NK 细胞生产文章总结
许多研究都评估了自然杀伤 (NK) 细胞作为潜在癌症治疗手段的效果。然而,在临床相关规模上获得原代人 NK 细胞具有挑战性。我们在符合现行药品生产质量管理规范 (cGMP) 环境的工作流程中生产了 1 × 109 个细胞。在整个培养过程中,NK 细胞保持 > 97% 的纯度,无异种扩增后,细胞显示被激活。本指南展示了无异种 NK 细胞扩增和关键单元操作封闭的可行性。
NK 细胞疗法
自然杀伤细胞发现于 20 世纪 70 年代早期,仅占外周血单核细胞 (PBMCs; 1) 的 5% 至 20%。NK细胞是通过CD56的表达和CD3的缺失来定义起表型的 (2, 3)。作为先天免疫系统的一部分,NK细胞在无需预敏化的条件下,在体外和体内都能有效杀死多种恶性细胞 (4-6)。恶性细胞识别受 NK 细胞表面抑制和激活受体复杂平衡的控制。自然杀伤细胞作为一种癌症疗法越来越受到关注 (7, 8),它们有助于移植物抗肿瘤 (GvT) 反应,但不会诱发移植物抗宿主病 (GvHD)。
对患有多发性骨髓瘤等癌症的患者,需要大约 5 × 106 至 1.2 × 107 个 NK 细胞/kg 的剂量 (9)。NK 细胞的一个现成来源就是从单采血中富集的PBMC。然而,如果供体没有接受动员剂的诱导,那么其PBMC中NK细胞只占一小部分。因此,为满足临床需求,尤其是在计划进行多次输注时,获取足够多数量的NK细胞很有难度。从 PBMC 中分离 NK 细胞已成为一个限制临床应用的重要瓶颈问题。因此,为了满足临床所需的大量细胞生产需求,我们需要制定一系列生产程序。
NK 细胞生产流程
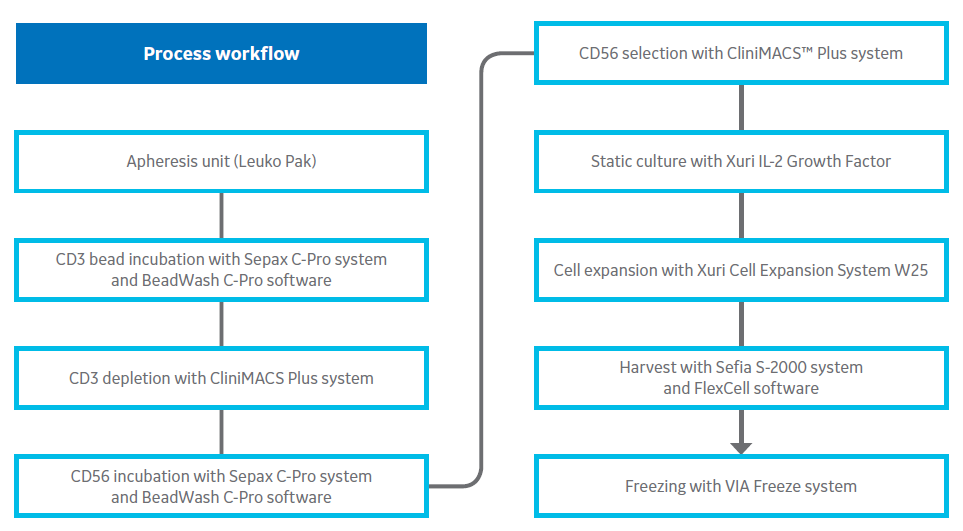
本文描述了在临床相关规模下生产人原代 NK 细胞的工作流程(图 1)。使用功能上封闭的半自动分离工艺获得 CD3‑/CD56+细胞。Sepax C‑Pro 细胞处理系统(BeadWash C‑Pro 程序)与 CliniMACS™ Plus 系统结合使用。然后在无异种的条件下,在无饲养细胞的情况下培养自然杀伤细胞。细胞达到所需体积和活细胞浓度后,转入 Xuri 细胞扩增系统 W25。培养结束后,使用支持自动化和功能封闭处理的 Sefia S‑2000 细胞处理系统处理细胞收获、浓缩、洗涤并使用100%的CS10冻存保护剂完成制剂。然后使用无液氮VIA Freeze控速降温仪冻存已制剂的细胞。定期检测培养物的特征表型和功能性杀伤效力。
总体上,我们展示了原代人 NK 细胞无异种扩增的可行性。分离步骤后,自然杀伤细胞纯度为 90%。在整个培养过程中,NK 细胞保持 > 97% 的纯度,扩增后显示细胞仍是激活状态。同时,扩增后的细胞在功能封闭系统中进行收获和冻存也展现了可行性。为了使生产流程更加符合药品质量管理规范(GMP)的要求,我们通过一项单独实验评估了使用不含 MicroBead 的生长因子来激活 NK 细胞。
图 1. 工艺流程。用于从新鲜外周血白细胞制备临床相关剂量 NK 细胞的步骤和系统图解。大多数步骤在功能上都是封闭和自动化的,并且工艺符合 GMP 指南。
材料和方法参见页底“相关信息”一节。
结果与讨论 - 大规模 NK 细胞生产
同预期一样,供体之间的扩增潜力存在很大的差异。NK细胞通过CliniMACS系统进行分离和纯化。尽管起始供体细胞存在差异,NK细胞的纯度在起始细胞中占比在4%-11%之间,纯化后的NK细胞纯度均提高至90%以上(图 2A、B)。高纯度的NK细胞在异体给药时可以显著降低GvHD的风险和严重程度,因此保持NK细胞的高纯度至关重要。
目前,CliniMACS 需要在细胞培养箱内的开放环境下孵育 MicroBead 和细胞。在本文中,我们采用 Sepax C‑Pro 细胞处理系统(搭配 BeadWash C‑Pro v412 程序软件)进行功能封闭和自动化的孵育。初始 CD3 MicroBead 孵育的收获率在 57% - 73.5%(平均 65%;图 2C)。该收获率与去除血小板的外周血白细胞内细胞占比率相当。CD56 MicroBead 孵育后的收获率在 98% - 103%(平均 100%;图 2C)。
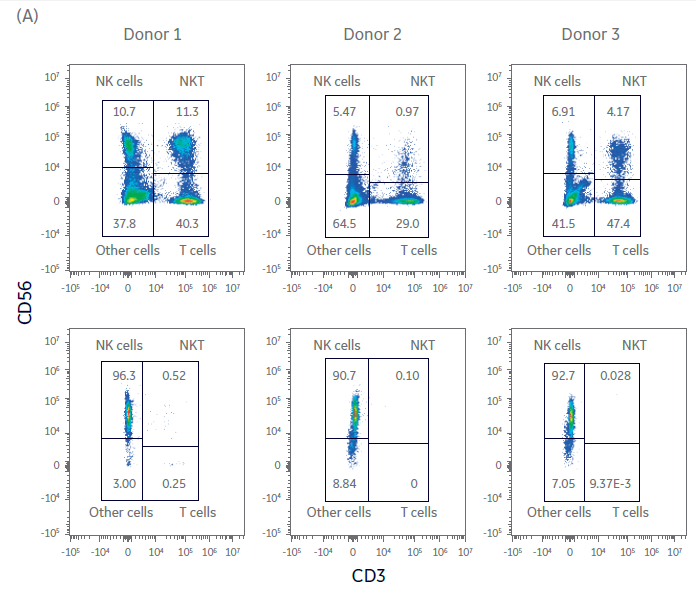
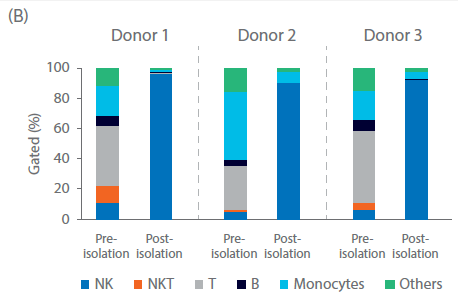
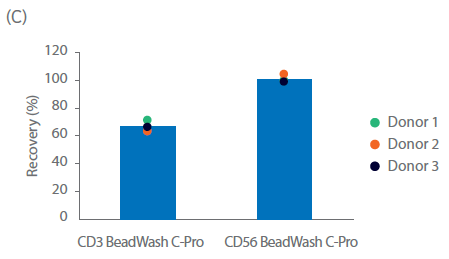
图 2. NK 细胞分离后的纯度与收获率。单采血样本在NK细胞分离程序前后的表型特征。(A) FlowJo™表示每个供体在第0天的门控细胞。(B) 用流式细胞仪测量供体1、2、3在第0天的细胞组分,显示NK细胞(CD56+/CD3-)、T细胞(CD56-/CD3+)、NK样T细胞(NKT,CD56+/CD3+),以及其他细胞,如单核细胞(CD14+)和B细胞(CD19+)。(C) 在Sepax系统上用BeadWash C-Pro程序孵育CD3或CD56 MicroBead后的活细胞收率。条状图代表了三份生物样本的平均值,每个点表示单独供体的数值。
分离后,细胞以无异种的方式扩增。细胞在含有Xuri IL-2和NK激活/扩增磁珠试剂的商品化无异种培养基中培养。细胞在静置培养期间内稳定扩增,然后转移至Xuri W25细胞扩增系统扩大培养。供体 1 的细胞在 Xuri Cellbag 生物反应器中生长特别好(几乎是静置培养的 10 倍)。供体 2 和供体 3 的细胞分别扩增了大约三倍和两倍。到第 20 天,累积细胞生长达到 2.6 × 109 至 7.4 × 109 个(图 3A)。在整个培养过程中,自然杀伤细胞纯度保持在 97% 以上(图 3C),在第 20 天NK细胞生产总数为 2.5 × 109 至 7.2 × 109 个(图 3B)。
关键的NK受体和激活标志物的表达情况通过表型分析检查(图 3C)。NKg2D 在自然杀伤细胞中组成性表达;在整个运行过程中,测量到NKp44在NK细胞上的表达量>93%。NKp44(NCR2)是一种天然的细胞毒性受体,在激活的自然杀伤细胞中上调。CD69 是一种激活标志物,是 T 细胞和 NK 细胞上最早的诱导性细胞表面糖蛋白之一。在上述培养中,培养开始时 NKp44 和 CD69 在不到 5% 的 NK 细胞中表达。在自然杀伤细胞激活后,直到培养结束,NKp44 和 CD69 在超过 90% 的 NK 细胞中表达。培养结束后,细胞则需洗涤并制剂,选用合适的缓冲液立即输注回病人体内,或者重悬至冻存液中冻存,然后通过冷链运输的方式转运至临床端。使用冷冻保护剂进行配制可实现冷冻保存,并可随后通过冷链运输至临床研究中心。
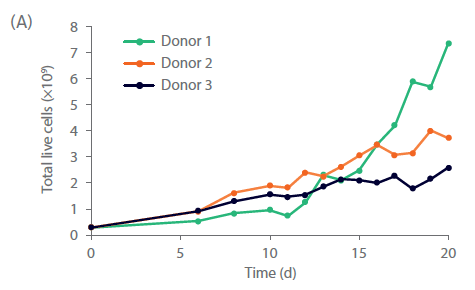
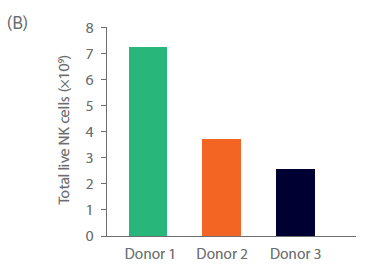
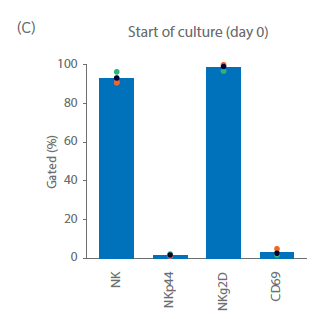
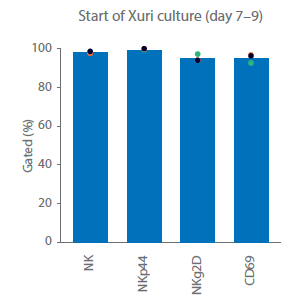
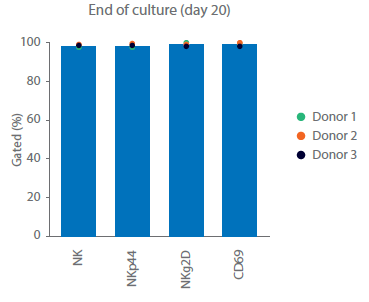
图 3. 细胞培养与表型。第 20 天供体 1、2 和 3 的 (A) 总活细胞和 (B) NK 细胞累积生长量。(C)在培养之前、期间和之后,通过流式细胞术测量 NK 细胞 (CD3‑/CD56+) 亚群 NKp44+、NKg2D+ 和 CD69+ 细胞。柱状图表示三份供体样本的平均值,点表示单个供体的值。
在本次生产流程中,扩增后的NK细胞的收获和后续的冻存制剂是通过Sefia系统完成的,然后进行冷冻保存。这种功能封闭、自动化、基于离心原理工作的的系统可浓缩、洗涤细胞,并通过缓冲液置换的方式将细胞重悬置冻存液中。在使用Sefia系统浓缩并洗涤细胞后,供体 1、2 和 3 的总活细胞收获率分别为 97%、91% 和 80%(图 4A)。收获后细胞活力平均下降了 8.5%(p = 0.0034,n = 3,双样本t检验,图 4A)。优化离心速度和时间等参数可以减少活力下降。
Sefia 系统中细胞收获前后的表型比较如图 4B 所示。在自然杀伤细胞纯度或 NK 细胞标志物 NKg2D/NKp44 和细胞激活标志物 CD69 的表达方面未发现统计学上显著的差异(p > 0.05,n = 3,双样本t检验)。
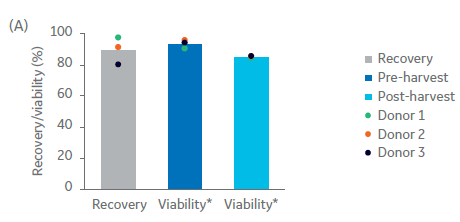
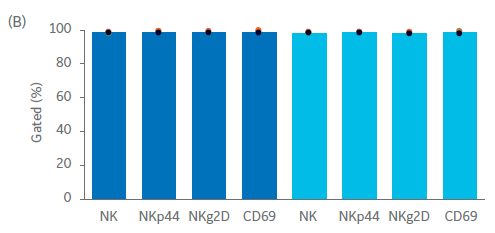
图 4. Sefia 收获前后 NK 细胞的收获率和表型。Sefia 收获前后 NK 细胞的特性。(A) 使用 Sefia 系统收获后供体 1、2 和 3 培养物的活细胞收获率与活力。(B) 收获前后 NK 细胞 (CD3‑/CD56+) 及其亚群(NKp44+、NKg2D+、CD69+)的百分比。柱状图表示三份生物样本的平均值,点表示单个供体的值。p < 0.05,n = 3,双样本t检验。
在培养开始和结束时,使用基于流式细胞术的方法评估针对 K562 细胞的 NK 细胞毒性。共孵育 5 h 后,测定靶向细胞死亡情况。结果如图 5 所示(图 5A - C 所示为一个供体的代表性散点图和门控分析,结果如图 5D 所示)。第 1 天静置的 NK 细胞杀死靶细胞的能力有限,即使在效应细胞:靶细胞 (E:T) 比为 5:1 的情况下也是如此(< 15% 的细胞死亡,图 5D)。然而,到第 21 天,在 5:1 的 E:T 比率下,靶向细胞杀死比例 > 70%。这些结果表明,即使在扩增后也存在功能激活的 NK 细胞。我们还在 Sefia 系统中对收获前后的 NK 细胞杀伤能力进行了比较(图 5D)。与表型一样,收获后的杀伤能力无统计学差异(双样本 t 检验,p > 0.05;n = 3)。
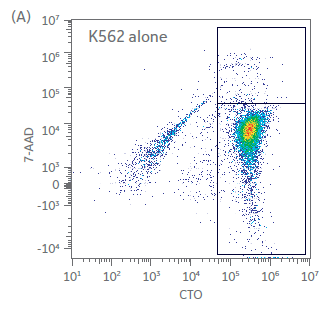
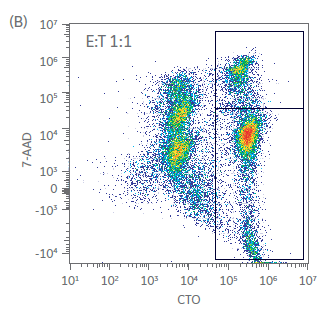
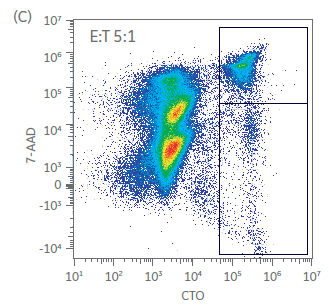
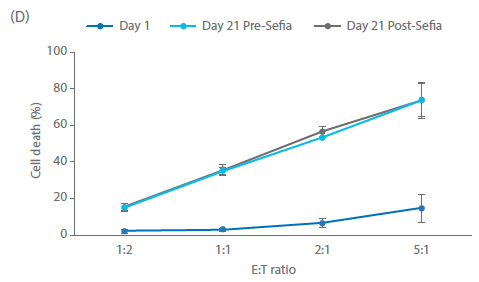
图 5. 杀伤效力。孵育 5 h 后,在不同效应细胞:靶细胞 (E:T) 比率下对 NK K562 共培养物反应中 NK 细胞毒性活性的 (A-C) 门控分析举例和 (D) 定量。显示了用 Sefia 系统收获前后的第 1 天和第 21 天培养物。Sefia 处理后,未检测到 NK 效力存在大的统计学差异。误差线代表标准偏差,p > 0.05;n = 3,双样本t检验。
Sefia 收获后,使用 VIA 降温系统将细胞冷冻保存在 CS10 培养基中进行冷冻。VIA Freeze是一款不依赖乙醇、异丙醇,且不使用液氮的程序降温仪。冻存管解冻后,复苏率和存活率平均 > 70%(图 6A)。冻存和复苏对 NK 细胞表型无影响,与培养结束时一样(图 6B)。为了提高复苏率,可对配方、冷却速度和解冻方法进一步优化。
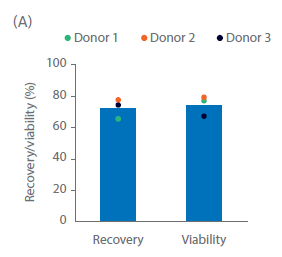
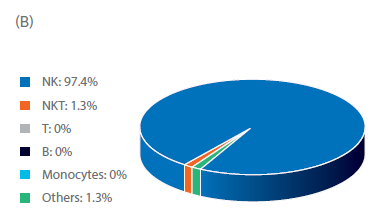
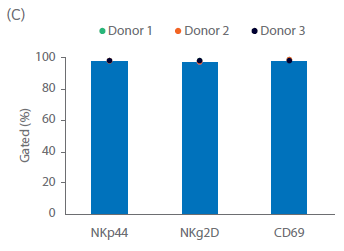
图 6 冷冻保存和解冻。(A) 在含 100% CS10 的冷冻瓶中冷冻保存的 NK 细胞的解冻后复苏率和活力。(B) 解冻的 NK 细胞保持纯度,(C) 培养结束时激活的 NK 细胞表型。柱状图表示三份生物样本的平均值,点表示单个供体的值。n=3。
结果和讨论 - 激活方法比较
使用抗原呈递细胞扩增自然杀伤细胞的方法已经比较常见。经证明使用饲养细胞可实现高倍数的扩增。然而,使用这种饲养细胞系统不太可能扩大规模。此外,如果未能从共培养物中去除饲养细胞,可能会对患者造成风险。另一种选择是使用磁性粒子,但目前的方法不符合 GMP 生产要求。作为替代,可使用高质量的细胞因子来激活和扩增细胞。作为细胞治疗生产辅料,Xuri IL‑2、Xuri IL‑15 和 Xuri IL‑21 生长因子符合 USP <1043>标准。
与NK细胞激活/扩增试剂盒珠和IL-2相比,我们测试了细胞因子的组合(Xuri IL-2、IL-15和IL-21生长因子的浓度分别为350 IU/mL、66.7 IU/mL和0.341 IU/mL)激活和扩增自然杀伤细胞的能力(图 7)。使用 QuadroMACS™ 系统手动分离,在所有四个供体中均获得了高纯度 (> 90%) 的 NK 细胞(图 7C)。虽然在不同供体之间,每日倍数存在差异,但是在使用Xuri生长因子后,所有供体来源的NK细胞均得到了扩增(图 7A)。然而,与单独使用细胞因子进行培养相比,IL‑2 联合 NK 细胞激活/扩增试剂盒通常有更高的日扩增倍数。结果差异无统计学意义(p ≥ 0.05,n = 4,双样本t检验)。
使用细胞因子而非激活磁珠激活和扩增自然杀伤细胞产生了相当的细胞活力(图 7B,双样本 t 检验 p ≥ 0.05,n = 4)和纯度(图 7C;双样本 t 检验 p ≥ 0.05,n = 4)。进一步优化细胞因子浓度、添加时间以及其他细胞因子组合,可使 NK 细胞激活和扩增更为稳健。
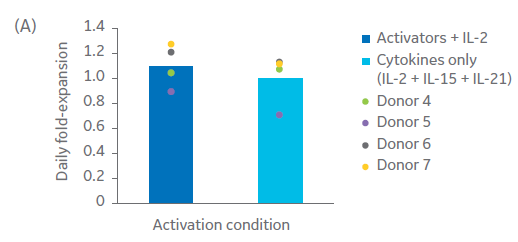
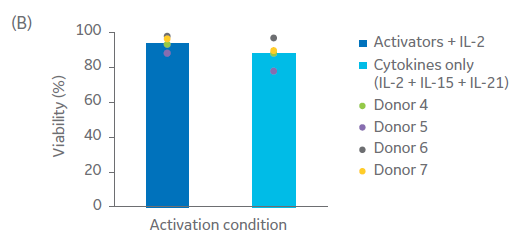
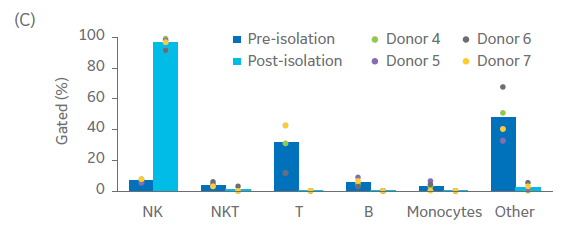
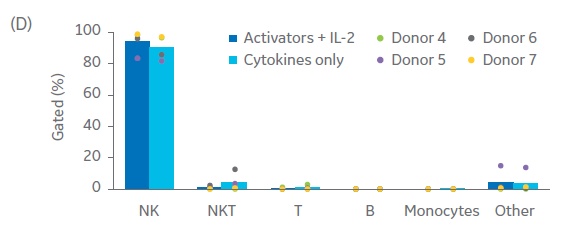
图 7. 激活方法比较。(A) 与使用补充有 IL‑2 的 NK 激活/扩增试剂盒激活的细胞相比,使用 Xuri IL‑2、IL‑15 和 IL‑21 生长因子联合激活的 NK 细胞在培养过程中的平均日扩增倍数,以及 (B) 第 20 天相应的存活率。流式细胞术检测培养物在 (C) 第 0 天和 (D) 第 20 天的表征。柱状图表示三份生物样本的平均值,点表示单个供体的值。
结论
在本文中,我们介绍了从外周血白细胞获取并无异种扩增自然杀伤细胞的工艺流程中无异种自然杀伤细胞扩增的工作流程。该工艺包括几个自动化和功能封闭的单元操作(图 1)。尽管输入细胞群存在显著的异质性且供体之间存在一定差异,但磁性分离后激活并扩增至临床相关剂量(每个供体 > 109 个细胞)产生了高纯度 (> 97% CD3‑/CD56+) 的 NK 细胞产物。从表型和功能上看,最终产物表现出激活 NK 细胞群的特征,对肿瘤细胞系具有强大的细胞毒性活性。
总体而言,本文介绍的方法与自然杀伤细胞生产的工业工作流程兼容。本指南介绍了无异种 NK 细胞扩增和关键单元操作封闭的可行性。未来的工作可以专注于微调每个步骤,进而获得稳健、可放大的工艺。例如,可以通过优化激活策略、冷冻保存参数和其他培养参数来提高细胞复苏率和活力。此外,改进试剂包装,以及在透气袋或封闭细胞培养瓶中进行静置培养,可能会使工作流程完全封闭。白膜层的小规模实验显示了细胞因子介导的激活的可能性。对该步骤进行优化可能会产生适用于 cGMP 制造环境的激活工艺。
致谢
所有工作均与 CCRM 合作进行,资金由 FedDev Ontario 和 Cytiva 在加拿大安大略省多伦多市的高级治疗细胞技术中心 (CATCT) 提供。感谢加拿大血液服务机构和供体为本项目提供研究样本。研究结果的报告和解释有本文作者负责。本文中的观点不代表加拿大血液服务机构的观点。
参考文献
- Herberman, R.B.et al. Natural cytotoxic reactivity of mouse lymphoid cells against syngeneic and allogeneic tumors.II. characterization of effector cells.Int J Cancer16:230–239 (1975).
- Cooper, M.A.et al. The biology of human natural killer‑cell subsets.Trends Immunol.22:633–640 (2001).
- Barao, I. and Ascensao, J. L. Human natural killer cells.Arch.Immunol.Ther.Exp.Warsz.46:213–229 (1998).
- Lee, S. H. et al. Keeping NK cells in highly regulated antiviral warfare.Trends Immunol.28:252–259 (2007).
- Marcus, A. et al. Recognition of tumors by the innate immune system and natural killer cells.Adv.Immunol.122:91–128 (2014).
- Shook, D. R. and Campana, D. Natural killer cell engineering for cellular therapy of cancer.Tissue Antigens 78:409–415 (2011).
- Pittari, G. et al. Revving up natural killer cells and cytokine‑induced killer cells against hematological malignancies.Front.Immunol.6:230 (2015).
- Rezvani, K. and Rouce, R. H. The application of natural killer cell immunotherapy for the treatment of cancer.Front.Immunol.6:578 (2015).
- Cheng, M. et al. NK cell‑based immunotherapy for malignant diseases.Cell Mol.Immunol.10:230–252 (2013).
订购信息
| 产品 | 产品代码 |
| HyClone 青霉素‑链霉素 100X 溶液 | SV30010 |
| HyClone SG‑200(稳定 L‑丙氨酰‑L‑谷氨酰胺) | SH30590 |
| HyClone Dulbecco 磷酸缓冲盐水 (DPBS),10× | SH30378 |
| Xuri IL‑2 生长因子 | 29062789 |
| Xuri IL‑15 生长因子 | 29112116 |
| Xuri IL‑21 生长因子 | 29112119 |
| Sepax C‑Pro 细胞处理仪 | 29264741 |
| BeadWash C‑Pro 程序软件 | 29286433 |
| Xuri 细胞扩增系统基础型细胞培养袋,2 L | 29108442 |
| XURI CP CELLBAG 2L PERF | 29279170 |
| Xuri 细胞扩增系统 W25 | 29064568 |
| Sefia S‑2000 细胞处理仪 | 29285527 |
| FlexCell Sefia 配套程序软件 | 16301 |
| VIA Freeze Duo 控速降温仪 | VFD_30006 |
材料与方法 - 大规模 NK 细胞生产
NK 细胞分离
NK 细胞分离涉及 CD3 阴选和之后的 CD56 阳选步骤。采用 BeadWash C‑Pro 程序软件,在 Sepax C‑Pro 细胞处理系统 (Cytiva) 中,将三个完整包装的 Leuko Pak (STEMCELL Technologies) 分别与 CliniMACS CD3 MicroBead (Miltenyi Biotec) 一起孵育(表 1)。根据操作手册,通将 BeadWash C‑Pro 程序的终产品袋通过一个穿刺口与 CliniMACS LD Depletion Tubing Set (Miltenyi Biotec) 相连,并使用 CliniMACS Plus 系统运行Depletion Protocol 3.1。
然后使用 BeadWash C‑Pro 程序软件,将 CD3‑ 组分与 CliniMACS CD56 MicroBeads (Miltenyi Biotec) 一起在 Sepax C‑Pro 中孵育(表 1)。根据操作手册,将 BeadWash C‑Pro 程序的终产物袋无菌焊接到 CliniMACS Tubing Set LS (Miltenyi Biotec) 上,并在 CliniMACS Plus 系统上运行CliniMACS Protocol 1.1 Enrichment程序。
无异种静置培养
在市售无异种培养基中加入稀释至工作浓度 (1% P/S, Cytiva) 的 HyClone 青霉素-链霉素溶液,制备 NK 培养基。根据生产商的程序,使用 NK 激活/扩增试剂盒 (Miltenyi Biotec) 激活自然杀伤细胞,并补充 350 IU/mL 的 Xuri IL-2 生长因子 (Cytiva)。将细胞接种到细胞培养用的多孔板或培养瓶中,并以 1 × 106 个细胞/ mL 的密度接种。细胞在培养箱内(37°C, 5% CO2 )孵育6天,用以完成激活。
6 天后,对细胞进行计数,并稀释至 1.5 × 106 个细胞/mL。将细胞静置培养,直至终体积500mL,细胞密度达到 2 × 106 个细胞/mL。这一过程需要 8-10 天。然后,将细胞转移至 Xuri 细胞扩增系统 W25。
Xuri W25 扩增系统中的无异种扩增
使用新鲜和条件培养基各 100 mL(总体积 200 mL)对 2 L Xuri Cellbag 生物反应器 (Cytiva) 进行预处理。培养基与静置培养中使用的配方相同。在制备条件培养基时,从细胞培养瓶中取 100mL NK 细胞悬液进行离心 (400 × g, 5 min)。然后将上清液转移至 600 mL 转移袋 (Fresenius Kabi) 中。将 Cellbag 生物反应器在 37°C 下平衡 2 h,然后以 2 × 106 个细胞/mL 的密度孵育 NK 细胞。
每天取样,并加入培养基,直至总体积达到 1 L。然后,根据活细胞密度开始灌流(表 2)。保持灌流速率的目的是
将乳酸水平保持在 25 mM 以下。在 Xuri W25 扩增系统中的整个培养持续时间内,Cellbag生物反应器以 6 rpm 的转速和 6° 的角度摆动。
收获
扩增后的自然杀伤细胞通过 Sefia S‑2000 细胞处理系统 (Cytiva) 和 FlexCell 程序软件进行收获。简言之,以 75 mL/min 的流速将 NK 细胞的体积从 1 L 减少至 20 mL。然后,使用不含钙或镁的 Dulbecco 磷酸盐缓冲盐 (DPBS‑/‑, Cytiva) 洗涤两个循环,补充 1 mM 乙二胺四乙酸 (Sigma) 和 2% 热灭活人血清 AB (Gemini)。用 400 × g 清洗 5 min。最后NK细胞在 100mL NK 基础培养基(与静置培养所用的市售培养基相同,无补充物)中重悬收集。
表 1. BeadWash C‑Pro 参数
| 参数 | BeadWash C‑Pro CD3 阴选 | BeadWash C‑Pro CD56 阳选 |
| 初始体积 | 120 mL | 220 mL |
| 检测初始体积 | N | N |
| 稀释比 | 0 | 0 |
| 稀释速度 | 17 mL/min | 17 mL/min |
| 稀释后混合 | 60 s | 60 s |
| 解冻袋验证 | N | N |
| 悬挂袋验证 | N | N |
| 输入袋冲洗 | Y | Y |
| 输入袋冲洗体积 | 100 mL | 100 mL |
| 输入袋冲洗时暂停 | N | N |
| 光学细胞检测 | Y | Y |
| 暂停/交换清洗袋 | N | N |
| 中间体积 | 30 mL | 30 mL |
| 前洗循环数 | 1 | 0 |
| 前洗离心力 | 85 × g | 300 × g |
| 前洗时长 | 420 s | 300 s |
| 磁珠体积 | 30 mL | 30 mL |
| 孵育体积 | 102.5 mL | 102.5 mL |
| 孵育时间 | 30 min | 30 min |
| 混合间歇时间 | 6 s | 6 s |
| 暂停/切换废液袋 | 关闭 | 关闭 |
| 后洗循环次数 | 1 | 1 |
| 孵育后清洗 | 不适用 | 不适用 |
| 后洗离心力 | 300 × g | 300 × g |
| 后洗时长 | 900 s | 900 s |
| 最终体积 | 150 mL | 150 mL |
| 暂停/切换重悬 | N | N |
| 手动提取 | N | N |
| 手动提取用注射器 | N | N |
表 2. Xuri W25 扩增系统中 NK 细胞的灌注速率
| 活细胞密度 | 灌注速率 |
| 2.0 × 106 个细胞/mL | 0.5 L/d |
| 1.0 × 107 个细胞/mL | 0.75 L/d |
| 1.5 × 107 个细胞/mL | 1 L/d |
效价测定
NK 细胞效价通过针对红白血病细胞系 K562 (ATCC) 的杀伤测定法测量。在 K562 培养基中培养 K562 细胞,在制备该培养基时,在 RPMI‑1640 (Thermo Fisher Scientific) 中补充 5% 热灭活胎牛血清 (Sigma)、1% HyClone SG 200(稳定 L-丙氨酸-L-谷氨酰胺;Cytiva)和 1% P/S。在 37°C 下,在 K562 培养基中用 2.5 μM CellTracker™ Orange (Thermo Fisher Scientific) 将 K562 细胞染色,持续 30 至 60 min。将染色细胞在 K562 培养基中清洗两次,并以不同的效应细胞:靶细胞 (E:T) 的比率将 NK 细胞添加到 96 孔圆底板上。使用不含 NK 细胞的 K562 细胞对照孔评估背景细胞凋亡。将细胞在 37°C 下孵育 5 h,然后用 400 × g 的速度离心 5 min。弃去上清液,进行 7-氨基-放线菌素 D (7-AAD) 染色(溶于DPBS-/-中,0.1 μg/ 孔;BD Biosciences)。将细胞在室温下孵育 5 min,然后在 CytoFLEX™ 流式细胞仪 (Beckman Coulter) 上运行。使用以下公式计算特定细胞死亡百分比:
表型分析
使用标准程序通过流式细胞术分析自然杀伤细胞群。简言之,洗涤 1 × 106 个细胞,并用人 FcR 阻断试剂 (Miltenyi Biotec) 进行阻断,然后用来自 BD Biosciences 的抗体染色:CD45‑APC‑Cy™7 (560178)、CD14‑FITC (555397)、CD3‑PE (555333)、CD19‑APC (555415)、CD56‑BV421 (562751)、NKp44‑BB515 (566025)、CD69‑BV650 (563834) 和 NKg2D‑APC (562064)。在 CytoFLEX 系统上分析染色的细胞。
冷冻保存
将 NK 细胞以 400 × g 的速度离心 5 min,并重悬于低温 (4°C) 100% CryoStor™ CS10 (BioLife Solutions) 中,达到细胞密度为 2.5 × 107/mL。将悬液以 1 mL 等份转移至冻存管中,然后放入 VIA Freeze Duo 无液氮、可控速率程序降温仪 (Cytiva) 内的冷却架 (4°C) 中。运行 VIA 冷冻程序,以 ‑1°C/min 的速率冷却细胞,直至温度达到‑100°C。然后,将冻存管转移到液氮罐中,以便在气相中长期储存。解冻冻存管后评估细胞复苏率、活力和表型。使用 NucleoCounter™ NC‑200 测定细胞复苏率和活力。使用流式细胞术测定表型。
材料和方法 - 激活方法比较
四名健康供体(供体 4、5、6 和 7)的白膜层购自 Canadian Blood Services。根据生产商的程序,使用 Ficoll‑Paque PLUS (Cytiva) 对白膜层进行处理,以分离 PBMC。使用 QuadroMACS™ 分离器 (Miltenyi Biotec) 对 PBMC 中的 NK 细胞进行富集。简言之,使用 CliniMACS CD3 MicroBeads 阴选 CD3 细胞,并通过 LD 柱 (Miltenyi Biotec)。然后用 CliniMACS CD56 MicroBeads (Miltenyi) 孵育CD3-组分,并通过 LS 柱 (Miltenyi Biotec)。阳性部分含有富集的 NK 细胞。
使用 NK 细胞激活/扩增试剂盒 (Miltenyi Biotec)、生长因子组合或同时使用两种方法激活和扩增富集的自然杀伤细胞。生长因子组合中 Xuri IL-2、Xuri IL-15 和 Xuri IL-21(均来自 Cytiva)的浓度分别为 350 IU/mL、66.7 IU/mL 和 0.341 IU/mL。第 6 天后,每 2 天进行一次细胞计数,并稀释至 1 × 106 个细胞/mL。