新冠疫情迫使政府和生物制药公司以前所未有的速度加强合作,从而推进产品审批,保障公众利益。Cytiva 的最新研究表明,这种趋势或将促成未来监管制度的不断完善,进而帮助患者更快地获得有价值的治疗。
在新冠疫情之前,药品开发很少用“迅速”一词进行描述。常见的原因包括候选药品数量众多、且损耗率高。另一个不可否认的因素是,用来衡量药品有效性和安全性的监管程序,不得不依赖于一系列漫长的研究与试验的结果。
Cytiva 的销售、服务和商业运营高级副总裁 Amanda Halford 表示:“一个新产品推向市场通常需要 10 年,这是行业基准。”疫情改变了这个状况。疫苗开发速度如此之快,她解释道,部分原因是公共卫生面临的紧迫风险,促使监管者基于通常的审批标准,采取同时而非依次审查结果的方式,从而加快审批速度。
药品开发呈现良好势头
许多国家和地区都加快了药品开发的速度。在 2020 年末和 2021 年初, Cytiva 进行的 全球生物制药弹性指数调查发现,70% 的受访者用“好”或“非常好”来评价本国药品审批机构的速度。
大多数药品审批机构并没有制定新法规,而是基于已有权限临时批准了药品。有些机构运用了简单直接的法规。例如,新加坡卫生科学局设立了大流行病特别通道(Pandemic Special Access Route),用于在大流行中授权新的干预措施。在一些其他地方,政府扩展了已有法规的应用范围。过去,美国食品药品管理局(FDA)、欧洲药品管理局(EMA)和英国药品与保健品管理局(MHRA)的疫苗紧急和临时授权规则,通常只适用于非常有限的情况,例如罕见病药品。
然而,许多国家和地区没有这些可以再利用的法规。国际疫苗研究所总干事 Jerome Kim 表示:“在疫情早期,监管机构在诊断、再利用药物和疫苗方面承受了巨大压力。而各国争相快速且系统地审查申请,则可能引发审查仓促或不完整的质疑。"
将疫情期间的经验付诸实践
对于监管的未来,疫情期间的工作提供了两个经验。首先,在确保安全性的情况下,加快监管决策速度和药品获取速度是可行的。其次,就何时以及如何实行这样的监管,公众希望出台明确的规定。
大多数生物制药公司高管希望,这种加快监管行动的势头可以得到保持。最近, Cytiva 对全球500 名生物制药高管进行了一项调研,60% 的受访者预计,未来两年,药品审批速度将会加快,而只有 19% 的人认为可能会放缓。51% 的受访者表示,政府的更多参与,加快了新药的上市速度,持相反观点的人只占25% 。
生物制药公司高管预计,药品审批将会加快
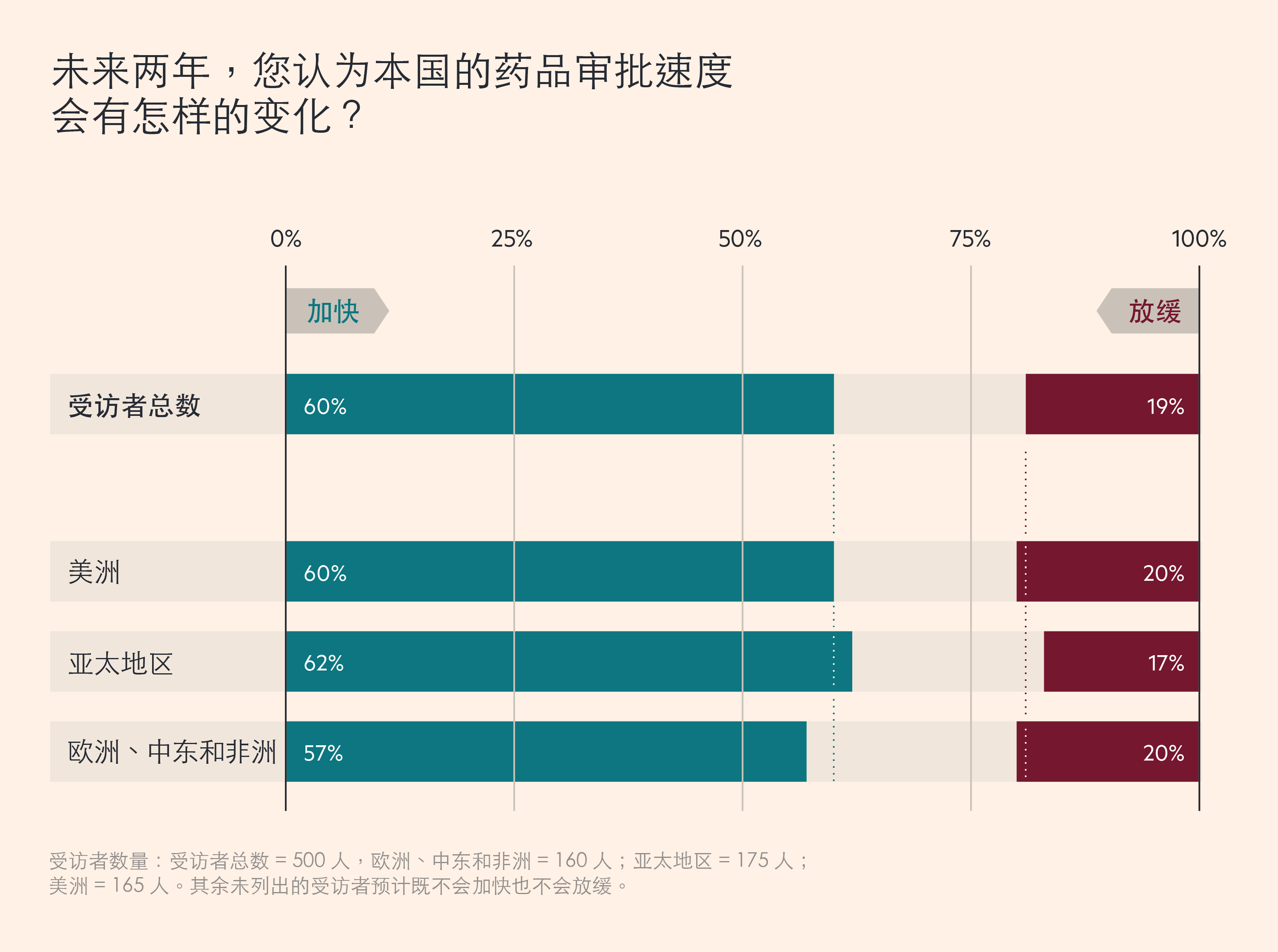
这些数字意味着,不同的司法管辖区内,变化速度亦有不同。例如,在欧洲,63% 的英国受访者认为,当前的政府干预正在加快药品上市速度,但在德国,这一比例仅为 43%。
协作加速审批进程
加速审批,并不代表在评估安全性和有效性时走捷径。相反,其目的是减少不必要的延误。
以阿布扎比为例,政府对一项新临床试验所需的步骤进行了深入研究,进而将一个长达数月的过程缩短为8 到 15 天。这些新规将使当地试验的开展,变得更加容易。
更为重要的是,临床研究者和监管机构改进了共享信息的方式。Jerome Kim 回忆说,随着监管机构开始允许分批提交临床实验数据, “疫情期间的学习曲线” 出现了。“美国食品药品管理局实行了这一举措,”他表示,"其他国家和地区也采用了类似的机制。"
这是疫情期间更广泛的信息共享的一部分。Amanda Halford 解释说,虽然新冠疫情之前,监管机构与临床研究者的联系已然存在,“但疫情的确加速了这种沟通。你能看到联系变得更为频繁。”她指出,这始于疫苗开发方面的合作,例如美国的“神速行动”(Operation Warp Speed)计划和英国疫苗小组(UK Vaccine Taskforce)等创新举措。这些合作后来扩展到了疫苗价值链的其他地方,“然后进入到供应链问题的分支领域,例如规模与制造,” Halford 补充说。
约半数生物制药公司高管认同,政府参与加快了新药的上市速度
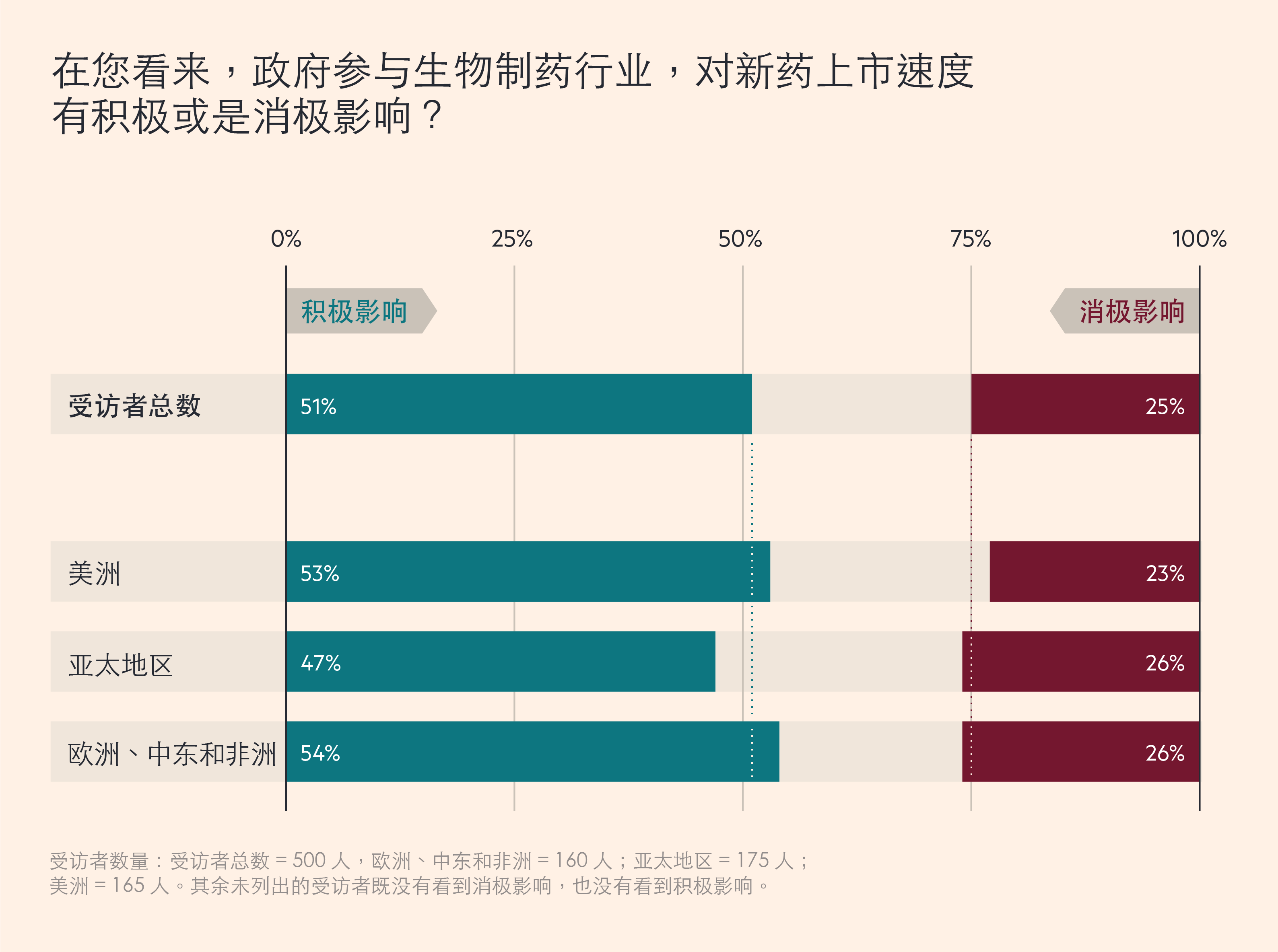
这种广泛互动改善了政府与生物制药行业的长期关系。FUJI FILM Diosynth Biotechnologies 首席执行官 Martin Meeson 表示:“当下政府与整个行业沟通、合作的方式与水平,让我对未来充满期待。”与此同时,他认为,现在的挑战是如何在未来五年保持这一势头。
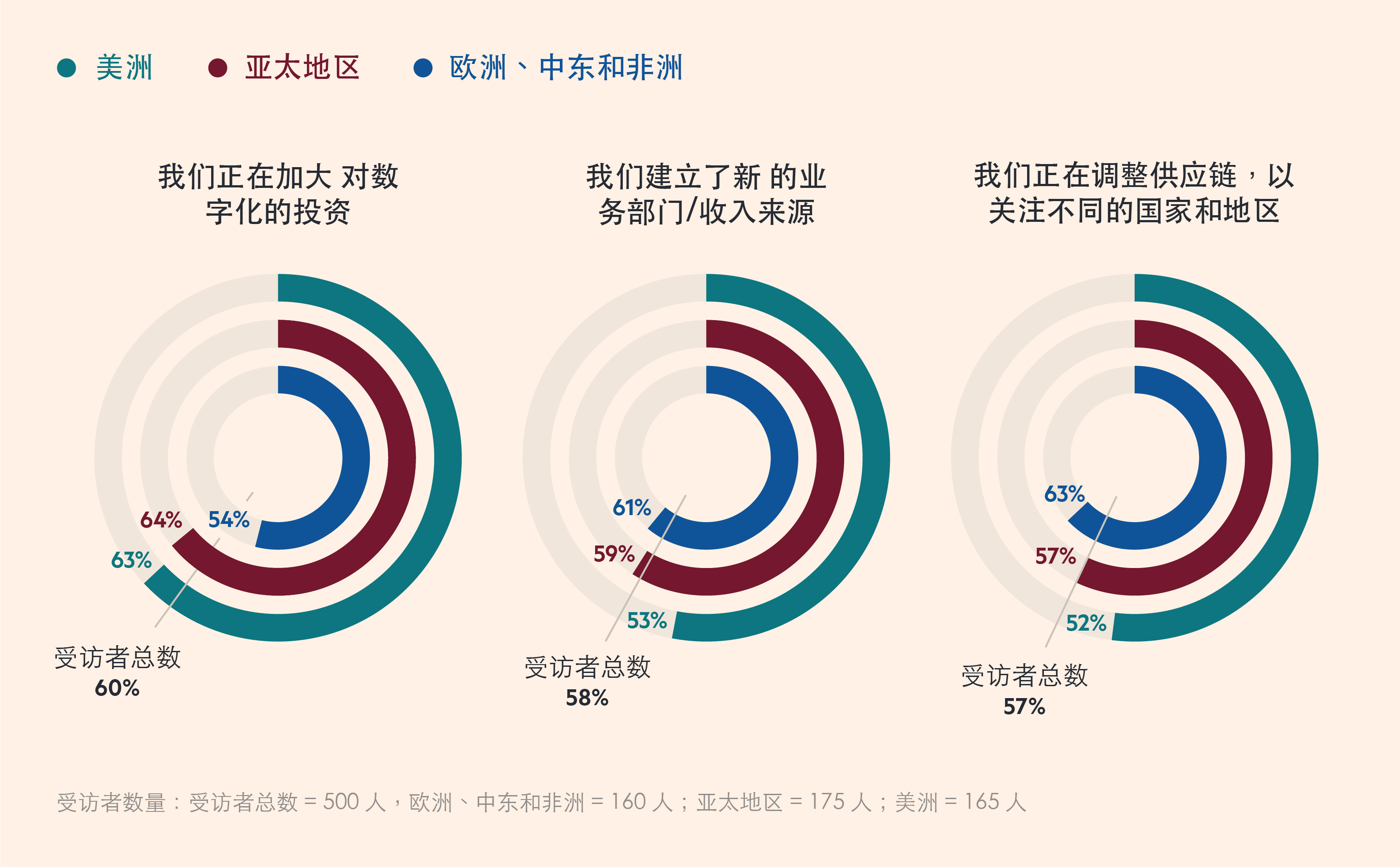
政府参与的增加,正在改变生物制药发展战略
随着合作关系的加深,广泛的数据共享使知识产权变得更为重要。在这方面,52% 的受访者认为,政府的参与产生了积极影响,而只有 27% 的人认为影响是消极的。
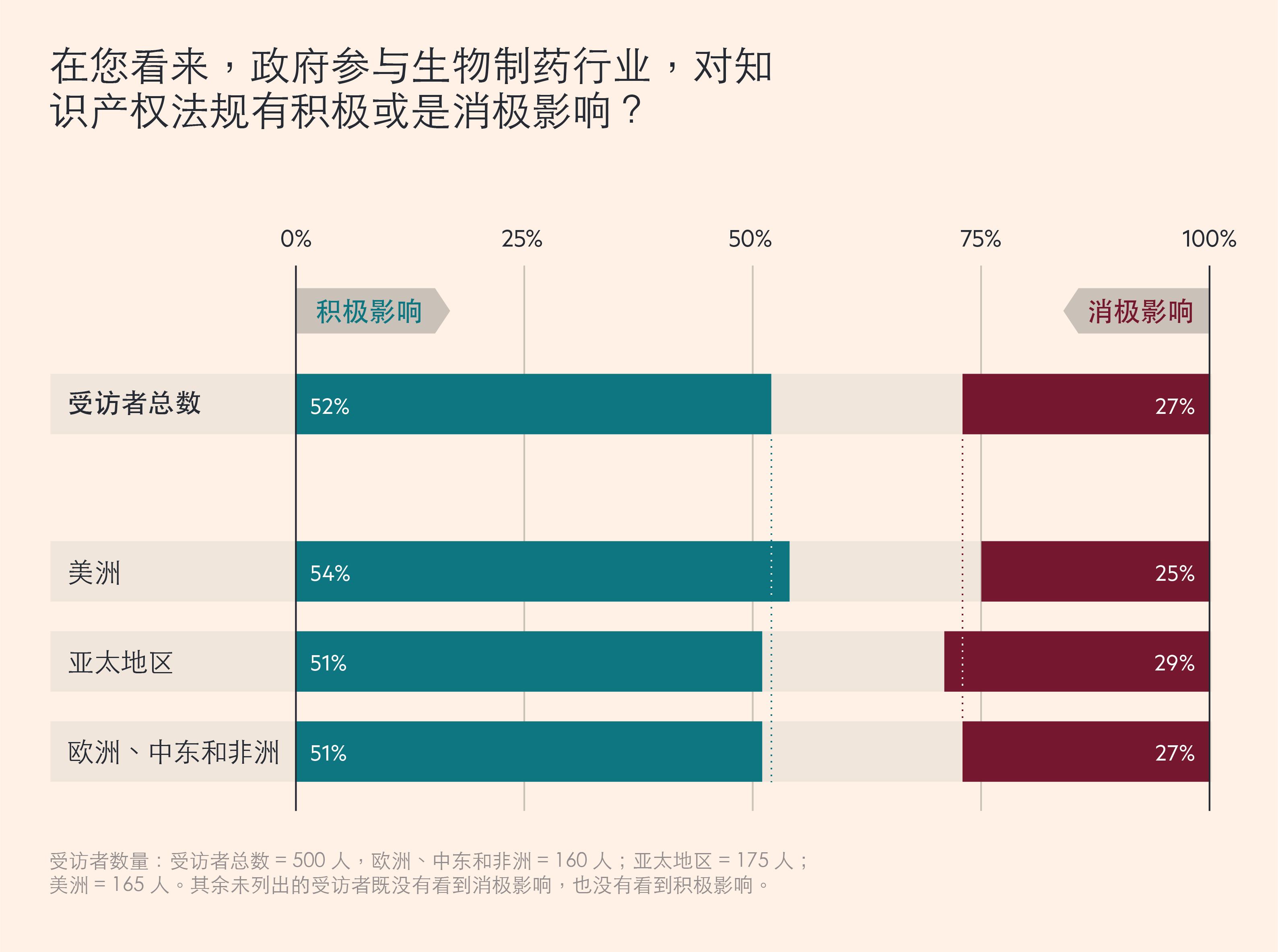
然而,仔细观察不难发现,在不同国家和地区,政府参与对知识产权的影响也不尽相同。例如,印度在新冠疫情达到顶峰时,停止了疫苗的出口,当地只有 46% 的受访者认为,政府干预对知识产权产生了积极影响,而 36% 的受访者表示,这种影响是消极的。而中国在疫情期间,不断寻求扩大全球疫苗市场,则有58%的受访者认同积极影响,仅 18%的人认同消极影响。
清晰、健全的知识产权保护法规绝不仅是锦上添花。在 Halford 看来, 这是“整个(药品开发)过程所需框架的重要组成部分。”如果缺失保护法规,投资可能性会不可避免地降低,而这将减缓新疗法的开发与获取速度。
基于监管的必要性
赋予药品审批规则新的灵活性、推动监管行动的新速度,是政府和制药公司扩展合作的一部分。54% 的受访者表示,他们的高管正在与政府领导或代表进行更密切的合作。只有 15% 的人持相反意见。
合作的方式多种多样。它可以像韩国 20 亿美元的 K 疫苗计划一样,通过大量投资,增强本土的综合研发与制造能力。
而在一些其他地方,仅仅依靠疫情期间的监管进步,就可能会产生显著效果。海湾国家就是例证。在新冠疫情之前,当地缺乏强大的制药研发或制造基地。不过,这些国家树立了一个简单的政策目标:面对疫情,成为最快批准并获得新的医疗干预措施的一批国家。为了实现这个目标,就必须对研发、知识产权和药品审批方面的法规进行彻底改革。结果不言自明——它们成为了全球第一批审查、许可、推出疫苗和后续治疗的国家。
即使在疫情没有带来重大监管变革的地方,专家们也感受到了监管进步的必要性。例如,中国医药企业管理协会会长郭云沛表示,中国的“制度还在不断完善,我们必须要简化药品审批流程,与世界接轨。”
国家和地区的发展水平不同,走出的道路也各具特色,但每个地方都可以在疫情中汲取一般经验并受益。“如何发扬在疫情期间形成的积极工作方式,并将其用于其他疗法的开发,政府和行业都感到了肩头的责任,”Meeson 补充道,“我们积累了很多宝贵的知识,现在我们需要把它付诸实践。”