作者:Ryan Zolyomi、Ian Scanlon*、Florence Rusly、Oliver Hardick*、Ashley Hesslein、Hendri Tjandra。
生物工艺开发 – 分离与纯化,Bayer U.S.LLC, Pharmaceuticals 和 Cytiva*
在临床用单克隆抗体 (mAb) 的生产中,使用蛋白 A 层析填料进行捕获即可实现出色的回收率和纯度。然而,与全面规模化生产相比,临床批次规模小,因此所需的循环数也少;这意味着很难实现填料的完整生命周期。拜耳与 Cytiva 合作评估了一种基于纤维的替代品 Fibro PrismA,旨在确定其作为真正一次性 mAb 捕获技术的潜力。我们评估了从实验室规模至工艺开发规模的可放大性,通过多次循环跟踪测定压降、步骤回收率、纯度和洗脱液体积。
与蛋白质 A 填料工艺相比,Fibro 层析的初始工艺建模表明其生产率大幅提高,但缓冲液消耗量和洗脱液体积稍高。如果对设施匹配有要求,可以通过优化来进一步降低这些体积。因此,Fibro PrismA 的效用适用于产品商业化。
通过我们的现有平台评估匹配度
在我们当前的 mAb 平台工艺中,层析填料是全面实现一次性工艺的主要障碍,而一次性工艺可以提供轻松、快捷的生产方案切换。这种工艺还将为生产多种产品的厂家带来操作灵活性。我们本着这样的目标对捕获步骤中使用的 Cytiva Fibro PrismA 层析填料进行了评估。 Fibro 层析填料使用成分明确的纤维素纤维基质,相对于层析微球或膜吸附器具有更加开放的结构。其专有结构能够克服填充床层析纯化的扩散和流速限制以及膜吸附器的载量问题(见图 1)。
图 1. 不同层析基架的表面积和传质机制。
我们考虑采用 Fibro 技术的原因之一是在一天内运行的循环次数更高,使得 Fibro 单元的使用寿命可以在单个批次生产中得到充分利用。尤其是在需要产品周转或小批量生产的情况下,该技术不需要装柱、清洁验证和存放层析柱,从而能够大大提高一次性层析单元在临床和商业生产中的效率。
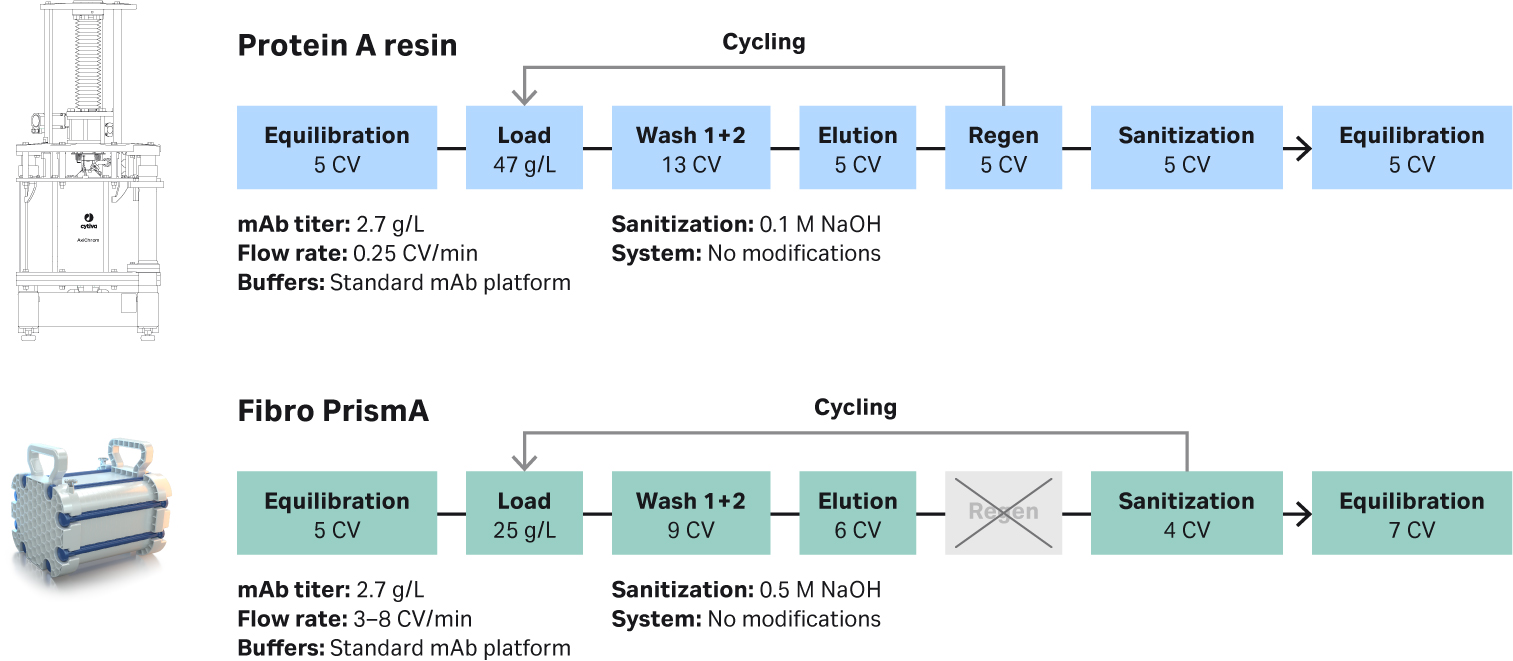
我们设计了一组实验,旨在使用标准的工艺放大参数对实验室规模到工艺开发规模中不同大小的 Fibro PrismA 单元的使用寿命和可放大性进行评估。我们开发的平台工艺见图 2。实验室实验表明,可以通过减少柱体积 (CV) 和取消层析柱再生步骤来优化 Fibro PrismA 的循环时间。相比基于蛋白 A 填料的典型工艺,Fibro PrismA 的流速明显快得多。流速可以通过系统硬件(例如层析撬组)进行限制,而不是限制 Fibro 设备流速。使用 Fibro 单元可以相当迅速地完成一次完整的层析操作,从而在需要纯化的上样体积相同的情况下,更快地完成循环。
图 2. 在 mAb 平台纯化中,使用 Cytiva MabSelect SuRe™ LX 基于蛋白 A 填料工艺(上)和 Fibro PrismA 工艺(下)的效果比较。
我们将某 mAb 的 500 L 澄清细胞培养液 (CCCF) 分成多次层析操作,见表 1。
表 1. 从实验室规模到工艺开发规模对 Fibro PrismA 进行评估
| HiTrap™ Fibro PrismA (0.4 mL) | HiScreen™ Fibro PrismA (3.75 mL) | Pilot Fibro PrismA (40 mL) | Large Pilot Fibro PrismA (160 mL) | Process Fibro PrismA (2.4 L) | |
| 循环时间 | 3.5 min | 4.5 min | 4.5 min | 12 min | 12 min |
| mAb 上样量/循环 | ~ 12 mg | ~ 90 mg | ~ 1 g | ~ 4 g | ~ 55 g |
| 循环 | 250 | 200 | 200 | 101 | 16 |
| 层析系统 | ÄKTA™ avant 25 | ÄKTA™ avant 150 | ÄKTA™ pilot 600 | ÄKTA ready | ÄKTA ready |
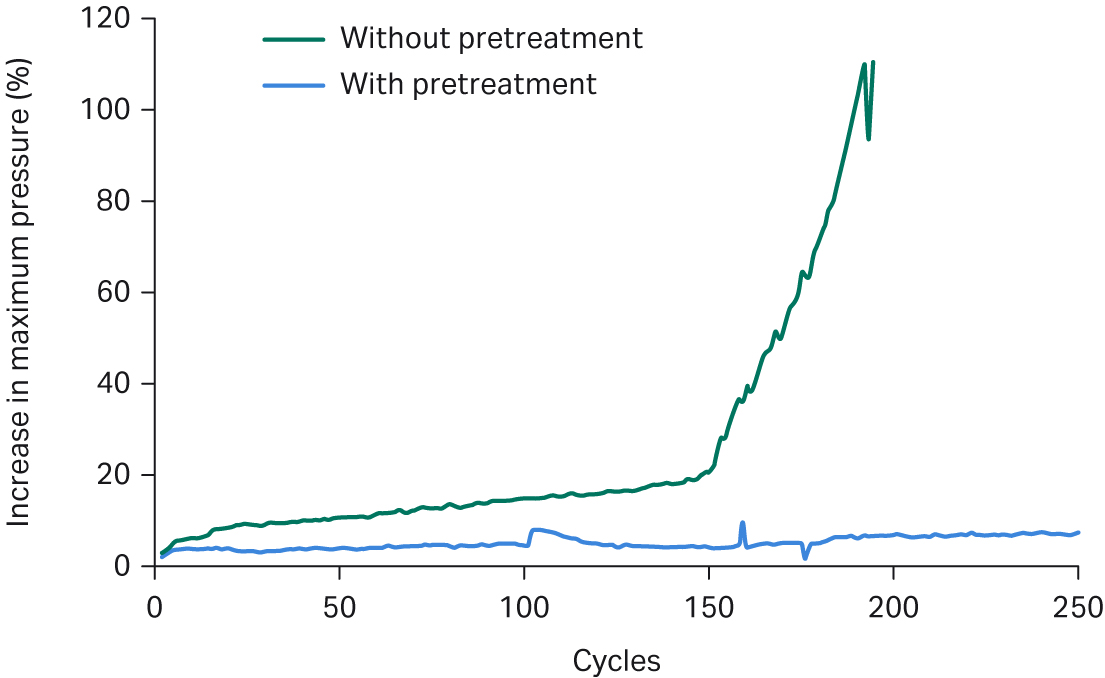
进一步过滤已澄清的收获物,再上样至 Fibro PrismA 单元中。我们的研究显示,这种进一步过滤能使多个循环中的污物和压力增量降至最低,从而使 Fibro 单元的使用寿命延长 40%(见图 3)。虽然对基于填料的工艺进行使用寿命研究需要大量时间和资源,但不到 24 小时即可对 Fibro PrismA 单元的两种进样方式进行使用寿命研究。这使得我们能够快速证明,采用额外的过滤步骤可以大幅降低循环中的压力增量,从而显著延长 Fibro 单元的使用寿命。
图 3. 针对 Fibro PrismA 单元的循环研究(上样前进行过滤和不进行过滤)。
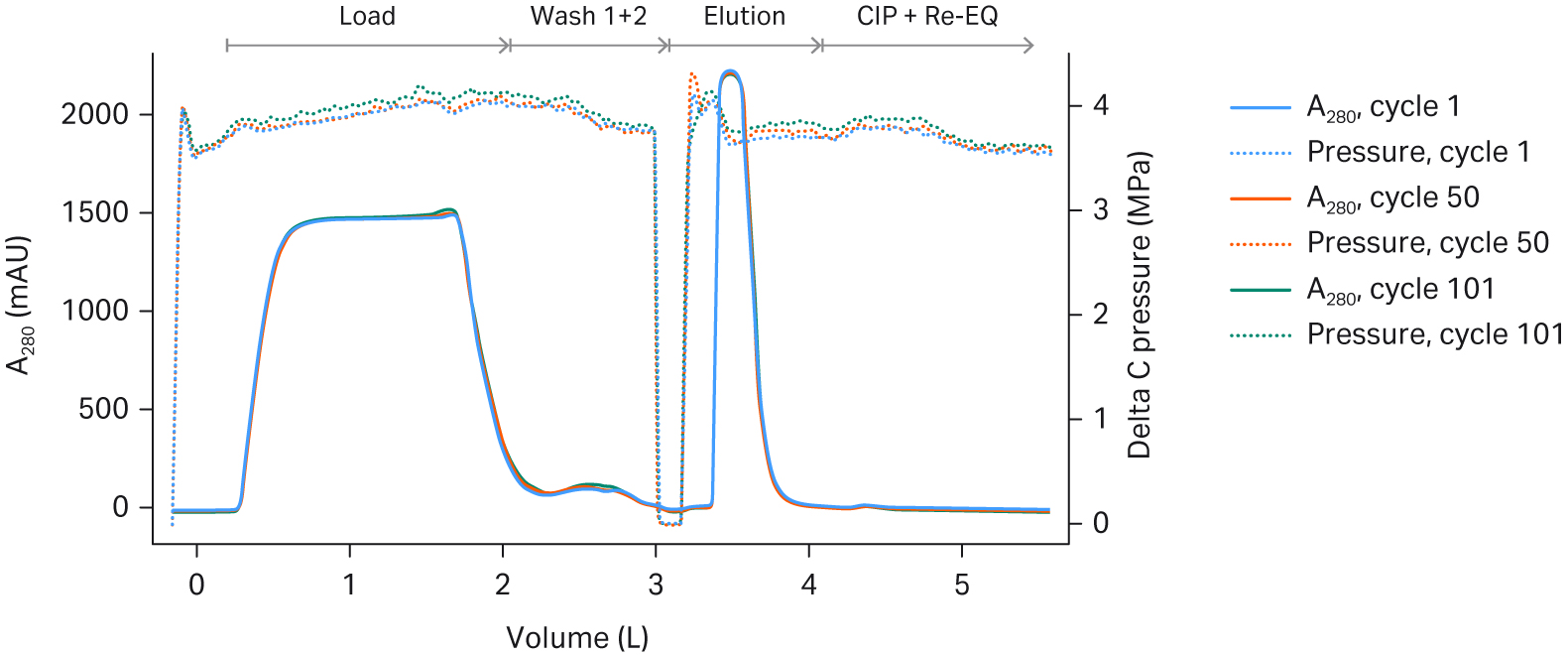
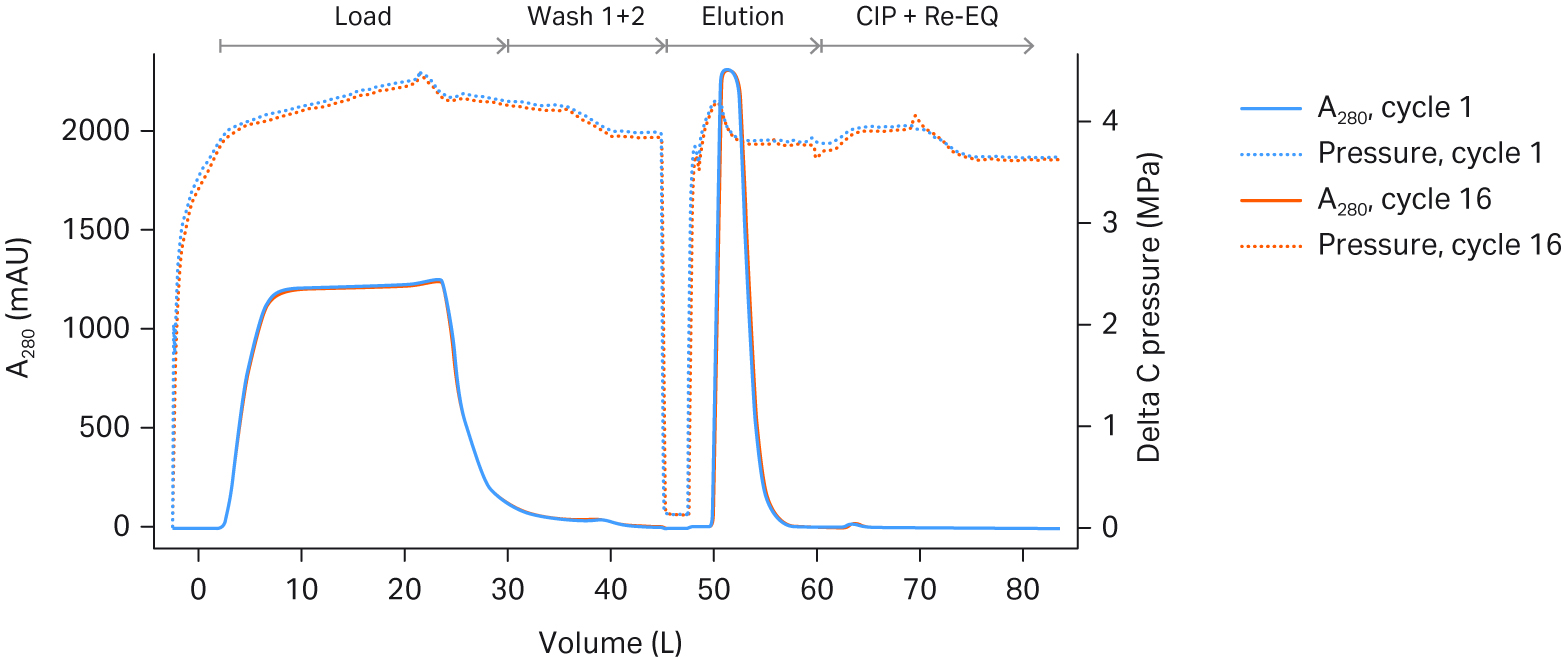
在本研究中,我们评估了 160 mL Pilot 单元和 2.4 L Process 单元的一次性撬组。这些单元的大小分别适用于 50-200L 以及 500-2000L 规模的生物反应器。一次性层析系统的循环时间由其压力限值所决定。对于一次性 ÄKTA™ ready 高流速套件,以最高流速运行 process 单元。在多个循环期间,两种单元的压力增量均略有上升,但均在可接受的范围内(见图 4)。
A)
B)
图 4. Fibro PrismA (A) 160 mL Pilot 单元和 (B) 2.4 L Process 单元在不同循环中的紫外光 280 吸光值和压力差 (DeltaC 压力) 叠加图。
评估可放大性和产物质量
我们在处理过程中遇到了一些问题,导致不同规模纯化单元中出现洗脱池不均匀。这些问题与定时、意外进入空气、不同单元的循环数不一致有关。表 2 显示每种洗脱池对应的循环数。
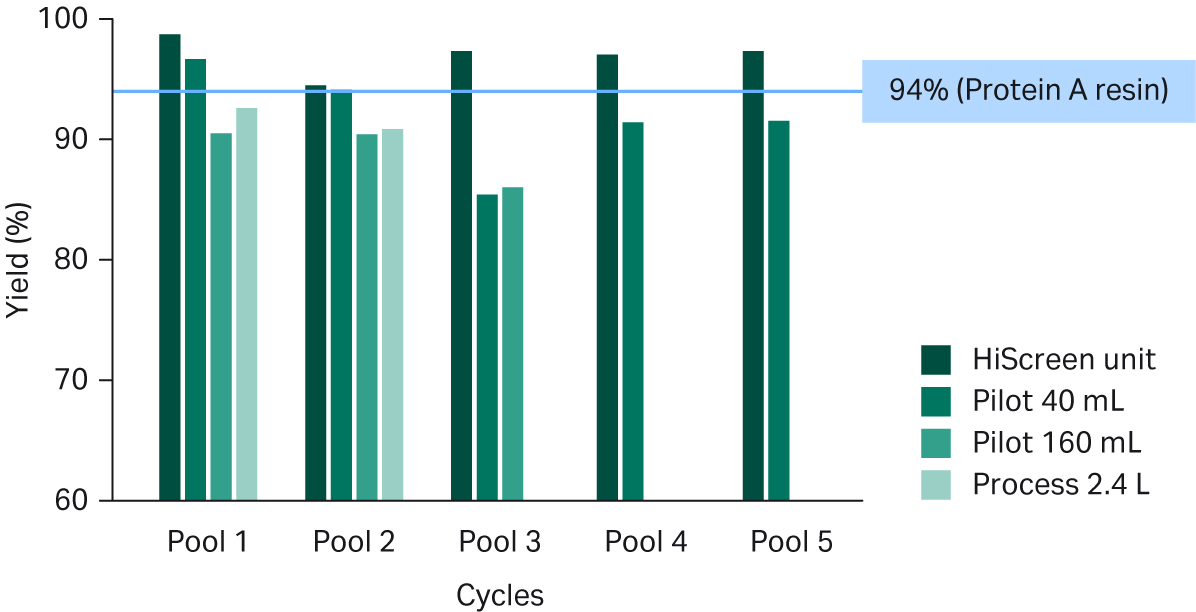
总体而言,Fibro PrismA 回收率与基于填料的标准工艺相当,在大部分情况下收率超过 90%(见图 5)。
表 2. 从实验室规模到工艺开发规模对 Fibro PrismA 进行评估
| 洗脱池 1 | 洗脱池 2 | 洗脱池 3 | 洗脱池 4 | 洗脱池 5 | |
| HiScreen™ 单元 (3.7 mL) | 循环 1 | 循环 2‒33 | 循环 34‒175 | 循环 176‒199 | 循环 200 |
| Pilot 40 mL | 循环 1 | 循环 2‒100 | 循环 101‒127† | 循环 128‒199 | 循环 200 |
| Pilot 160 mL | 循环 3 | 循环 4‒100 | 循环 101 | - | - |
| Process 2.4 L | 循环 1 | 循环 2‒16 | - | - | - |
* 今后的循环研究将重点关注按一致的方式收集循环。
† 空气意外进入。
图 5. 不同规模的 Fibro PrismA 单元的洗脱液回收率。标准 MabSelect SuRe™ LX 填料工艺的回收率为 94%,如蓝色线所示。
我们观察到 Pilot 单元的曲线略有下降趋势,这可能是由于这些原型单元上的配基偶联工艺略有不同。预计最终推出的 Fibro 单元中不会出现这种差异。此外,较小 Pilot 单元的洗脱池 3 的回收率较低,这是因为在洗脱之前,Fibro 单元意外吸入了空气,对基于紫外的洗脱液收集过程造成了干扰。在后续研究中,我们优化了 ÄKTA™ 系统 UNICORN™ 软件的紫外收集标准,所有规格的单元回收率均一致大于 90%(数据未显示)。
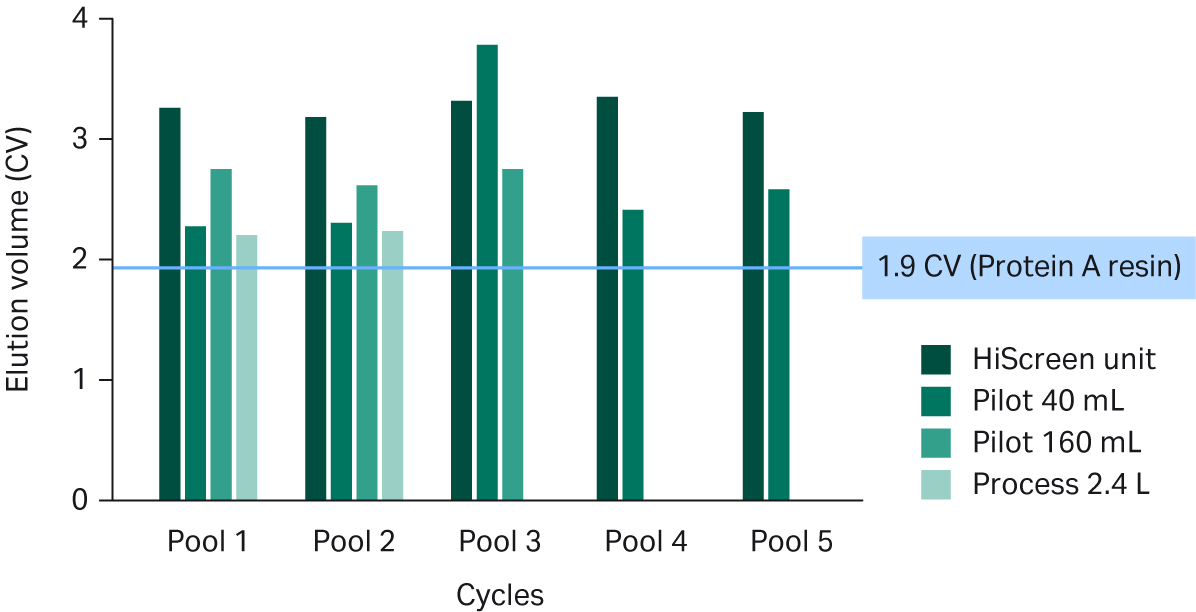
在评估可放大性时,针对所有规格的单元测量洗脱体积非常重要。然而,洗脱体积也与系统滞留体积(相对于 Fibro 单元体积)有关。如图 6 所示,Pilot 和 Process 单元产生的洗脱体积小于 3 个柱体积 (CV)。为使洗脱池的浓度高于 HiScreen™ Fibro PrismA 单元,对 Pilot 和 Process Fibro 单元的洗脱池体积进行了优化。HiScreen™ Fibro PrismA 单元的洗脱池体积应该更大。
对于某些生产设施来说,Fibro 单元的洗脱液体积可能是一个限制因素,尤其是对蛋白 A 步骤的洗脱液进行 pH 值调节时。
图 6. 不同规模的 Fibro PrismA 单元收集的洗脱液体积(柱体积 (CV))。标准 MabSelect SuRe™ LX 填料工艺的洗脱液体积为 1.9 柱体积 (CV),如蓝色线所示。40 mL Pilot 单元的洗脱池 3 的洗脱体积较大,这是由于在洗脱之前,空气意外进入该单元所造成的。
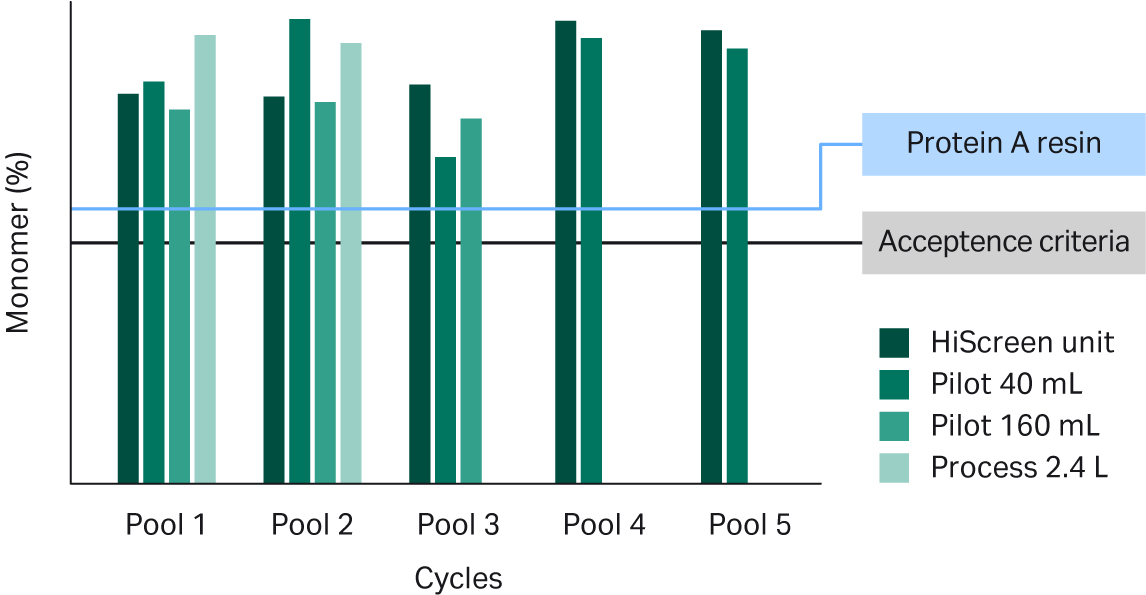
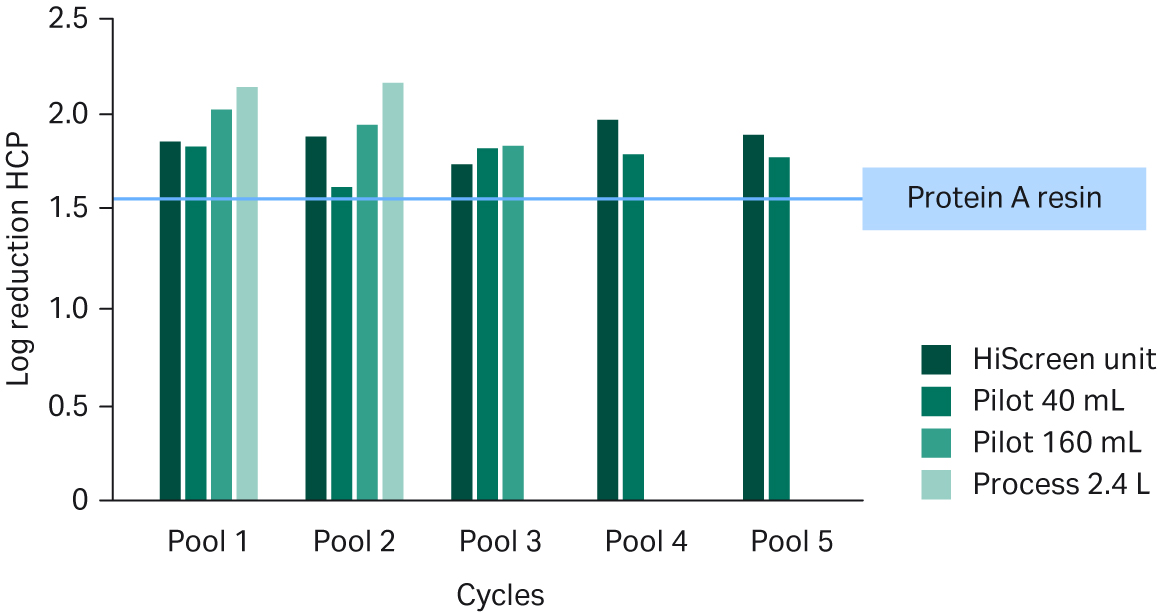
我们还研究了 Fibro 单元洗脱液中与产品和工艺相关的杂质。在所有单元和洗脱池产生的洗脱液中,产品单体水平均高于监管机构通常要求的水平,该水平与 MabSelect SuRe™ LX 填料所获得的结果相当(见图 7)。在候选 mAb 与宿主细胞蛋白 (HCP)共纯化的情况下(如图 8 中的 mAb),如何减少 HCP 也是相当大的挑战。尽管如此,与基于填料的工艺相比,Fibro 洗脱池的 HCP 减少效果略好(见图 8)。
图 7. 不同规模的 Fibro PrismA 单元收集的洗脱液中的单体占比。标准 MabSelect SuRe™ LX 填料工艺的数值以蓝色线显示。
图 8. 不同规模的 Fibro PrismA 单元收集的洗脱液中的 HCP 对数减少情况。标准 MabSelect SuRe™ LX 填料工艺的数值以蓝色线显示。
评估生产率和设施匹配度
如表 3 所示,我们列出了 2000 L 生物反应器(mAb 滴度为 5 g/L)的三种情况:标准的基于填料工艺、实验性的 Fibro PrismA 工艺、优化的 Fibro PrismA 工艺。实验性 Fibro 工艺代表的工艺变化最小。优化后的工艺上样密度和流速均增大,从而缩短了时间,提高了生产率。在所有方案中,每个运行周期后都会进行消毒。
表 3. 2000 L 生物反应器(mAb 滴度为 5 g/L*)的工艺建模假设。将 Fibro PrismA 的值标准化为 Mab Select SuRe™ LX 的值。
| MabSelect SuRe™ LX 蛋白 A 填料 | Fibro PrismA(实验性) | Fibro PrismA(经优化) | |
| 填料/纤维基质的体积 (L) | 1x | 0.08x | 0.08x |
| 上样密度 (g/L) | 1x | 0.53x | 0.64x |
| 流速 (CV/min) | 1x | 12.00x | 16.00x |
| 循环/批 | 1x | 23.86x | 19.86x |
| 缓冲液消耗量 (L) | 1x | 1.35x | 1.12x |
| 洗脱液体积 (L) | 1x | 2.07x | 1.73x |
| 核心工艺时间 (hr) | 1x | 1.43x | 0.92x |
| 生产率 (g/L/hr) | 1x | 9.41x | 14.60x |
*5 g/L,这是一个处于商业化规模滴度中间范围的合适数。
如表 3 所示,当 Fibro 单元以其上样范围的偏低水平运行时,与基于填料的工艺相比,实验性的 Fibro 工艺所消耗的缓冲液总量多出约 35%。这可能会导致出现设施匹配问题,例如设施的限度为 1000 L 移动式罐。在蛋白 A 步骤之后,需要保持较低的 pH 值,因此 pH 值滴定步骤需要额外的体积。按照我们目前的实验设置预计的 Fibro 单元洗脱液体积,这种移动式罐的容量会达到其最大填充体积。解决该问题的方法之一是在调整 pH 值之前,通过单程 TFF (SPTFF) 减少 Fibro 单元的洗脱液体积。但是,这样做将使循环过程多了一层操作复杂性。与基于填料的工艺相比,按 Fibro 基质每小时上样浓度(g/L) 计算,Fibro 单元的生产率至少高出 9.4 倍。
我们还在上样密度范围的偏高水平下操作了 Fibro 单元并对其获益进行了建模,结果证明其他几种分子的动态结合载量 (DBC) 为 Fibro 的 80%。将上样量增加 20%、流速增加 33% 时,可将缓冲液消耗量和洗脱液体积降低至与基于填料工艺一致的水平。此外,在优化方案中,Fibro 工艺时间比基于填料的工艺更短,而前者生产率却高出后者约 15 倍(按 Fibro 基质每小时上样浓度 (g/L) 计算 [见表 3])。
非常适合使用 Fibro-PrismA 的生产场景
根据上述研究,在填料的使用寿命基本不会完全耗尽的临床生产中,使用 Fibro PrismA 较为有利。因此,由于在临床项目中往往只生产少量批次,使用 Fibro PrismA 有可能降低临床项目中蛋白 A 工艺的成本。另一个非常适合使用 Fibro 单元的场景是对剂量要求较低,或患者人数较少的少量商业化 mAb 产品的生产。因此,即使在商业化生产中,如果生产批次不频繁,仍然可以通过这种经济高效的方式进行生产。
与其他蛋白 A 捕获替代品相比,Fibro PrismA 有几大优点。首先,Fibro PrismA 可以使用与相应批次的填料工艺相同的层析系统和缓冲液。此外,Fibro PrismA 允许在高使用率和快速处理之间做出灵活选择。最后,Fibro PrismA 的工艺设置相对简单。然而,Fibro PrismA 工艺的缓冲液消耗量和洗脱液体积均比基于填料的工艺要高。用户可以适当地采取措施做一些取舍。如果可以采取措施尽可能得当取舍,则可以将长期影响降至最低。然而,由于每次都无需进行装柱、功能测试以及清洁,而且也不用存放层析柱,其益处是相当大的。这些工作的实际成本往往很难统计。