生物工艺中腺相关病毒 (AAV) 的纯化需要可放大性、经济高效、稳健的过滤和层析工艺。我们在本文中介绍如何开发重组 AAV (rAAV) 的高效纯化工艺。本文所介绍的层析纯化包括亲和捕获,用以最大限度地提高回收率,并高效去除杂质。rAAV2 与 rAAV5 血清型的亲和步骤的最佳洗脱条件是不同的。通过去除低 pH 值洗脱缓冲液中的 NaCl,可以显著提高 rAAV5 的回收率。我们利用阴离子交换精纯来减少 rAAV 空衣壳,并最大限度地富集完整衣壳。在该精纯步骤中,我们为 rAAV5 开发了一种阴离子交换方案,即首先用高浓度 MgCl2 洗脱空衣壳,然后用 NaCl 梯度洗脱完整衣壳。完整衣壳的富集率为 40% 至 65%,同时病毒基因组 (VG) 回收率为 60% 至 80%,具体取决于所采用的合并策略。
简介
高效 AAV 纯化过程的关键因素是高总收率与最大限度地减少空衣壳产物杂质。用去垢剂进行细胞裂解收获细胞,并通过核酸酶处理降解 DNA 后,对进料进行澄清,然后进行浓缩和缓冲液置换步骤,从而减少捕获步骤的制备体积。亲和捕获是一种非常高效的方法,可以特异性结合和浓缩目标蛋白,并同时具有非常高的杂质去除率。
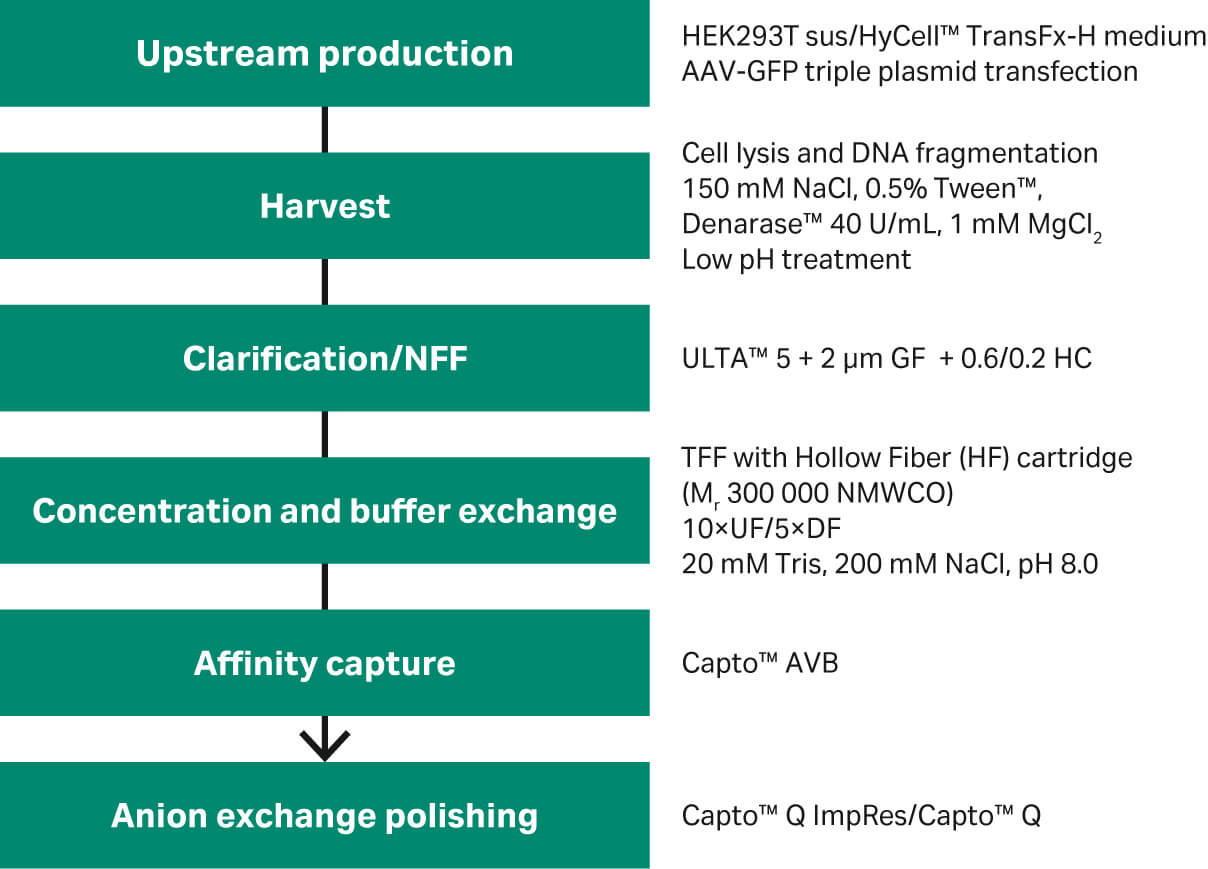
在本研究中,我们首先调整了 rAAV2 和 rAAV5 的亲和捕获步骤,然后对 rAAV5 进行精纯步骤,以提高 rAAV 完整衣壳的收率(图 1)。如需了解上游细胞培养的具体步骤,请阅读关于上游工艺开发和使用一次性生物反应器悬浮培养 HEK293 细胞制备 rAAV 的相关文章。
Capto™ AVB 是一种为纯化 rAAV 设计的亲和层析填料。Capto™ AVB 填料的配基是一种单域抗体片段,可以特异性地结合 rAAV 1、2、3 和 5 血清型,此外如果存在 AVB 结合表位区域,还可以结合经过基因工程改造的重组变体。该亲和配基不会区分 rAAV 完整衣壳(包含 VG 和目的基因)和 rAAV 空衣壳(产品相关杂质,但缺少病毒基因组)。
收获物中完整衣壳产物的比例通常远低于 50%。空衣壳含量过高会降低有效性并污染产物,因此需要减少空衣壳的含量。在上游生产过程中,除了空衣壳外,包含截短基因组的部分完整衣壳或工艺相关杂质也有可能被包装到衣壳中。传统方式一般采用 CsCl 梯度超速离心(根据密度差异进行分离)小规模纯化 rAAV 完整衣壳。但是,对于大规模生产,则最好采用层析方法。
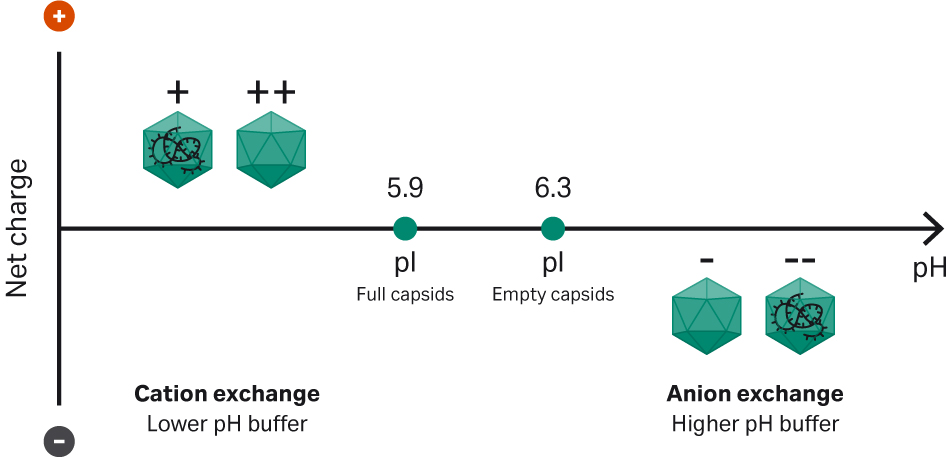
完整衣壳的等电点 (pI) 低于空衣壳,二者的 pI 分别约为 5.9 和 6.3,可以通过盐或 pH 值洗脱进行离子交换层析,利用这种电荷差异对它们进行分离。同时,根据血清型的不同,rAAV 的其他衣壳特性也可能会影响结合行为。在阳离子交换中,使用低于衣壳平均 pI、pH 值较低的缓冲液,可以使衣壳的净电荷变为正电荷。因此,由于完整衣壳的正电荷比空衣壳少,因此在盐梯度缓冲液中先被洗脱。如果改为阴离子交换,则衣壳净电荷为负,并且缓冲液 pH 值高于衣壳平均 pI。在这种情况下,由于空衣壳的负电荷比完整衣壳少,因此首先在盐梯度缓冲液中被洗脱(图 2)。去垢剂、碳水化合物和金属离子等添加剂可以改善分离效果。
要准确地分析 rAAV 完整衣壳和 rAAV 空衣壳的比例比较有挑战性。但是优化精纯步骤极为关键。利用 qPCR:ELISA 测定完整衣壳的百分比需要依靠两种独立的测定方法,二者都具有相当高的固有变异性,从而导致不确定性。我们建议至少再使用另外一种正交分析法分析完整衣壳的百分比,从而对结果进行确认,并提高准确性。
在本研究中,我们在层析图谱中利用紫外 260:280 比值来表示完整衣壳的百分比(空衣壳的比值约为 0.6 至 0.7,完整衣壳的比值约为 1.1 至 1.3)。为了检测 VG,我们还通过定量 PCR (qPCR) 测定了组分中的完整衣壳和空衣壳比率。我们利用酶联免疫吸附试验 (ELISA) 检测病毒颗粒 (VP),以测定完整衣壳的百分比和 VG 回收率。
图 1. rAAV2 和 rAAV5 纯化步骤概述。
图 2. 利用离子交换分离完整和空衣壳的原理。
结果和讨论
所有实验使用的起始材料都是通过在 HEK-293T 细胞中进行三重质粒转染产生 rAAV,再经去垢剂裂解 (Tween™ 20) 收获、澄清、浓缩或使用中空纤维 (HF) 经切向流过滤进行缓冲液置换。有关详细介绍,请参阅材料和方法以及图 1。
优化亲和捕获步骤
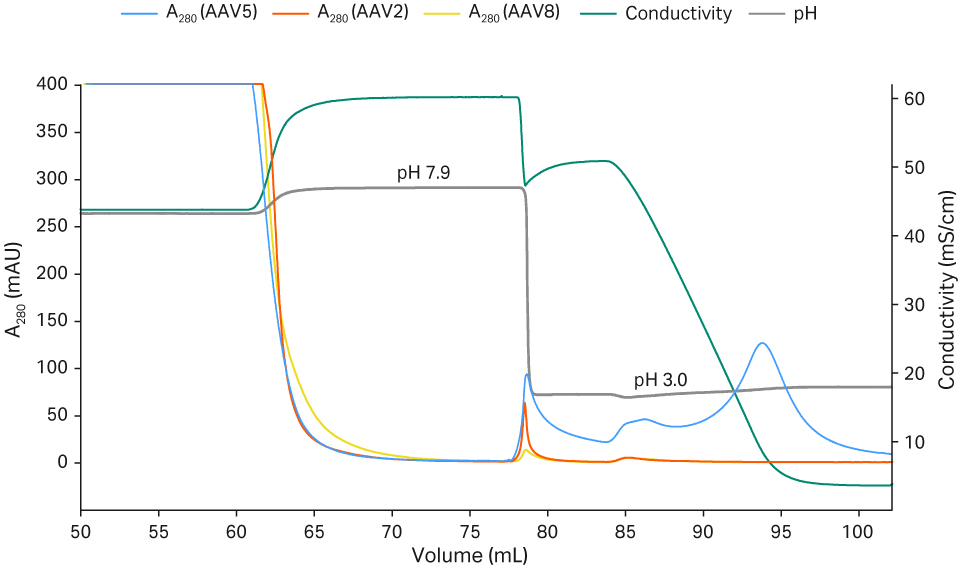
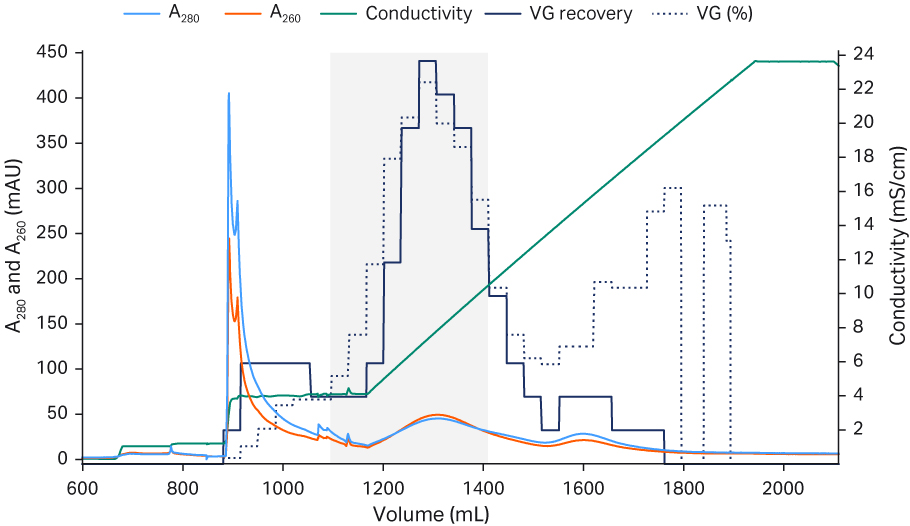
经浓缩和缓冲液置换得到的 rAAV2、rAAV5 和 rAAV8 样本用 Capto™ AVB 进行亲和层析,然后用含 50 mM 柠檬酸盐、pH 值 3.0 的 500 至 0 mM NaCl 进行梯度洗脱(图 3)。rAAV2 在 500 mM NaCl 中被完全洗脱。虽然 rAAV5 在高盐浓度下有一定程度的洗脱,但大部分 rAAV5 是在梯度结束时盐浓度接近于零的情况下被洗脱,说明 rAAV5 与 Capto™ AVB 的结合力更强。由此可以明显看出,rAAV5(但 rAAV2 并非如此)的回收率在洗脱过程中随着 pH 值 3.0 的缓冲液中 NaCl 浓度的降低而提高。通过图 3 中的结果可以看出,rAAV8 与 Capto™ AVB 的结合程度非常低。
层析柱:Capto™ AVB HiTrap™ 层析柱,1 mL
样本:rAAV2、5 和 8(TFF 截留物)
样本上样量:~ 1 × 1013 VP/mL 填料
起始缓冲液:20 mM Tris 缓冲液,200 mM NaCl,pH 值 7.8
洗脱缓冲液:100 mM 柠檬酸盐,pH 值 3.0,500 至 0 mM NaCl 梯度
流速:1 mL/min (150 cm/h)
系统:ÄKTA™ pure 25
检测波长:280 nm
图 3. 洗脱 pH 值和洗脱强度对 rAAV2、5 和 8 的回收率的影响。
如图 3 所示,由于 NaCl 的存在降低了洗脱的回收率,因此大部分 AAV5 使用 AAV2 的洗脱方案(使用 50 mM 柠檬酸盐、pH 值 3.5、500 mM NaCl、500 mM 精氨酸进行洗脱)无法洗脱。为此我们继续优化 rAAV5 的洗脱条件,因为这种血清型是工艺放大的重点对象(另请参阅可放大性 AAV 生产工艺)。
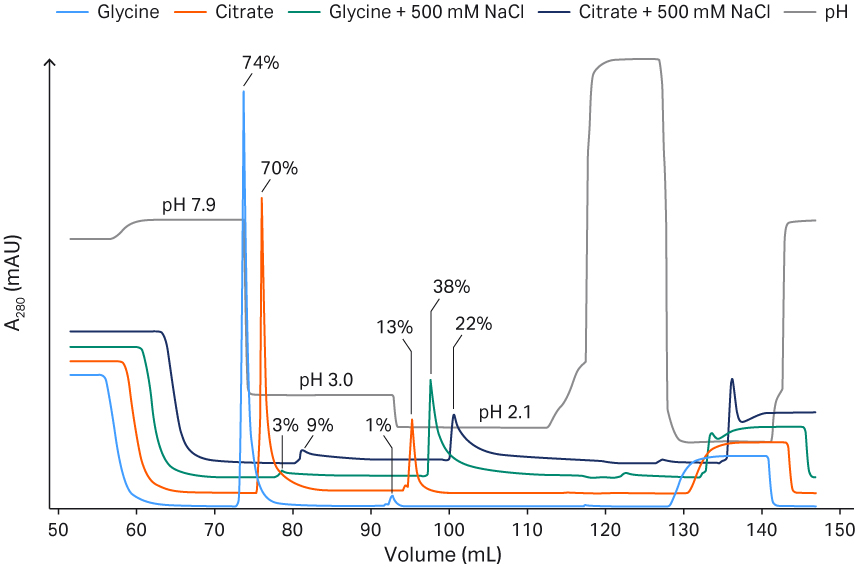
在添加和不添加 500 mM NaCl 的情况下,我们对 100 mM 甘氨酸和 100 mM 柠檬酸盐缓冲液的差异进行了研究(图 4)。在不添加 NaCl 且 pH 值 3.0 的条件下,100 mM 的甘氨酸洗脱效率更高。其原因可能是甘氨酸在较低 pH 值下具有较高的缓冲能力,但其电导率也会增加,从而有可能降低 rAAV5 的洗脱率(图 3)。为了平衡这一问题,于是我们选择了以下最终洗脱条件:50 mM 甘氨酸和 pH 值 2.7,从而获得了良好的 VP 回收率(范围在 60% 至 90% 之间)。无论使用何种缓冲液,添加 500 mM NaCl 洗脱时都会导致 rAAV5 的回收率变得非常低,即便 pH 值降为 2.1 也无法改变这种情况(图 4)。去除精氨酸并未对洗脱的 AAV5 的收率(用酶联免疫吸附试验和转导测定进行分析)带来不利影响(数据未显示)。
层析柱:Capto™ AVB HiTrap™ 层析柱,1 mL
样本:rAAV5(TFF 截留物)
样本上样量:~ 1 × 1013 VP/mL 填料
起始缓冲液:20 mM Tris 缓冲液,200 mM NaCl,pH 值 7.8 至 8.0
洗脱缓冲液:100 mM 甘氨酸或 100 mM 柠檬酸盐缓冲液,添加和未添加 500 mM NaCl
流速:1 mL/min (150 cm/h)
系统:ÄKTA pure™ 25
检测波长:280 nm
图 4. 添加或未添加 NaCl 的情况下,比较甘氨酸和柠檬酸盐缓冲液在不同洗脱 pH 值下对 Capto™ AVB 洗脱效果的影响。图中显示了 rAAV5 总颗粒的回收百分比。
rAAV2 未进行完整的动态结合载量 (DBC) 实验,只是进行了四次高上样量实验(范围在 1.0 × 1014 至 1.8 × 1014 VP/mL 填料之间),所得到的平均 VP 回收率为 83%。最高上样量得到的 VP 回收率为 100%,因此估计 rAAV2 的动态结合载量大于 2 × 1014 VP/mL 填料。
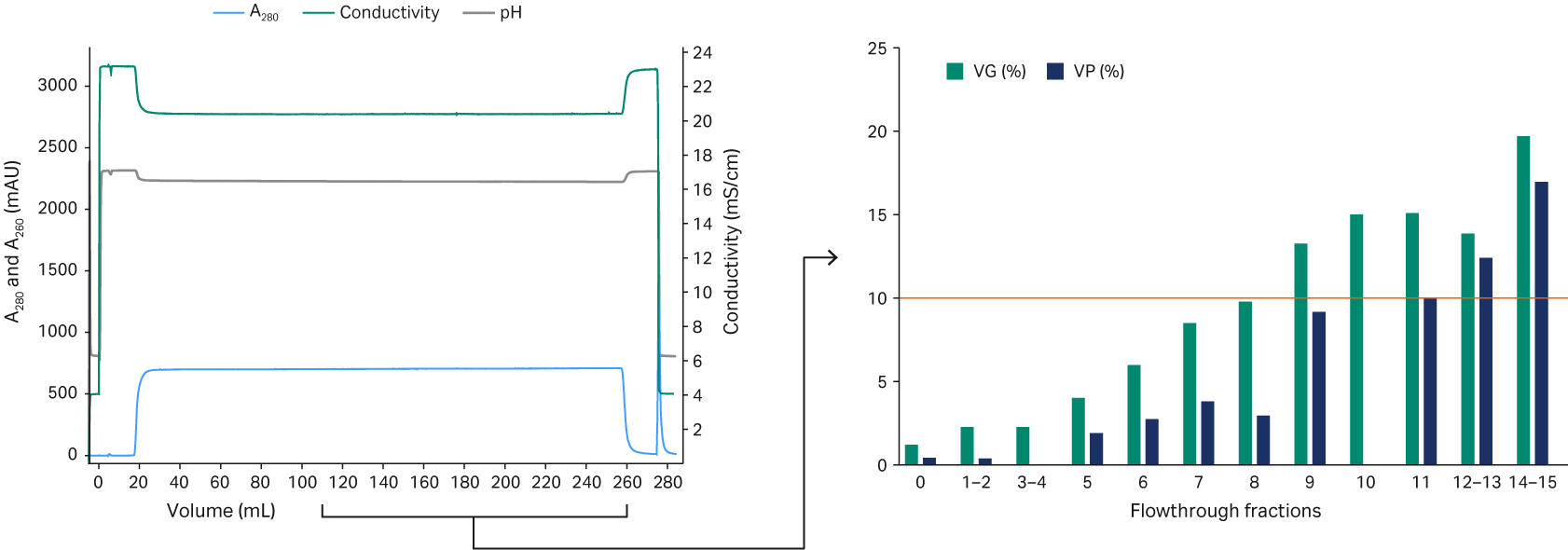
接下来,我们需要使用经典流穿 (BT) 实验法测定 rAAV5 的动态结合载量,使用 1 mL Capto™ AVB HiTrap™ 预装柱进行上样,直至 rAAV5 出现 BT 为止(图 5)。通过酶联免疫吸附试验 (ELISA) 进行分析,上样的材料中包含 2.1 × 1012 VP/mL,并且 10% BT 点对应 3.8 × 1014 VP/mL Capto™ AVB 填料。为了达到 10% 的 BT 水平,采用了最大容量,即上样量的 80%。这相当于动态结合载量达到了 3.1 × 1014 rAAV5 颗粒/mL 填料。
层析柱: Capto™ AVB HiTrap™ 层析柱,1 mL
样本:rAAV5
上样量:1.0 × 1014 至 1.8 × 1014 VP/mL 填料
起始缓冲液:20 mM Tris 缓冲液,200 mM NaCl,pH 值 7.8
平衡缓冲液:20 mM Tris 缓冲液,200 mM NaCl,pH 值 7.8
流速:1 mL (150 cm/h)
系统:ÄKTA pure™ 25
检测波长:280 nm
图 5. 使用 1 mL Capto™ AVB HiTrap™ 层析柱测定 rAAV5 动态结合载量的流穿实验。
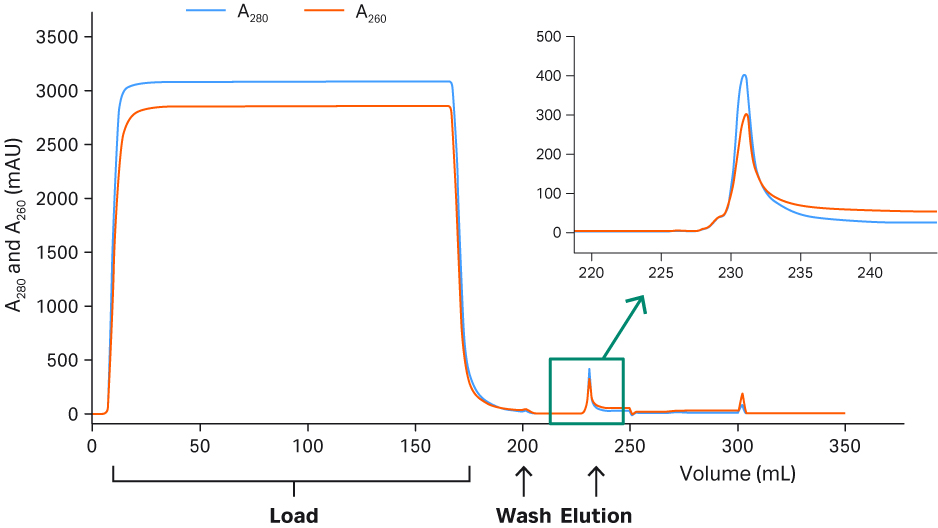
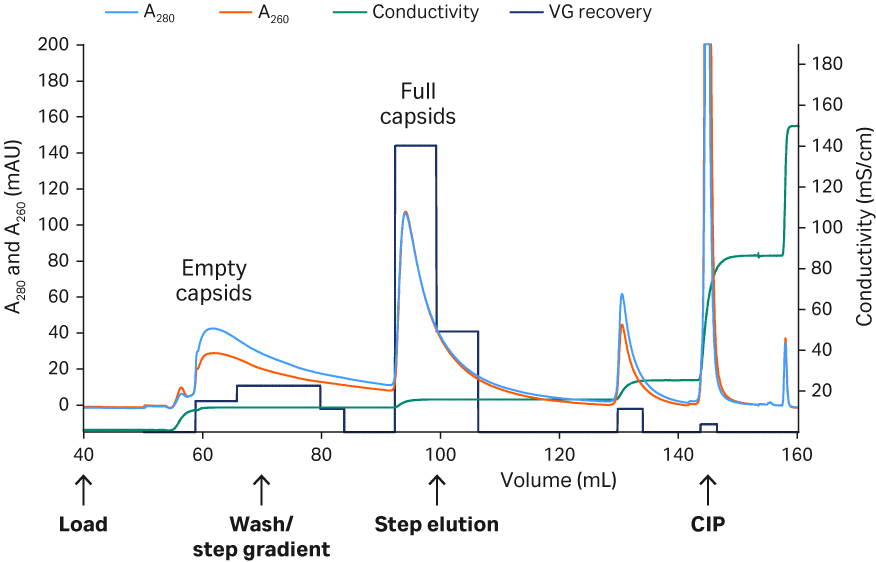
对于 rAAV2,发现 50 mM 柠檬酸盐(pH 值 3.5)、500 mM NaCl、500 mM 精氨酸的洗脱方案为最佳方案(图 6),该方案去除杂质后纯度高,且平均回收率达 90%。未对 rAAV2 进行进一步评估。
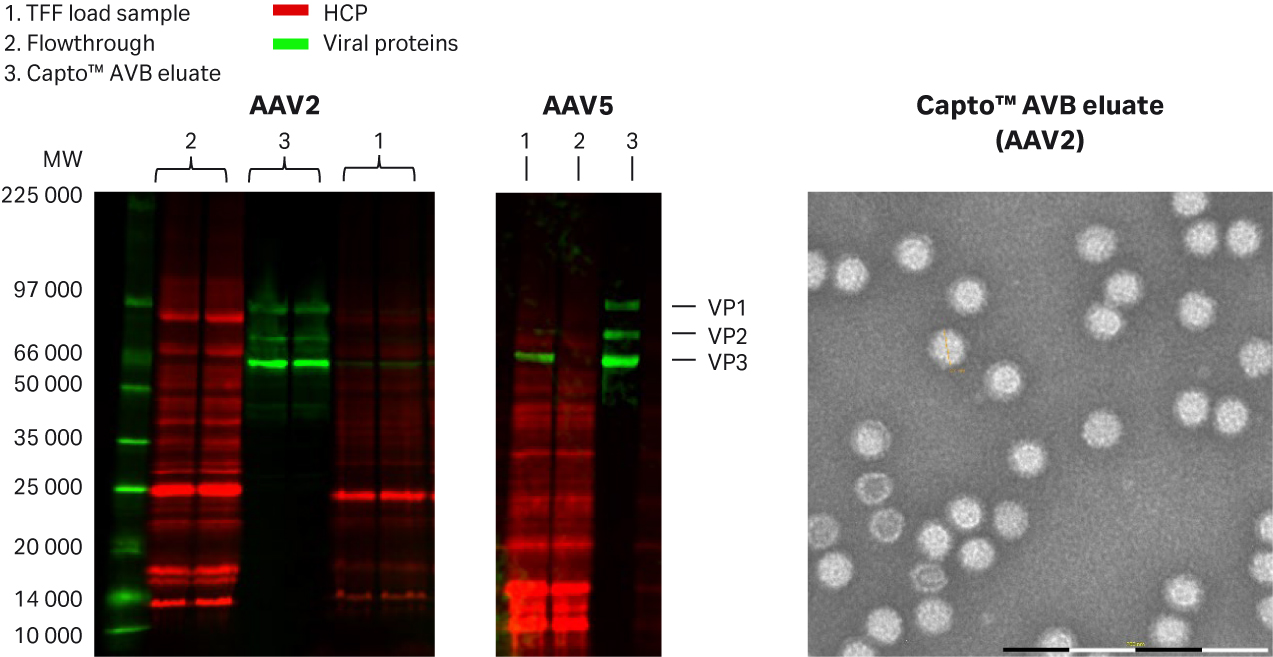
典型的 Capto™ AVB 层析图谱 (rAAV2) 和最终的详细方案请参见图 6。rAAV2 和 rAAV5 的高纯度洗脱液请参见图 7。结果为采用多重荧光蛋白印迹法检测总蛋白或宿主细胞蛋白 (HCP) 的结果,使用 Cy™5 进行预先标记(灵敏度与银染相似),以及使用一抗靶向病毒蛋白(VP1、VP2 和 VP3),在同一印迹上使用 Cy™3 标记的二抗。由于在洗脱液中未检测到 Cy5™ HCP 信号,说明经过 Capto™ AVB 层析后获得了良好的纯度。
在流穿组分中未检测到病毒条带,而在洗脱液中检测到了清晰可见的病毒条带,证实了酶联免疫吸附试验的结果,即 rAAV 浓度约为亲和捕获步骤的 100 至 200 倍。rAAV2 洗脱液的透射电子显微术 (TEM) 图像同样证实了 rAAV2 高纯度和存在单个完整的 rAAV2 颗粒(图 7)。通过使用 Superose™ 6 Increase 进行分析性分子排阻层析评估,洗脱缓冲液中无盐并不会导致 rAAV5 产生任何形式的聚集(未显示 < 1% 的数据)。
层析柱:Capto™ AVB,HiTrap™ 层析柱,1 mL
样本:rAAV2 和 5
上样量:~ 170 至 215 CV(TFF 截留物,1 至 3 × 1014 VP/mL 填料)
起始缓冲液:20 mM Tris pH 值 7.8 + 200 mM NaCl,10 CV
洗脱缓冲液:rAAV2:50 mM 柠檬酸盐,pH 值 3.5,500 mM NaCl,500 mM 精氨酸,4 CV
rAAV5:50 mM 甘氨酸 pH 值 2.7,5 CV
流速:1 mL/min 或 150 cm/h
系统:ÄKTA pure™ 25
检测波长:260 nm 和 280 nm
图 6. 使用 Capto™ AVB 纯化 rAAV2 的层析图谱。
图 7. 采用多重荧光蛋白质印迹对 (A) rAAV2 和 (B) rAAV5 洗脱液进行 Capto™ AVB 纯度分析,采用 (C) TEM 图像(使用 ViroNova 的 MiniTEM™)对染色阴性样品进行分析。使用 Cy™5 预先标记检测 HCP,使用抗 AAV2 或 AAV5 的一抗和 Cy™3 标记的二抗进行 rAAV 蛋白检测。
优化精纯步骤
采用精纯步骤的目的是为了尽可能的减少与空衣壳产物相关的杂质。在实验中中和经亲和纯化的 rAAV5 洗脱液,并使用平衡缓冲液将其稀释约 10 倍,以提高 pH 值并将电导率降至 1 至 3 mS/cm 之间。我们针对 rAAV5 完整衣壳和空衣壳分离性能筛选了几种填料(表 1),发现阴离子交换填料 Capto™ Q ImpRes 和 Capto™ Q 是最理想的候选填料。
我们选择使用 Capto™ Q ImpRes 进一步优化运行条件,评估结果列于表 2 中。
表 1. 筛选用来分离完整衣壳与空衣壳的精纯填料
| 填料 | 足够的 rAAV5 结合力 | 足够的 VG/VP 分离能力 | VG 回收率 (%) |
| Capto™ Q ImpRes | 是 | 是 | 40 至 70 |
| Capto™ Q | 是 | 是 | 40 至 70 |
| Capto™ MMC ImpRes | 是 | 否* | > 60 |
| Capto™ adhere ImpRes | 是 | 否* | > 80 |
| Capto™ SP ImpRes | 是 | 否* | > 80 |
*采用筛选条件
表 2. 使用 Capto™Q ImpRes 进行完整衣壳与空衣壳分离测试的条件和参数
| 测试使用的条件和参数 | 备注 |
| 梯度洗脱与线性洗脱对比 | 两种方式都可能具有线性梯度优势,获得稳健的回收效果 |
| 保留时间(100 至 300 cm/h【在 HiScreen™ 预装柱中为 2 分钟和 6 分钟】) | 结果相似 |
| pH 值范围为 7.0 至 9.5 | 高 pH 值通常会获得更高的分离度 |
| 缓冲液系统(Tris 或 BTP) | 结果相似,Tris 更便宜 |
| MgCl2(0 至 20 mM) | 关键参数,10 至 20 mM 为评估的理想范围 |
| NaCl(高达 1 M) | 梯度缓,步长值小(在低于 0.5 M 下洗脱) |
| 添加剂(0.1% 泊洛沙姆 188(非离子表面活性剂)、1% 蔗糖) | 分离和分析结果得到改善 |
将经过亲和纯化的 rAAV5 样本上样到 Capto™ Q ImpRes 中,并使用 20 mM 双-Tris 丙烷 (BTP)(pH 值 9.0)的缓冲液进行平衡处理。洗涤步骤完成后,加入含 0、5、17 或 20 mM MgCl2 的相同缓冲液,然后加入梯度更缓的 NaCl 缓冲液 (20 CV,含相同恒定浓度 MgCl2、高达 1 M 的 NaCl)。所有缓冲液都含有添加剂(1% 蔗糖 + 0.1% 泊洛沙姆 188)。
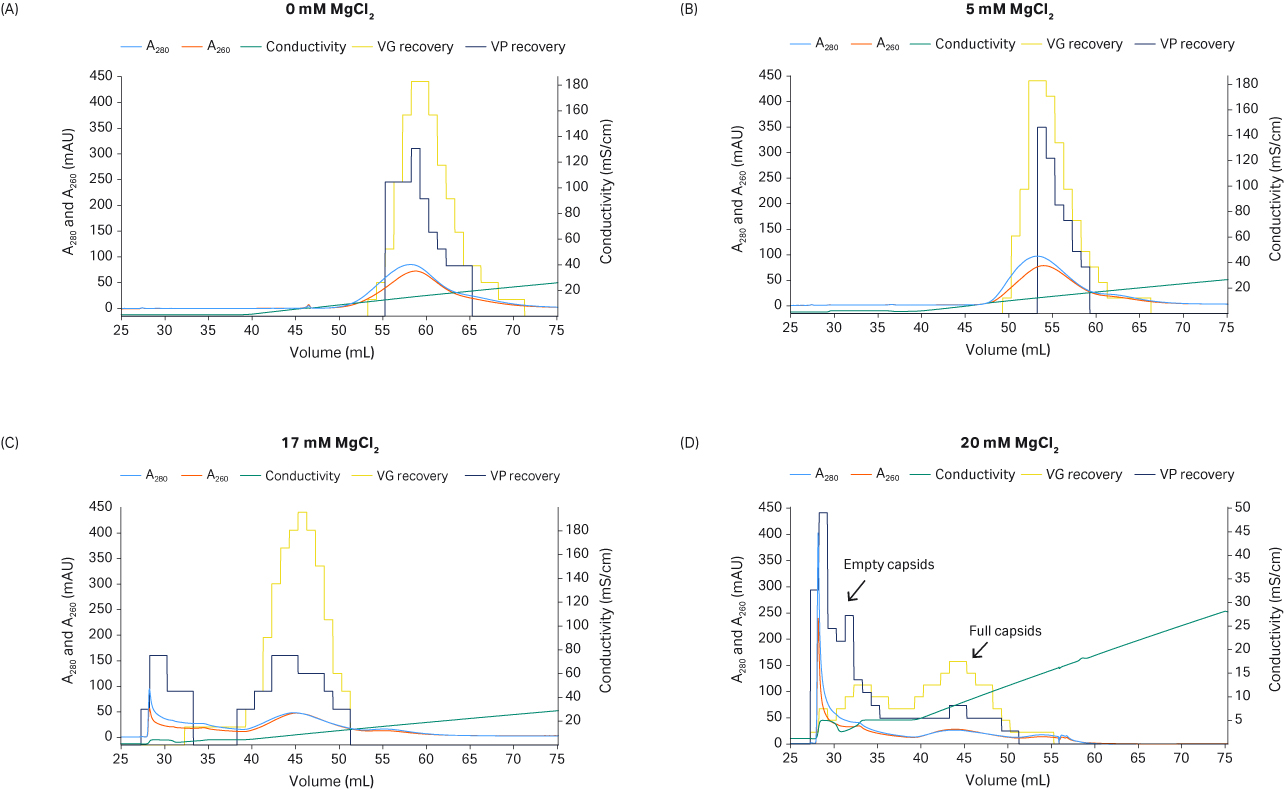
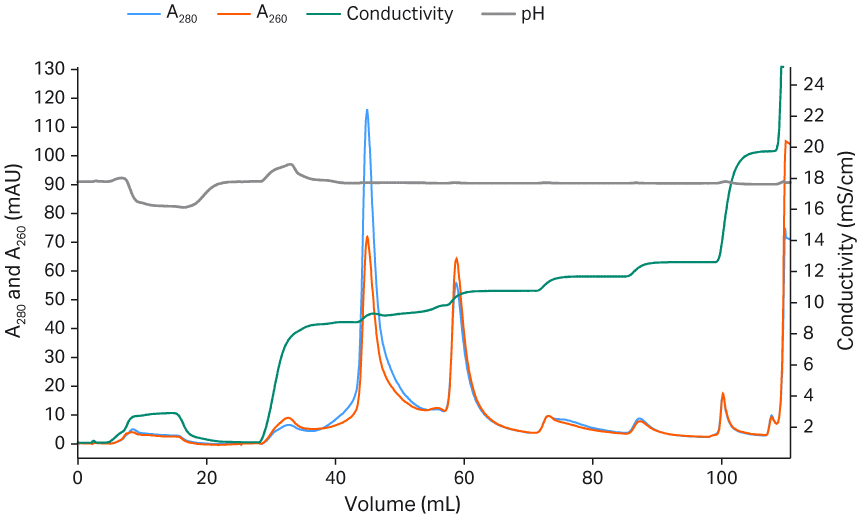
其中非常关键的一个步骤是使用线性 MgCl2 洗涤步骤洗脱空衣壳,然后再用 NaCl 梯度洗脱完整衣壳。在使用 NaCl 梯度洗脱之前,提高 MgCl2 的浓度可以提高空衣壳的洗脱比例(图 8 A 至 D)。当采用的 NaCl 梯度较缓时,完整衣壳会随着一些空衣壳一起洗脱(图 8)。20 mM 的 MgCl2 浓度太高,因为一些完整衣壳会随着空衣壳一起洗脱,导致 VG 回收率降低(图 8D)。需要对 MgCl2 的浓度进行微调,从而在 NaCl 梯度洗脱过程中最大限度地去除空衣壳,同时保留完整衣壳。在该实验中,17 mM MgCl2(图 8C)比 20 mM MgCl2(图 8D)的分离效果好。阴离子交换填料的配基密度可能是影响分离的一个因素。
从图 8 的 qPCR 和酶联免疫吸附试验结果可以看出,较高的 MgCl2 浓度可以提升完整颗粒与空颗粒的分离效果,并且在 NaCl 梯度洗脱中完整衣壳洗脱的较早。
目前尚不清楚 MgCl2 提升分离效果的作用机制,不过有可能是因为 Mg2+ 离子与完整衣壳和空衣壳的结合存在差异,从而影响了颗粒与阴离子交换配基的结合。
层析柱:Capto™ Q ImpRes HiScreen™ 层析柱,4.7 mL
样本:rAAV5(Capto™ AVB 洗脱液,用缓冲液 A 稀释 10 倍)
上样量:20 CV
缓冲液 A:20 mM BTP 或 Tris pH 值 9.0 +/- 添加剂(1% 蔗糖 + 0.1% 泊洛沙姆 188)
缓冲液 B:20 mM BTP 或 Tris pH 值 9.0 + 1 M NaCl +(0 至 20 mM)MgCl2 +/- 添加剂(1% 蔗糖 + 0.1% 泊洛沙姆 188)流速:150 cm/h
梯度:1 mL/min
系统:ÄKTA pure™ 25
检测波长:260 nm 和 280 nm
图 8. MgCl2 浓度对完整衣壳与空衣壳分离的影响。VG(使用 qPCR)和 VP(使用 ELISA)的回收率分别显示在黄色和深蓝色的直方图中。
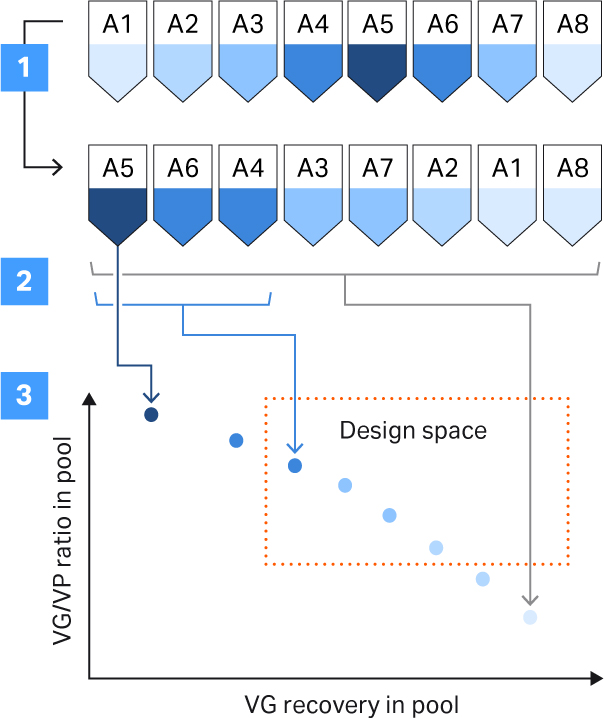
完整颗粒与空颗粒的分离导致波峰出现重叠,根据所采用的组分合并策略,可以平衡完整衣壳百分比与 VG 回收率之间的关系。我们使用了一个程序来帮助我们定义合并策略(图 9)。我们的目标是完整衣壳百分比超过 50%,VG 收率超过 40%(图 9)。
图 9. 支持合并策略所用的程序。所用步骤包括:(1) 根据完整衣壳与空衣壳的比率挑选组分;(2) 通过增加合并物中的组分数量,计算在理论上合并物中的完整衣壳与空衣壳比率和 VG 回收率;(3) 利用各合并物的计算值绘制图形并与设定的标准进行比较(设计空间,请参见本文的定义部分进一步了解设计空间)。
使用 qPCR 和酶联免疫吸附试验 (ELISA) 对洗脱组分进行分析,并根据完整衣壳与空衣壳的比率进行分类。然后增加合并物中的组分数量,以此计算完整衣壳与空衣壳的比率和 VG 回收率。我们的设计空间标准为产物和工艺标准,其中完整衣壳高于 50%,VG 回收率高于 40%(由最终的合并策略定义)(图 9)。使用 Capto™ Q ImpRes 分离 rAAV5 完整衣壳和空衣壳的最终方案获得的完整衣壳百分比在 40% 至 65% 之间。根据合并策略的不同,VG 回收率在 60% 至 80% 之间(图 10)。我们确定结合载量大约在 1 至 3 × 1013 VP/mL 填料之间(未显示相关数据)。
层析柱:Capto™ Q ImpRes HiScreen™ 层析柱,4.7 mL
样本:rAAV5,Capto™ AVB HiTrap™,1 mL 洗脱液,用缓冲液 A 稀释 10 倍
上样量:5 CV (2 × 1012 VP/mL)
缓冲液 A:20 mM Tris pH 值 9.0 + 18 mM MgCl2 + 添加剂(1% 蔗糖和 0.1% 泊洛沙姆 188)
(洗涤液 1:缓冲液 A,4 CV)
缓冲液 B:缓冲液 A + 1 M NaCl
流速:150 cm/h 或停留时间 2.4 min
梯度:线性梯度(0% 至 20% B),15 CV。在 0% 缓冲液 B、5 CV 条件下洗脱;在 20% 缓冲液 B、5 CV 条件下洗脱
系统:ÄKTA pure™ 25
检测波长:260 nm 和 280 nm
图 10. 使用 Capto™ Q ImpRes 填料分离 rAAV5 完整衣壳和空衣壳的最终优化方案
通过灵活地合并正确的组分,梯度洗脱允许条件发生小的变化。然而,线性步骤洗脱方案可以简化大规模 GMP 生产的工艺。我们使用 Capto™ Q ImpRes(图 11)和 Capto™ Q 填料(图 12)研究了 rAAV5 的分步洗脱选项。通过改变 pH 值、MgCl2 和/或 NaCl 可以优化小型的线性分步洗脱,以实现完整衣壳与空衣壳分离。结果显示完整衣壳与空衣壳的分离效果良好。Capto™ Q 填料中含有右旋糖酐填充剂,还可以提升其他血清型的分离效果(研究还在进行当中)。
层析柱:Capto™ Q ImpRes HiScreen™ 层析柱,4.7 mL
样本:rAAV5
上样量:5 CV
缓冲液 A:20 mM Tris pH 值 9.0 + 添加剂(1% 蔗糖和 0.1% 泊洛沙姆 188)
缓冲液 B:20 mM Tris pH 9.0 + 10 mM MgCl2 和 1 M NaCl,pH 值 9.0
流速:150 cm/h,停留时间 2.4 min
梯度:11% 至 100% 缓冲液 B
系统:AKTA pure™ 25
检测波长:280 nm 和 260 nm
图 11. 使用 Capto™Q ImpRes 填料和线性分步洗脱分离 rAAV5 完整衣壳和空衣壳(通过 qPCR 测定 VG 回收率,如深蓝色直方图所示)。
层析柱:Capto™ Q HiScreen™ 层析柱,4.7 mL
样本:rAAV5
上样量:5 CV
缓冲液 A:20 mM BTP(pH 值 9.5)+ 2 mM MgCl2 + 添加剂(1% 蔗糖 + 0.1% 泊洛沙姆 188)
缓冲液 B:20 mM BTP(pH 值 9.5)+ 2 mM MgCl2 + 添加剂(1% 蔗糖 + 0.1% 泊洛沙姆 188)+ 1 M NaCl
流速:150 cm/h,停留时间 2.4 min
梯度:8% 至 100% 缓冲液 B
系统:ÄKTA pure™ 25
检测波长:280 nm
图 12. 使用 Capto™ Q 填料和线性分步洗脱分离 rAAV5 完整衣壳与空衣壳。
结论
- Capto™ AVB 填料可实现高效的亲和层析捕获。
- Capto™ AVB 的最佳洗脱条件与所使用的 rAAV 血清型有关。
- 使用 Capto™ Q ImpRes 或 Capto™ Q 填料的阴离子交换精纯步骤可用来富集 AAV 完整衣壳。该步骤中 MgCl2 的浓度极为重要。
- 合并策略是决定完整衣壳与空衣壳比率及平衡二者关系的关键因素,同时需要考虑完整衣壳的收率。
- 该方案可转化为线性分步洗脱,适用于大规模临床级生产。
致谢
我们感谢来自葡萄牙 Oeiras 的 iBET(Instituto de Biologia Experimental e Tecnológica) 对于亲和捕获的讨论与积极合作。
CY24378-11Apr22-AN
TR29791259、29792294 和 29646699