从 2020 年 COVID-19 疫情席卷全球开始,生物制药行业迅速全身心地投入到疫苗开发工作当中。从Moderna 和 Pfizer-BioNTech 利用信使 RNA (mRNA) 开发的疫苗开始全面爆发。mRNA 最初用于癌症疫苗研究,后来由于其在人体内的分布特异性和稳定性的问题而在业内发展缓慢。这些限制使 mRNA 疫苗数十年来一直处于不温不火的地位。
如今,mRNA 疫苗作为一项有可能改变医学未来的颠覆性技术,一跃成为人们关注的焦点。但科学界仍然面临着 mRNA 疫苗/疗法工艺开发的效率和效用的问题。要想真正实现 mRNA 治疗患者,我们需要在这一不断增长的市场领域中找到主要问题并寻求突破瓶颈的策略。
mRNA 的用途受到越来越多的关注
尽管许多人是通过 COVID-19 疫情了解 的mRNA,但研究人员研究 RNA 疫苗与疗法已经有将近 30 年的时间。虽然早在二十世纪九十年代,匈牙利科学家 Katalin Karikó 就报道了 mRNA 的潜力 (1);但由于人们对于合成 RNA 在人体中会产生免疫反应的担忧,导致 mRNA 一直停留在理论层面。最终,Karikó 与免疫学家 Drew Weissman 一起合作克服了这一难题,他们将修饰的核苷酸掺入 mRNA中,从而为使用 mRNA 开发 COVID-19 疫苗奠定了基础 (1)。
Moderna 和 Pfizer-BioNTech 的疫苗只是生物制药行业进入新时代的开始。早在 2019 年 COVID-19 爆发之前,mRNA 疫苗和疗法市场的估值就已接近 6 亿美元 (2)。从目前情况来看,预计到 2026 年该数字将达到 29.119 亿美元 (2),目前临床阶段的 mRNA 疗法已多达 155 种 (3)。
mRNA 之所以备受关注,与以下三个因素有关:
- 安全:与许多传统疫苗不同的是,mRNA 疫苗没有感染风险。而且 mRNA 在注射后也会被正常的细胞过程迅速降解。
- 快速:mRNA 生产不需要细胞,生产速度比其他生物药物快。mRNA 容易实现标准化和工艺放大,从而提高了对大规模疫情爆发的响应能力。
- 高效:mRNA 能诱导特异抗原的表达,产生体液(抗体)和细胞介导的(T 细胞)免疫,从而产生高效的免疫反应。
据 GeneLeap Biotech的 mRNA 开发副总监 Jing Zhu 博士介绍,Moderna 和 Pfizer-BioNTech 疫苗的成功使其公司未来的计划发生了重大改变。“去年,GeneLeap Biotech 的疫苗和疗法开发主要集中在三个领域:AAV [腺相关病毒]、寡核苷酸和 mRNA,”他解释说。“但由于 COVID-19 疫苗获得成功,我们调整策略,将主要精力转向 mRNA。mRNA 不仅具有传统方法所不具有的优势,而且开发时间与投入也远低于其他生物制品。”
Centre for Process Innovation (CPI) 作为英国高端制造网络的成员,对于 mRNA 2020 年取得的成功同样感同身受,该机构的宗旨是为生物制药行业提供工艺开发支持与制造技术。2020 年,CPI 成为英国政府支持 COVID-19 疫苗快速开发的中坚力量。因此,该机构主导完成了为帝国理工学院自我扩增型 RNA(saRNA,一种 mRNA)候选疫苗的开发,包括:可放大性生产的工作流程。2021 年初,该机构获得了 5 百万英镑的资金以支持英国 COVID-19 变异株 mRNA 疫苗文库开发 (4,5)。
“早在疫情爆发之前,CPI 就已从事脂质纳米颗粒的研究,还与其他公司和组织合作开发了无细胞表达平台,从而为我们现在所从事的工作提前打下了基础”,CPI 首席技术专家 John Liddell 博士说道,“mRNA 作为疫苗的吸引力在于药效高,只需少量原料就能生产出大量疫苗产品,同时不需要大规模生产的设施。此外,mRNA 通过酶合成方式,可实现高转录反应,在几小时内即可达到每升 4 到 5 克的产量。这样的优势意味着,制药公司只要具备生产新型 mRNA 所需的能力和原材料,就能在几周内完成生产,而其他方法所需的时间要长得多。”
总得来说,只要行业能够克服目前的 mRNA 工艺开发面临的挑战,就其自身特点而言,mRNA 非常适合作为快速应对传染病和精准(即个性化)医疗(生物制药领域的最新发展趋势)的手段。
接下来的路该怎么走?
虽然 mRNA 对于现代医学发展具有重要意义,但它的发展需要建立新的开发平台,而不能依靠针对单克隆抗体 (mAb) 或其他基因疗法设计的旧平台。“与蛋白产品相比,RNA 对降解的敏感性要高出几个数量级。它很容易被 RNase [核糖核酸酶] 降解,”Liddell 博士解释道,“RNase 活性非常广泛,能够在不知不觉中破坏您的所有产品。因此,我们在开发和生产 mRNA 产品过程中必须消除 RNase 活性,这一点与处理蛋白有很大区别。mRNA 可以采用平台化生产工艺,与我们目前的 mAb 工艺非常相似。[对于 mAb],该领域的优势是拥有 20 多年积累的知识,而 mRNA 需要学习的东西还很多。”
mRNA 现在面临的许多开发与生产的挑战与当初 mAb 的情况非常相似,当时行业由于难以克服低效价与低纯化率的问题,导致商业化生产成本高,效率低。在集中克服这些生产挑战之后,mAb 成为发展最快的一类生物制药产品 (6)。工艺开发的一致性有可能成为推动 mRNA 向前发展的关键因素。“目前所使用的 mRNA 工艺由独立的开发机构各自运用自身的技能与知识进行开发”,利德尔博士说道,“COVID 疫苗生产应该与流感疫苗生产采用同样的方法,因此需要在各个方面都使用标准化流程。“mRNA 工艺开发与放大面临的主要挑战之一是缺乏适合于数量较少、颗粒较大(与重组蛋白相比)的 mRNA 专用的设备与耗材。此外,也缺乏 mRNA 工艺放大的经验、知识和对于监管相关的认知。
mRNA 工艺开发挑战深入分析
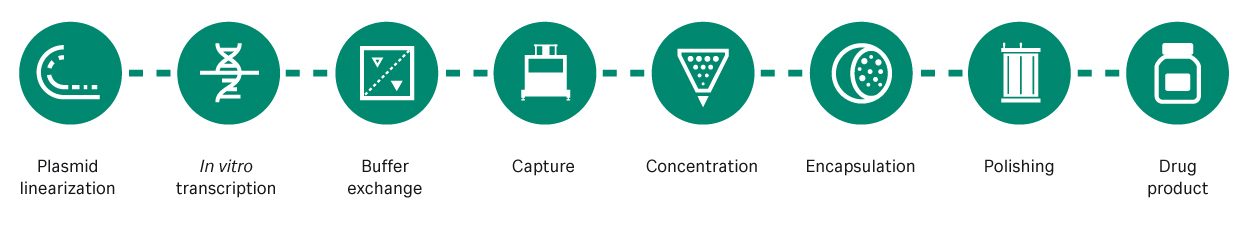
通过详细分析 mRNA 工艺开发(图 1)过程可以发现多个需要进一步改进的地方。
图 1. mRNA 的生产步骤。使用线性化质粒 DNA 模板进行 mRNA 转录、捕获、浓缩、脂质纳米颗粒封装、纯化,最后进行药品包装。
质粒的供应
质粒 DNA (pDNA) 是 mRNA 疗法和疫苗生产不可或缺的原材料,可用作 mRNA 的模板。pDNA 也是生产病毒载体疗法(生物制药行业另一个快速发展的领域)所需要的原材料,因此在供应 GMP 级 pDNA 方面存在很大的压力。CPI 已与生产 pDNA 的公司达成了长期供货协议,但由于竞争日趋激烈,GeneLeap Biotech 等新兴公司还是难以获得所需的原材料。Liddell 博士特别提到了一种可能的解决方案:“对于 DNA 模板生产,可以采用多种替代的无细胞技术来生产 pDNA,例如滚环 DNA 扩增技术,此类技术有望减少工艺开发时间,提高产品质量,”他说道,“在支持基因疗法和 mRNA 应用方面,质粒生产面临诸多的压力,尤其是 GMP的 压力。因此,为了解决这方面的供应链问题,滚环扩增等替代技术的应用有望得到进一步的发展。”
体外转录
pDNA 首先采用大肠杆菌发酵工艺进行生产,然后进行收获、纯化、线性化,最后进行二次纯化。得到的线性 pDNA 可作为体外转录 (IVT) 的模板,产生所需的 mRNA 分子。
IVT 目前是降低 mRNA 工艺开发成本的主要手段。“虽然 IVT 是一种产品生产手段,但它的工艺非常复杂。它除了使用 DNA 模板外,还需要小心地添加许多不同的组分,例如合成 mRNA 所需的酶和核苷酸,”Liddell 博士说道,“还需要在 mRNA 的 5' 末端添加加帽试剂。为了优化产出与质量,通常采用DoE的方法对这些不同组分进行工艺优化。目前反应是按照批次进行的,但是可以利用替代的反应器来减少昂贵原材料的库存,最终甚至可以实现连续反应方案。尽管这种方案的开发会很难,但却能对整体生产力产生重大影响。”
据 Zhu 博士介绍,由于需要进行额外的优化,GeneLeap Biotech 的 mRNA 生产出现了问题,而且成本上升。“我们发现,各家供应商的 T7 RNA 聚合酶的‘特性’都不一样,也就是说使用一家供应商的 T7 优化 IVT 系统后,如果换成另一家供应商的 T7,就需要再次进行系统优化。所以对我们来说找到一家可靠的供应商持续供货变得极为重要。”
能够适应 mRNA 特点的设备同样也非常重要。“我们的上游生产需要使用针对无细胞表达平台设计的设备,”Zhu 博士补充道,“虽然我们可以使用目前市场上供应的生物反应器的一些功能,但它们缺少我们所需要的一些重要功能,例如一定的在线监测功能,可以在工艺放大过程中监测不同 mRNA 模型的各种参数。”
纯化挑战
mRNA 分子的杂质(因项目而异)也是一个复杂的问题,需要根据具体情况采用不同的纯化工艺。“mRNA 是一种非常大的分子(30 到 50 纳米),比蛋白分子大得多,与病毒载体的大小相仿。这意味着它们与传统层析填料的相互作用不佳,有可能只能实现表面吸附,”Liddell 博士解释说。
IVT 过程中 mRNA 的杂质存在着差异性,因此需要提高纯化技术的可选择性,以便工艺开发科学家可以根据分子的特点配制相应的培养基。Zhu 博士提到了一个 GeneLeap Biotech 使用 oligo dT 纯化平台纯化 mRNA 的内部案例。“我们有些项目使用的 mRNA 的非常纯净,IVT 后的纯度高于 90%。于是我们采用 TFF [切向流过滤] 或 SEC [尺寸排阻色谱] 来去除少量残留杂质,”他解释道,“而另外一些项目的杂质则较为复杂,找到一个通用的纯化平台比我们预想的更加困难。通常Oligo dT 介导的纯化效果很好。但是,对于某些 mRNA 变体,我们发现存在非常强的双链 RNA 产品杂质,这需要采用精纯步骤才能分离。因此根据杂质进行层析配制将是获得最终工艺的理想做法。也可进一步调整某些 mRNA 纯化解决方案(例如 Cytiva 基于纤维材料的 Fibro 层析)以作为潜在的替代方案,帮助mRNA 的纯化。”
其他需要考虑的问题有 mRNA 是否为传统 mRNA 还是自我扩增 mRNA,后者分子较大,因此纯化过程中面临的挑战更多 (7)。“可以使用四种常规核苷酸和修饰的 mRNA 来制备 mRNA,即使用碱基类似物增加半衰期,此时一般需要将尿苷换成假尿苷,”Liddell 博士说道,“对于自我扩增 mRNA,可以使用部分病毒序列生成的复制子(由 saRNA 编码的四种非结构蛋白构成),然后复制 RNA 编码的转基因蛋白。这种技术非常精妙,但目前尚仍处于早期发展阶段”。
封装
mRNA 生产工艺的另一个关键步骤是使用脂质纳米颗粒(LNP) 进行封装,目的是防止核酸在进入患者体内的过程中发生降解。在封装之前,先要将脂质溶解在乙醇或其他有机溶剂中。由于乙醇具有强易燃性,因此生产设施必须配备可以安全使用此类材料的装置,例如防火设备。
不具备这方面能力的公司可以委托提供封装服务的外包合作伙伴;但是目前具有这方面经验的 CDMO 很少。该领域的专利较多,因此知识产权状况也较为复杂。据 Liddell 博士介绍,现在 mRNA 使用的脂质最初是为了提供小干扰 RNA (siRNA) 而开发的。在提高稳定性方面,未来可能有更好的 LNP 制剂或替代的递送技术,运输稳定性是 mRNA 产品面临的另一挑战,也是我们接下来要讨论的问题。
运输稳定性
由于 mRNA 非常敏感,需要使用超低温冷链将 COVID-19 疫苗运往世界各地。如果前面提到的工艺挑战得到解决,至少可以使这一问题得到部分缓解。例如,Liddell 博士说,“mRNA 之所以需要低温来保持稳定,是因为开发与布局过快而带来的一些不可避免的问题。COVID 情况紧急,刻不容缓,因此我们不得不在现有基础上匆忙为之。不过我确实认为还有很大的改进空间,可以选择适当的添加剂和赋形剂来实现更高温度下的运输稳定性。除了替代的脂质和赋形剂外,我们还可以利用其他制剂技术(例如冻干)来获得更好的稳定性。”
mRNA 的用途不止是生产 COVID-19 疫苗
COVID-19 疫情给我们造成了巨大损失,而最重要的是,截至撰写本文时夺走了全球超过 460 万人的生命 (8)。但 mRNA 疫苗为数百万人提供了宝贵的保护作用,而且有可能为患者治疗带来新的机会。但是,知识的缺口可能会减缓这一进程,不仅减缓开发进程,而且会减缓监管批准的进程。Liddell 博士与 Zhu 博士一致认为,mRNA 的重点还是要放在疫苗上,例如取代基于鸡胚疫苗生产方法和在肿瘤学领域的应用,但必须解决工艺开发问题才能使 mRNA 的众多可能性成为现实。mRNA 的美好前景只有通过合作、沟通、共同努力才能实现,只有这样才能带来行业的进步。
进一步了解 mRNA 高效生产所需的设备和解决方案。
一键下载相关资料参考文献
- Garde D. The story of mRNA: How a once-dismissed idea became a leading technology in the COVID vaccine race. StatNews. 10 Nov 2020. https://www.statnews.com/2020/11/10/the-story-of-mrna-how-a-once-dismissed-idea-became-a-leading-technology-in-the-covid-vaccine-race/
- Brandessence Market Research and Consulting Private Limited. mRNA vaccines and therapeutic market size is projected to reach USD 2911.9 million 2026, says Brandessence Market Research. PR Newswire. 5 Apr 2021. https://www.prnewswire.com/in/news-releases/mrna-vaccines-and-therapeutics-market-size-is-projected-to-reach-usd-2911-9-million-2026-says-brandessence-market-research-885706800.html
- Roots Analysis. mRNA Therapeutics and Vaccines Market, 2020-2030. https://www.rootsanalysis.com/reports/mrna-therapeutics-and-vaccines-market.html. Jan 2021.
- Centre for Process Innovation. CPI joins national taskforce to develop COVID-19 vaccine. https://www.uk-cpi.com/news/cpi-joins-national-taskforce-to-develop-covid-19-vaccine. 20 Apr 2020.
- Macdonald GJ. UK government-backed Centre for Process Innovation (CPI) scaling up Imperial’s coronavirus vaccine. Genetic Engineering & Biotechnology News. 9 June 2020. https://www.genengnews.com/topics/bioprocessing/u-k-government-backed-centre-for-process-innovation-cpi-scaling-up-imperials-coronavirus-vaccine/.
- Ecker DM, Crawford TJ, Seymour P. The therapeutic monoclonal antibody product market. BioProcess International. 30 Oct 2020. https://bioprocessintl.com/business/economics/the-market-for-therapeutic-mab-products/
- Blakney AK, Ip S, Geall AJ. An update on self-amplifying mRNA vaccine development. Vaccines (Basel). 2021;9(2):97. doi:10.3390/vaccines9020097
- World Health Organization. WHO Coronavirus (COVID-19) Dashboard. https://covid19.who.int/ Accessed 9 Sept 2021.