本研究使用了能产生 pLP2 质粒 (4180 bp) 的大肠杆菌 DH5α 菌株,在质粒生产过程中,监测利用5 L 玻璃发酵罐培养的大肠杆菌生长状态,并通过 Xcellerex™ XDR-200 MO 一次性发酵罐将培养规模从 5 L 放大至 80 L 和 160 L。结果显示:在所有不同培养基体积的测试中,大肠杆菌生长性能峰值(即 600 nm 处测得的光密度值 [OD600])、质粒滴度和产生的超螺旋 (SC) 质粒 DNA 的百分比都保持在一个稳定范围。
研究中利用了XDR-200 MO 自动预设 Setpoint Table(设定值表格)的功能,实现了自动进料控制。通过Control(控制)选项卡中的 Lookup table(查询表格)对搅拌、空气和 O2 流速进行级联控制,使 DO 实现全自动化控制。其叶轮的设计(上方斜桨叶轮与下方拉什顿叶轮),有助于在发酵罐中将生产规模放大至 160 L。我们的测试结果显示:XDR-200 MO 生物反应器在大肠杆菌上游培养工艺,尤其是质粒生产(可用于用于基因治疗的设备)是一个优势。
简介
如今,基因疗法药物、mRNA 疫苗和 DNA 疫苗都是通过质粒 DNA(利用大肠杆菌在发酵罐中培养)生产的。通常情况下,一般只需要生产几百升质粒即可满足病毒载体和 mRNA 的生产,因此,灵活的一次性解决方案变得非常具有吸引力。
此前我们使用 XDR-50 MO 生物反应器生产了几种质粒并将其用于 VLP 蛋白的微生物发酵生产中,具有非常高的 (OD600) 值。这主要得益于XDR-50 MO特殊的叶轮设计(上方倾桨叶轮和下方拉什顿叶轮)、高 VVM 气流和挡板设计。此外,XDR-50 MO的一次性方案能够进一步加快周转时间,并降低交叉污染风险。
而一次性 XDR-200 MO* 与 XDR-50 MO 发酵罐一样,具有相同的设计特点。本研究旨在确定 XDR-200 MO 发酵罐是否适用于160 L 的病毒载体生产,以及能否满足 mRNA/病毒载体的工艺要求。
我们通过概念验证证明,利用XDR-200进行大规模生产与 5L 玻璃发酵罐生产的大肠杆菌,其生长状态和SC 质粒 DNA 产量方面,都保持在相似的水平。
有关详细材料和方法,请参见本文档的结尾部分。
* XDR 200-MO 的配置具备双重用途 (DP),既可用于细胞培养,也具有微生物的培养。
结果和讨论
大肠杆菌培养工艺开发:5 L 玻璃发酵罐
在5 L 玻璃发酵罐中,初始接种量为 (OD600),培养体积为 2.5 L。在接种培养 8.7 个小时后,DO 值下降至设定值 (30%),然后通过预设的级联控制自动为发酵罐供应空气和 O2 气流。将起始进料速率设置为 0.2 mL/min,每 2 小时手动增速 10% - 15%,将大肠杆菌的特定生长速率 (μ) 维持在 0.06 至 0.08 h-1 之间。
生长曲线如图 1 所示。在培养结束时,OD600 峰值达到 89.2。
(A)
(B)
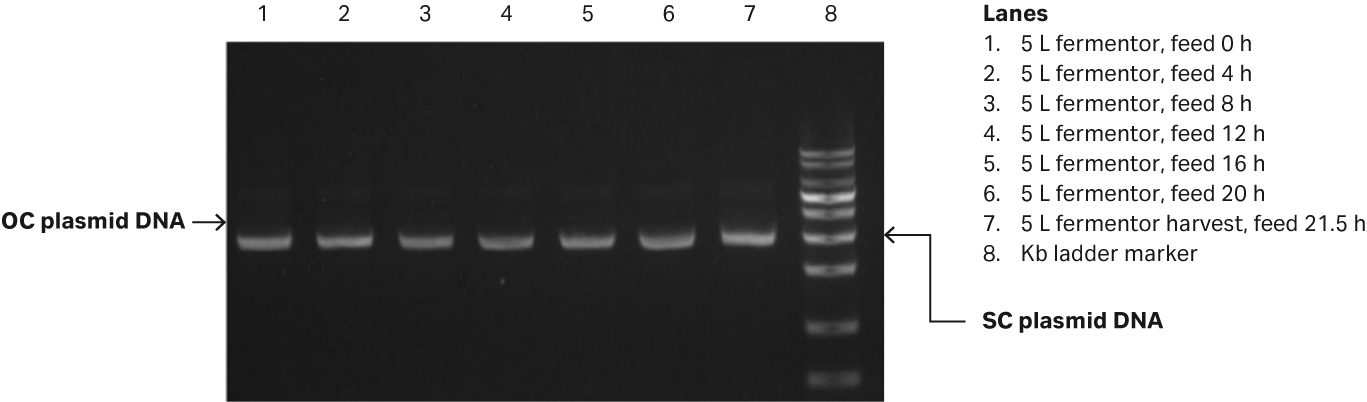
图 1. (A)在 5 L 发酵罐中,测量的大肠杆菌 (OD600) 值和特定生长速率/h。(B) 对 5 L 玻璃发酵罐中生产的质粒进行琼脂糖凝胶电泳分析。
利用XDR-200 MO 发酵罐对大肠杆菌进行放大培养:培养体积80 L
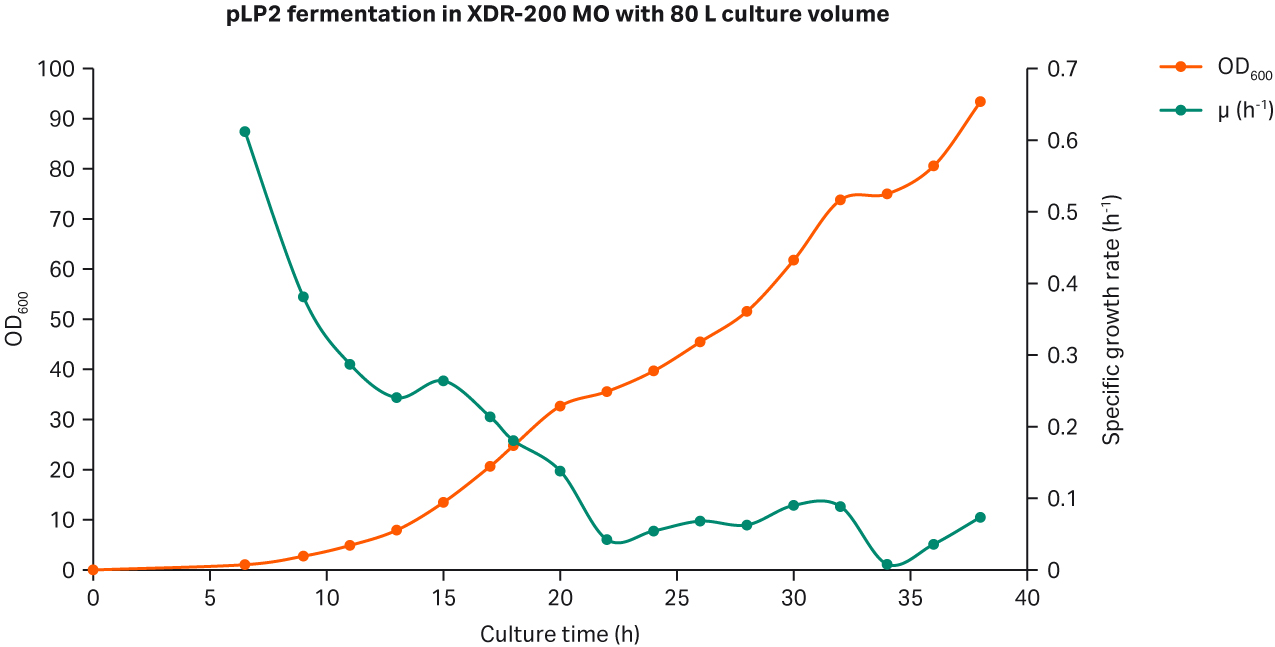
按照与 5L 生物反应器相同的每分钟通气体积与罐中液体体积比 (VVM),在 XDR-200 MO 发酵罐中进行工艺放大,将峰值 VVM 控制在 0.2~0.3 之间。我们以 0.02 (OD600) 的量接种到发酵罐中,起始培养体积为 68 L,DO 设定值为 30%,并根据空气和 O2 流速进行级联控制。当 O2 流速达到 9 至 10 Lpm 时,我们按 15 rpm 的增量手动提高搅拌速度,以维持该 DO 值。
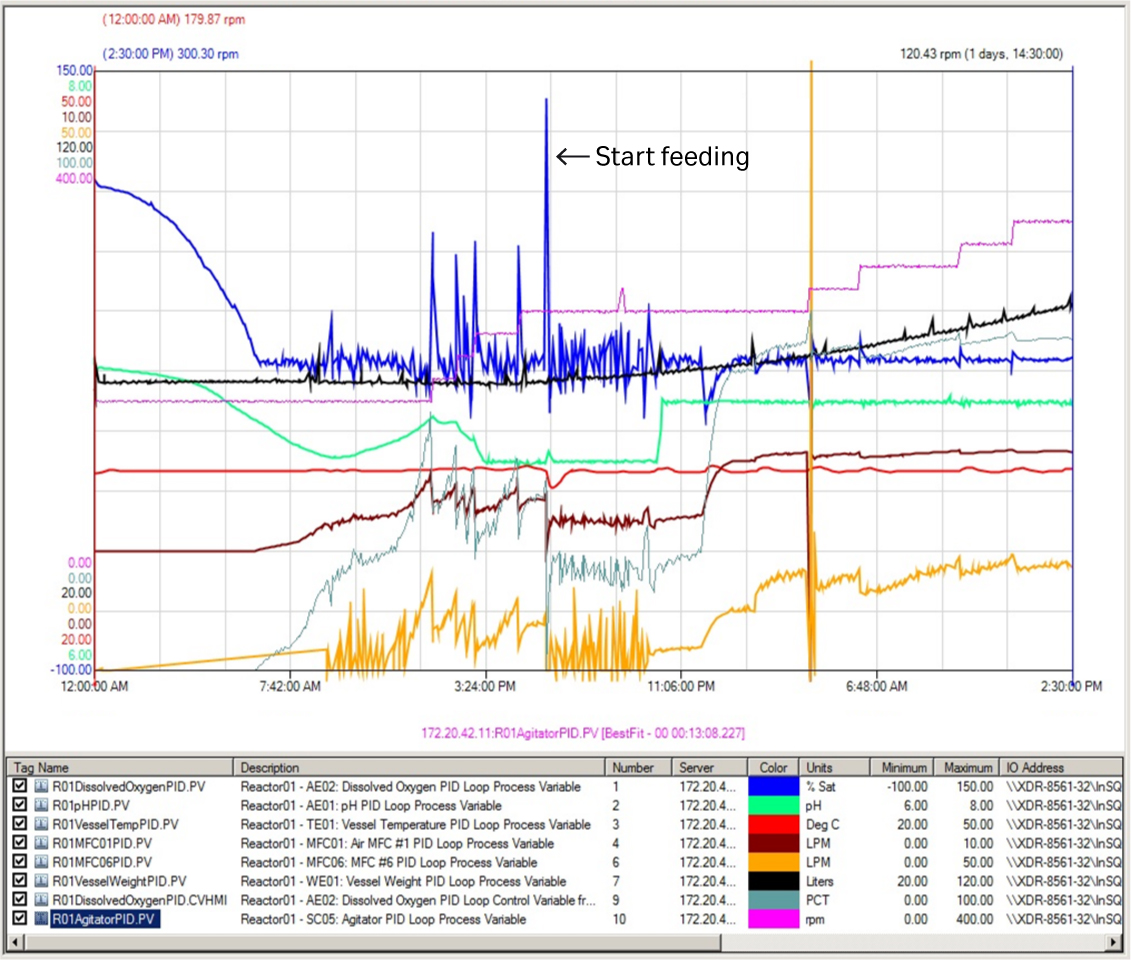
经过 6.5 h 发酵后,DO 值首次降至设定点 (30%)。此时,通过预设的级联控制自动为发酵罐供应空气和 O2 气流。发酵进行到 18 h 时,DO 值突然上升至 115%。与此同时还出现空气和 O2 流速显著降低的情况,表明营养物质正在被消耗。此时以 5.6 mL/min 速度开始进料(图 2),并每 2 小时手动增速 10% - 15%,将大肠杆菌的生长速率维持在 0.06 至 0.08 h-1 之间(图 3A)。
图 2. XDR 200 MO 发酵罐首次运行时(培养体积为 80 L)的关键工艺参数曲线。橙色曲线 = 氧气;紫色曲线 = 手动搅拌。
(A)
(B)
图 3. (A) XDR-200 MO(培养体积为 80 L)的大肠杆菌生长曲线。(B)对发酵罐生产的质粒进行琼脂糖凝胶电泳分析的结果。
我们的分析结果表明,发酵培养结束后,通过凝胶电泳测定的质粒滴度为 58.79 mg/L,SC 百分比为 91.49%(图 3B,第 7 泳道)。
在 XDR-200 MO 发酵罐中放大大肠杆菌工艺:培养体积为 160 L。
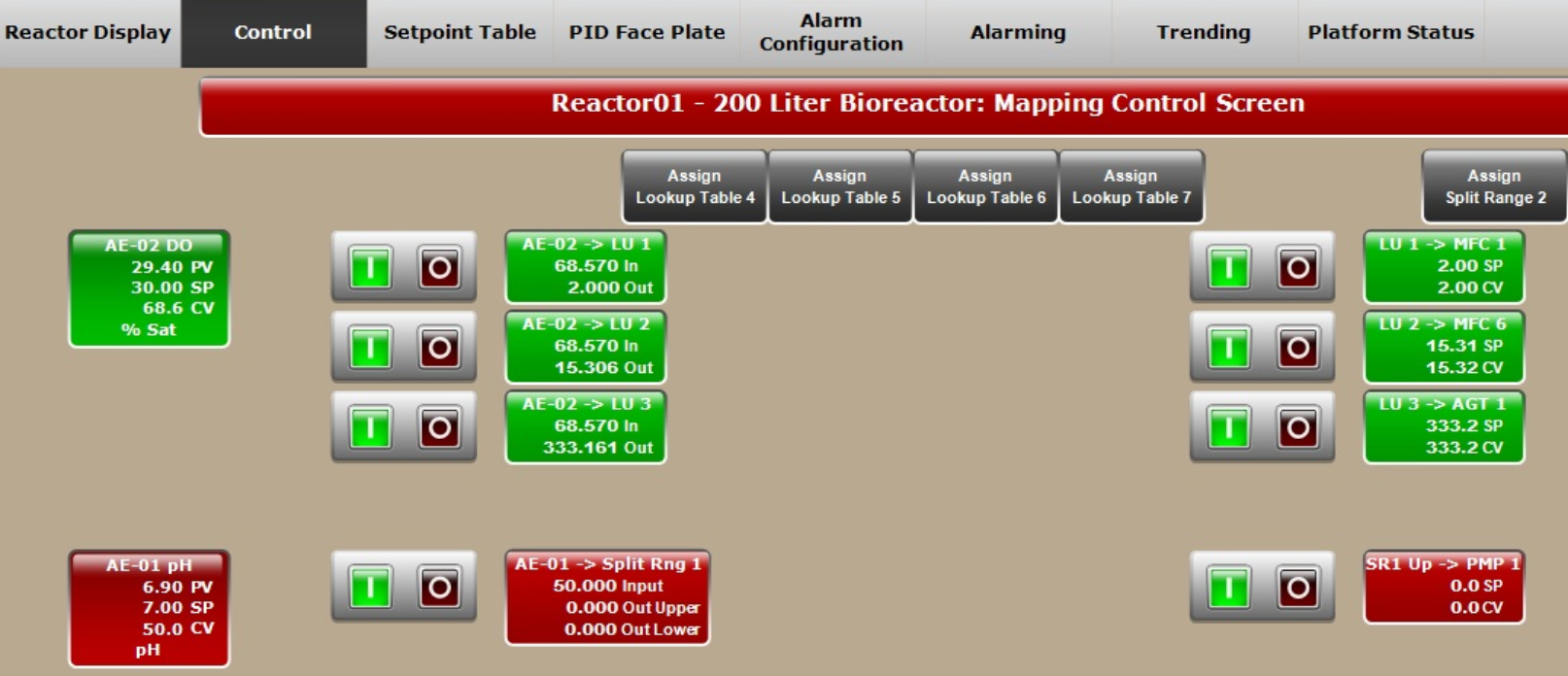
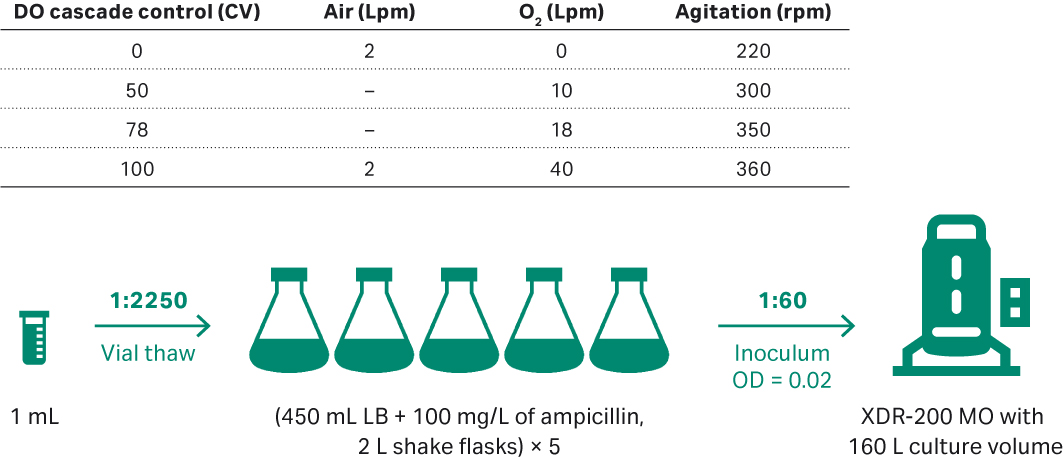
相比此前的运行,该步骤发酵罐的整套工艺(包括搅拌速度和进料速率)实现了自动化。XDR-200 MO 发酵罐采用了更加先进的 DO 值控制模式。在 DO 值控制回路中,您可以根据不同的空气、 O2 流速以及搅拌速率自定义设置不同的 DO CV(控制器变量)(图 4A),更利于气体和搅拌的控制。自定义设置不仅有助于实现 DO 的稳定控制,而且还有助于避免产生大量的气泡并控制袋压。
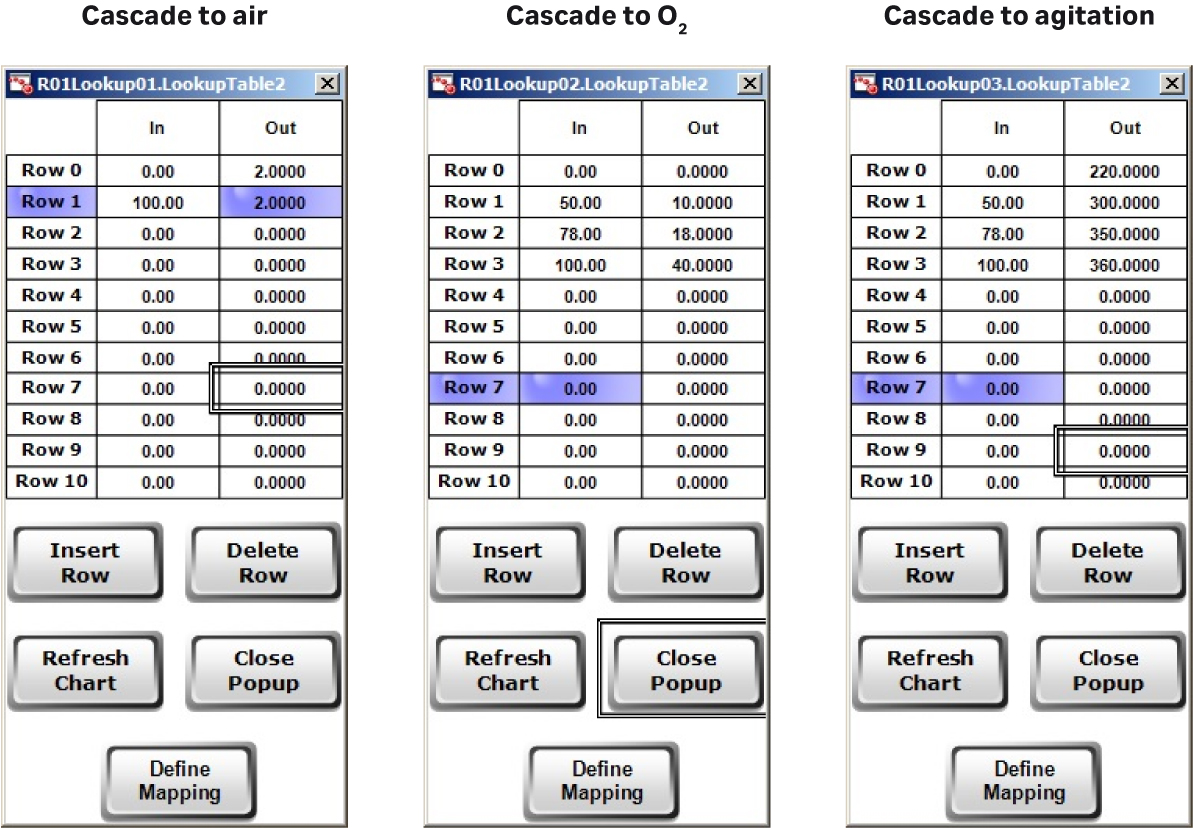
在该培养批次中对 DO 采用全自动控制,并使用Lookup table(查询表格)将该值与空气、O2 流速和搅拌速度(图 4B)进行级联。
(A)
(B)
(C)
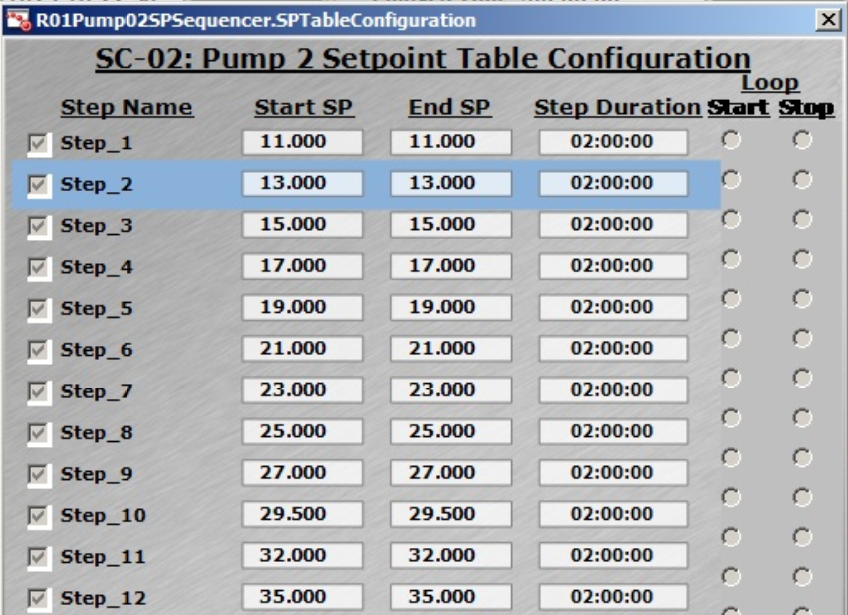
图 4. (A) 灵活的 DO 设置控制策略允许用户进行输入。(B) DO 级联控制图,与 MFC1(空气)、MFC6(O2)和 AGT1(搅拌速度)级联。(C) XDR-200 MO(运行的培养体积为 160 L)的 Setpoint Table(设定值表格)中的进料速率预设情况。
在 Setpoint Table(设定值表格)(图 4C)中进行预先设定即可实现进料速率自动调整,从而简化操作。控制软件记录所有进料速率和进料量数据,能降低错误操作风险,更好地满足监管要求。
在该实验中,我们通过设置软件的 Control(控制)和 Setpoint Table(设定值表格),对 DO 值和进料实现了自动控制(图 4B 和 4C)。当基础培养基中的碳源(养分)耗尽时,控制系统开始进料过程,自动将进料培养基添加到发酵罐中。
Setpoint Table(设定值表格)的设置如图 4C 所示 — 该运行中的最大进料速率达到 35 mL/min(步骤 12)。
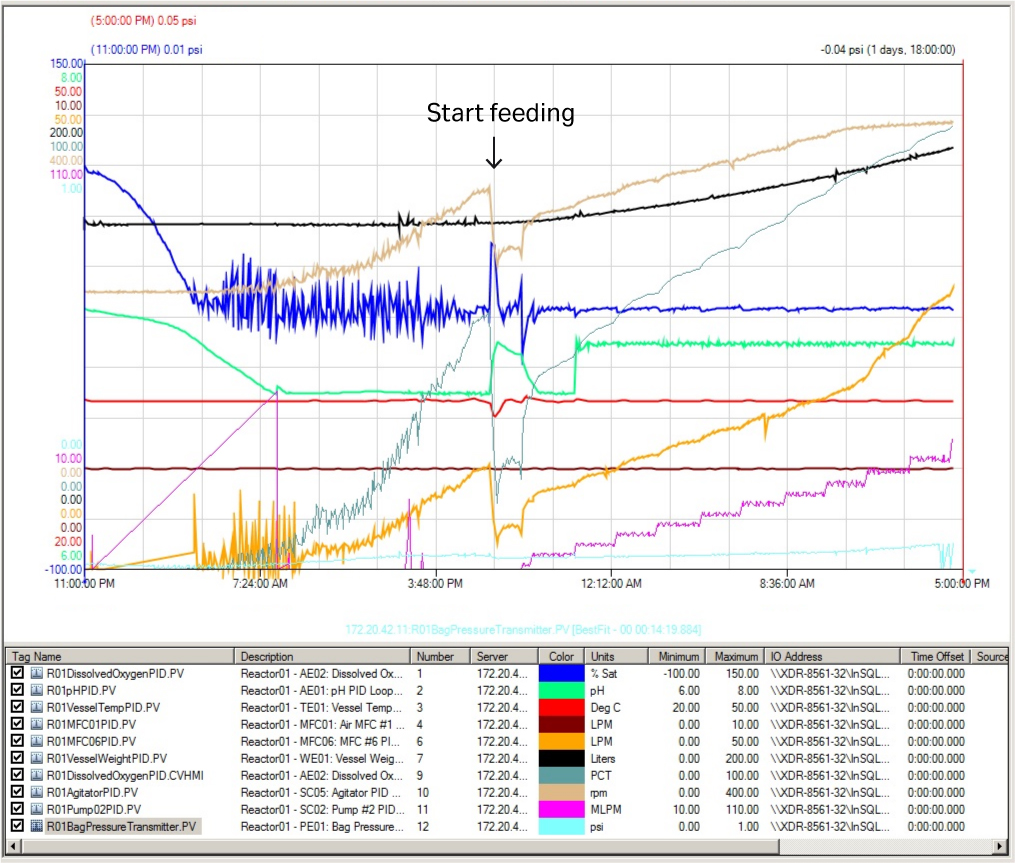
发酵罐的关键运行参数曲线如图 5 所示。关键参数包括 DO 值(蓝线)、pH 值(绿线)和温度(红线),均在整个培养过程中保持稳定,只有微小的波动。该曲线表明在该培养体积下,XDR-200 MO 发酵罐可对所有关键参数进行良好控制。
图 5. XDR-200 MO 发酵罐(培养体积为 160 L)的关键运行参数曲线。
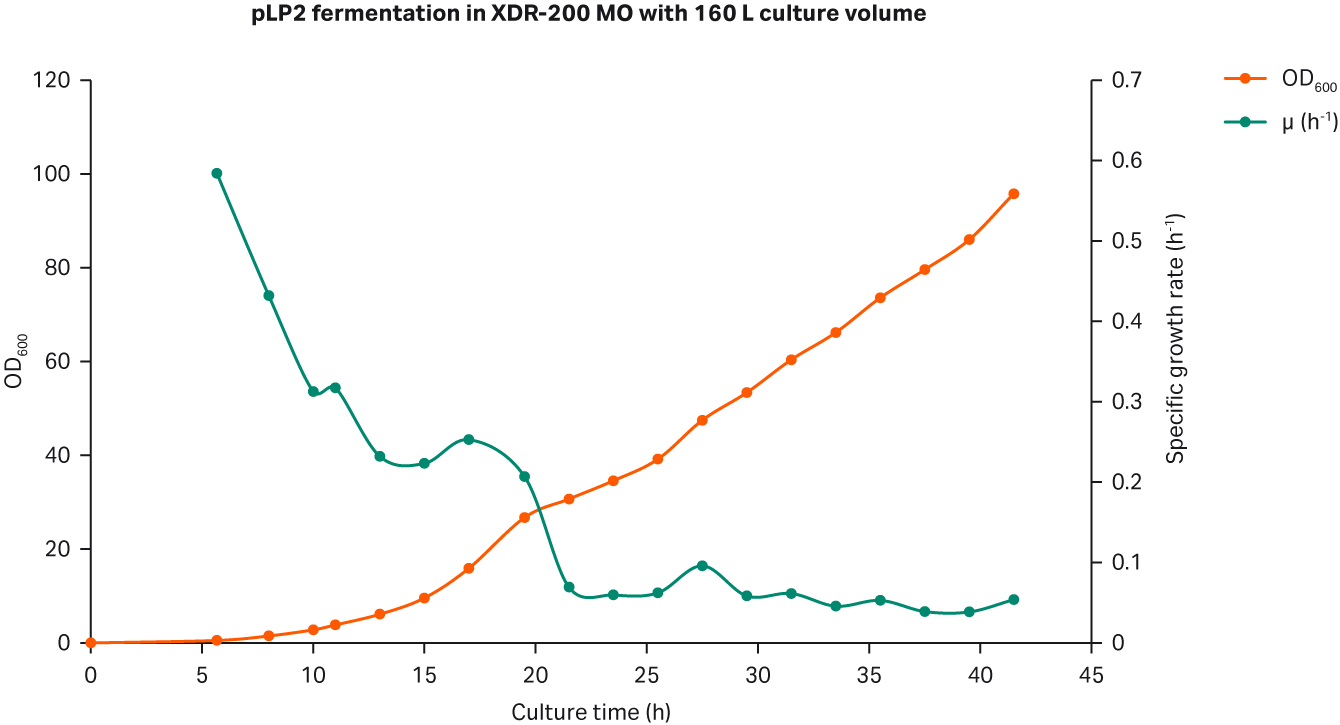
当达到收获点时,培养物重量达到 167 kg,而 OD600 峰值达到 95.8。同样,进料后的平均生长率维持在比生长率 0.06 至 0.08 h-1 之间(图 6A)。
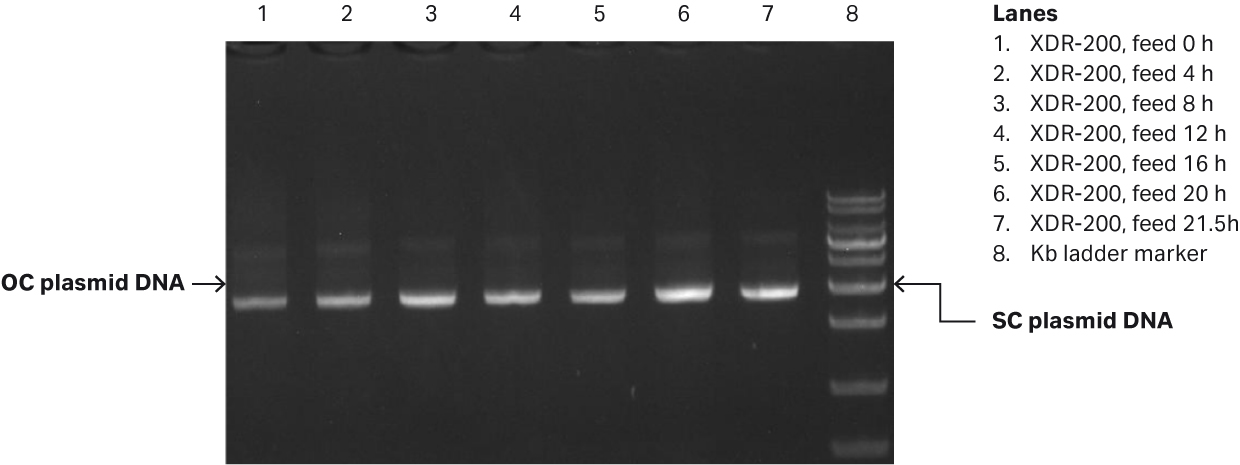
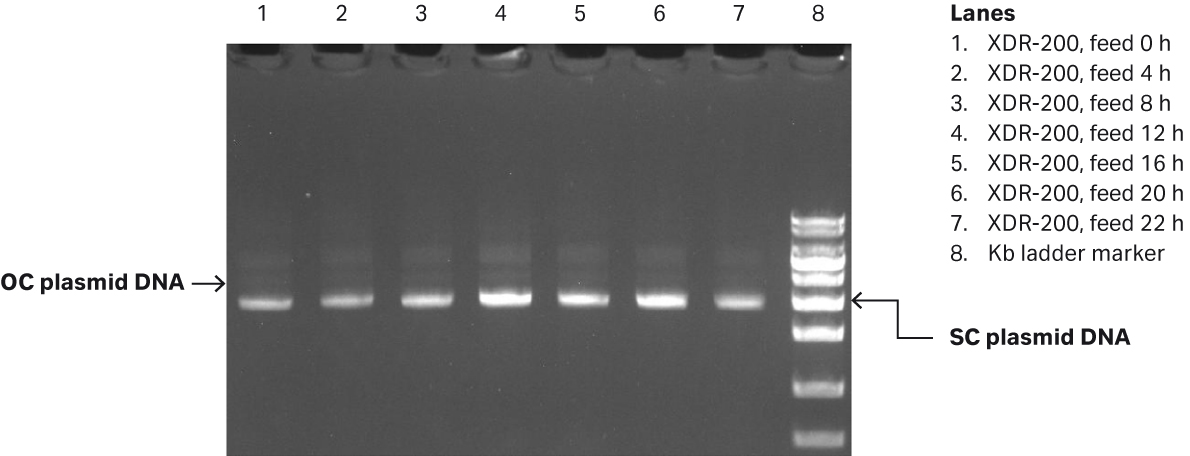
我们通过凝胶电泳测定质粒滴度为 50.6 mg/L,而 SC 百分比为 86.6%(图 6B)。
(A)
(B)
图 6. (A) XDR200 MO(培养体积为 160 L)的大肠杆菌生长曲线。(B) 对 XDR-200 MO 发酵罐中生产的质粒进行琼脂糖凝胶电泳分析的结果。
5 L 发酵罐和 XDR-200 MO 发酵罐中大肠杆菌生长、质粒滴度和 SC 百分比汇总
5 L 玻璃发酵罐和 XDR-200 MO 发酵罐(培养体积分别为 80 L 和 160 L)的 OD600 峰值分别为 89.2、93.4 和 95.8。表 1 列出了质粒滴度和 SC 百分比。
表 1. 5 L 发酵罐和 XDR-200 MO(体积为 80 L 和 160 L)发酵罐中的质粒滴度和 SC 百分比
| 泳道 # | 描述 | 质粒滴度(mg/L) | SC 百分比(GIS 法) | ||||
| 5 L 批次 | 80 L 批次 | 160 L 批次 | 5 L 批次 | 80 L 批次 | 160 L 批次 | ||
| 1 | 进料后第 0 h | 23.997 | 21.888 | 14.503 | 91.76% | 80.36% | 87.72% |
| 2 | 进料后第 4 h | 26.249 | 29.299 | 25.942 | 90.08% | 83.55% | 88.1% |
| 3 | 进料后第 8 h | 30.010 | 30.777 | 36.602 | 92.99% | 92.46% | 87.75% |
| 4 | 进料后第 12 h | 29.940 | 30.578 | 35.984 | 90.56% | 89.09% | 87.46% |
| 5 | 进料后第 16 h | 46.678 | 51.576 | 44.295 | 93.78% | 87.8% | 89.51% |
| 6 | 进料后第 20 h | 61.509 | 58.79 | 50.639 | 92.24% | 91.49% | 91.75% |
结论
- 在 XDR-200 MO 发酵罐中,OD600 峰值达到 93.4 至 95.8,表明该发酵罐能维持大肠杆菌以较高 OD600 值生长。
- 从 5 L 发酵罐放大到 80 L 和 160 L 发酵罐后,得到的 OD600 峰值、质粒滴度和 SC 百分比均与其相当,这表明您可以依靠 XDR-200 MO 发酵罐获得良好的大肠杆菌生长和质粒生产。
- 在所应用的比生长率联合高 O2 流速(相对于空气流速而言)的培养条件下,我们未观察到溶氧传质速率 (OTR) 问题。
制备研究细胞库
本研究使用抗氨苄青霉素大肠杆菌 DH5α 株生产 pLP2 质粒。pLP2 质粒大小为 4180 bp,具有很高的 DNA 拷贝数。
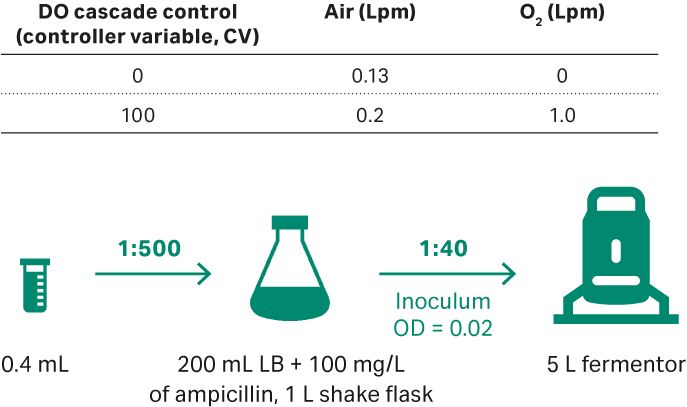
为建立研究细胞库 (RCB),我们在室温下融化 pLP2 大肠杆菌DH5α 株,并取 100 μL 菌株接种于含 200 mL LB 培养基(氨苄青霉素浓度为 100 mg/L)的 1 L 摇瓶中。培养 23 h 后,当其 OD600 值为 0.898 时,完成 RCB 制备。将该 RCB(OD600 值为 0.45,含 15% 甘油)冷冻保存于 -80℃。
制备发酵培养基
Cytiva 思拓凡(中国 Fast Trak)提供定制大肠杆菌基础生长培养基和补料生长培养基。将所有成分依次加入烧杯或储罐中,持续搅拌至所有成分溶解。我们将培养基加热至 90℃ 以上,然后将其转移至 SCHOTT-DURAN™ 螺旋盖玻璃瓶或 Nalgene™ 20 L 桶中 (Thermo Fisher Scientific) 进行高压灭菌。为确保彻底灭菌,我们将 20 L 桶的装载量保持在 10 L 或以下。
质粒滴度和 SC 百分比检测
在发酵过程中,每 4 h 从 5 L 发酵罐或 XDR-200 MO (200 L) 发酵罐的进料口取样,并将其冻存于 -20℃。分批培养完成后,将同一批次的所有样本稀释至 OD600 值为 1.0 至 1.5,然后取 6 mL 样本提取质粒。通过分光光度计对质粒提取物的滴度进行评估;共计在琼脂糖凝胶中上样 2 μL 质粒提取物(约 300 ng 质粒)进行电泳分析。使用 GIS 软件,通过凝胶电泳测定 SC 质粒百分比。
5 L 玻璃发酵罐的大肠杆菌 DH5α 培养工艺开发(培养体积为 3 L)
将融化后的大肠杆菌 DH5α 接种于含 LB 培养基和 100 mg/L 氨苄青霉素的 1 L 摇瓶中(图 7)。摇瓶培养条件为 200 rpm、30°C,取样并在 OD600 处测定其细胞密度。分别在 0、4、8、12、16 和 20 h 时,通过琼脂糖凝胶电泳测定进料样本中的质粒滴度和 SC 百分比。
图 7. (A) 用于质粒开发的大肠杆菌上游培养工艺流程(5 L 发酵罐)。
5 L 发酵罐的运行条件如下:
- 起始接种物 OD = 0.02。
- ECFT 基础培养基和 ECFT 补料培养基为 2.5 L。
- 30°C;DO 值为 30%。
- 起始培养阶段的 pH 值为 7.00 ± 0.3,当 OD = 30 时,将 pH 值改为 7.00 ± 0.1。
- 当氧气流速达到 0.95 至 1.0 Lpm 时,叶轮转速为 300 至 470 rpm;每次手动增大 15 rpm。
- 当 OD = 24.4 时,以 0.2 mL/min(即培养基 0.08 mL/min/L)的速率开始进料。
- 随着菌株生长,增加进料速率,将细菌比生长速率维持在 0.06 至 0.08 h-1。
- 当生长 OD600 达到峰值不再增加时收获培养物,然后将其冻存于 -20°C。
XDR-200 M(培养体积为 80 L)的工艺开发
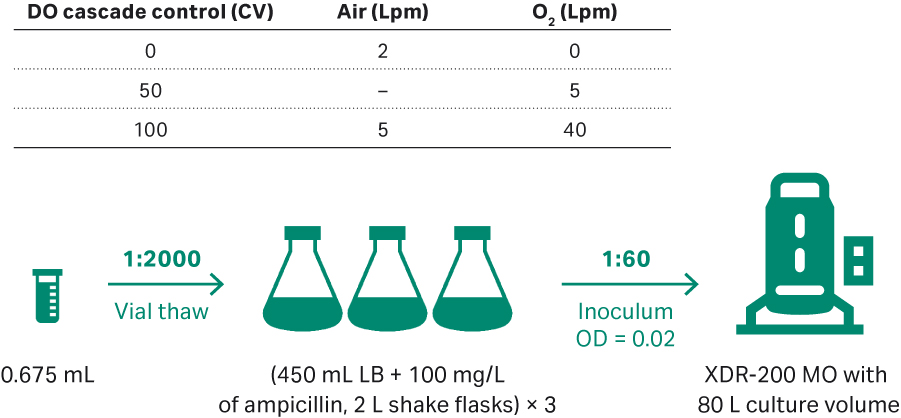
图 8 描述了 XDR-200 M(培养体积为 80 L)首次运行的接种环节。每 2 h 取样一次,在 OD600 处测定其细胞密度,并对收获物进行凝胶电泳检测(从进料后第 0 h 开始,然后每 4 h 一次,直至第 20 h 收获点)。
图 8. (A) 用于质粒开发的大肠杆菌上游培养工艺(80 L 体积的 XDR-200 MO 发酵罐)。
首次运行 XDR-200 MO 发酵罐时的运行条件如下:
- 起始接种物 OD = 0.02。
- 起始阶段的 ECFT 基础培养基和 ECFT 补料培养基为 68 L。
- 30°C;DO 值为 30%。
- 起始培养阶段的 pH 值为 7.00 ± 0.3,当 OD = 35.0 时,将 pH 值改为 7.00 ± 0.1。
- 当氧气流速达到 9 至 10 Lpm 时,叶轮转速为 180 至 300 rpm;每次手动增大 15 rpm。
- OD = 24.8 时,以 5.6 mL/min 的速率开始补料。
- 通过调整进料速率,将比生长率控制在 0.06 至 0.08 h-1。每 2 h 将进料速率增加 10% 至 15%。
- 当生长进入平台期时,收获培养物并将样本冻存于 -20°C。
XDR-200 M(培养体积为 160 L)的工艺开发
如图 9 所示,培养大肠杆菌的生物反应器体积由此前的 80 L 放大至 160 L,将 5 个单位的大肠杆菌 DH5α 种子接种于 2 L 摇瓶中(含 450 mL LB 培养基和 100 mg/L 氨苄青霉素)。摇瓶培养条件为 200 rpm,取样并在 OD600 处测定其细胞密度。当 OD600 值达到 1.13 时,将所有种子转移至 XDR-200 MO 发酵罐中进行接种。分别于第 0、4、8、12、16、20 h 以及 22 h(收获点)通过琼脂糖凝胶电泳测定补料样本中的质粒滴度和 SC 百分比。
图 9. (A) 用于质粒开发的大肠杆菌上游培养工艺(160 L 体积的 XDR-200 MO 发酵罐)。
在该部分研究内容中,XDR-200 MO 培养罐的运行条件如下:
- 起始接种物 OD = 0.02。
- 起始阶段的基础培养基和补料培养基为 136.8 L。
- 30°C;DO 值为 30%。
- 起始培养阶段的 pH 值为 7.00 ± 0.3,当 OD = 34.6 时,将 pH 值改为 7.00 ± 0.1。
- 将 DO 值与空气、氧气以及搅拌速率进行级联,实现自动控制。
- 在整个过程中,搅拌速率峰值为 355 rpm,氧气流速峰值达到 27.7 Lpm。
- OD=26.7 时,以 11 mL/min 的速率开始补料。
- 通过软件的 Setpoint Table(设定值表格)功能自动进行补料。
- 在 40 至 42 h 之间收获培养物。
TR29785567
CY24065-26Nov21-AN