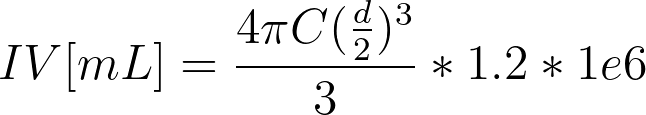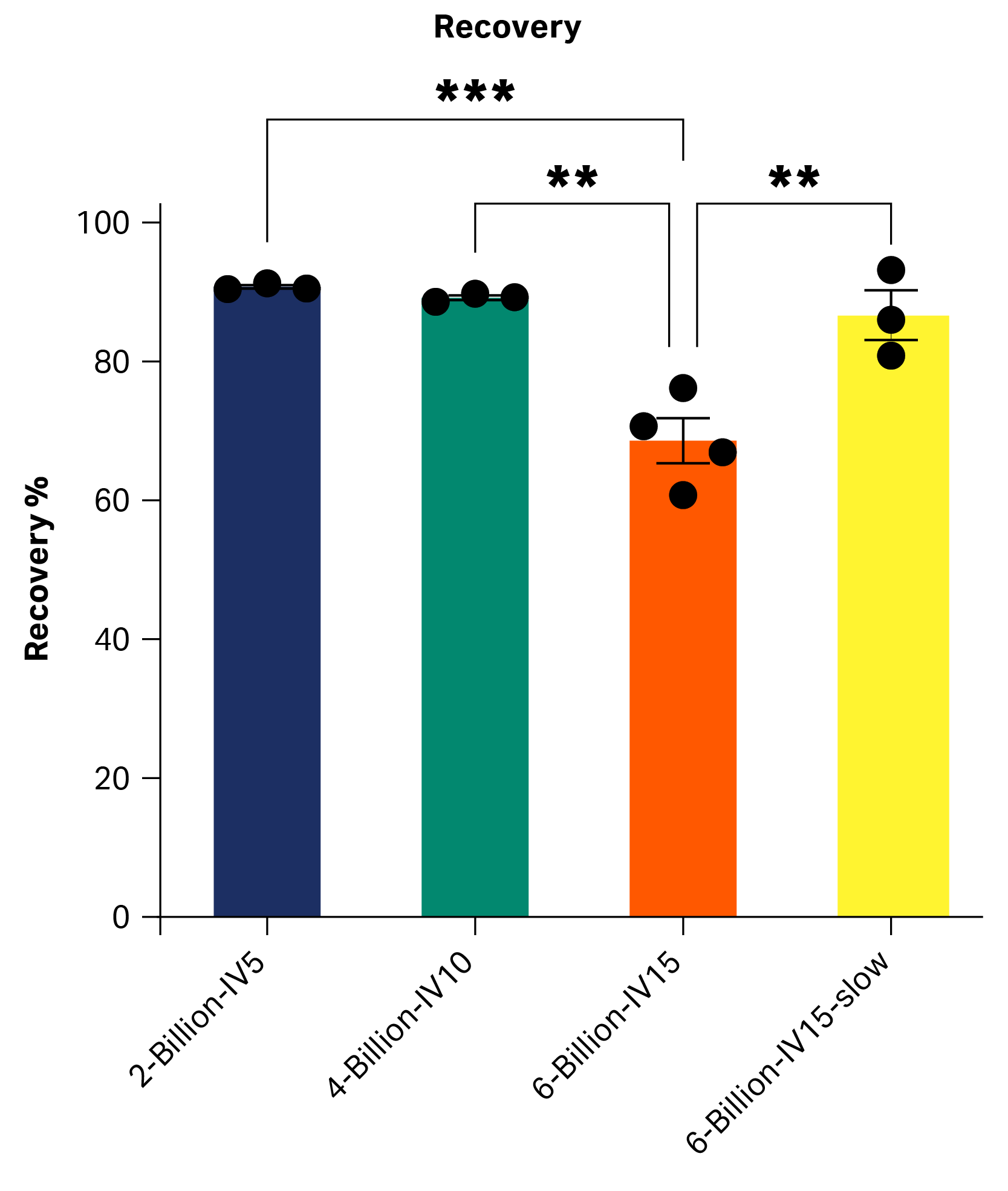摘要
在减少扩增细胞治疗产品的处理时间方面,以封闭和自动化的方式优化细胞收获非常重要,并且有助于向患者快速提供治疗。Cytiva 提供用于 Sepax™ C-Pro 系统的 CultureWash C-Pro 应用软件,可以进行自动化处理、最大限度地提高细胞回收率并最大限度地减少操作员干预,同时可以避免使用开放式手动技术。我们使用人 B-类淋巴母细胞系 721.221 模型(来源:罗格斯大学—以下简称“221s”)对一个预测性数学公式进行测试,用于计算可产生多达 40 亿细胞总数的最小中间体积,以获得 20 mL 的最终产品剂量,并在高于此细胞数量时推荐 CultureWash 应用程序的最佳参数集。在收获多达 40 亿个细胞时,我们使用标准参数集实现了 > 88% 的回收率,并且使用我们的最佳参数集能够将细胞数量更多的团块大小的回收率从约 68% 增加至 > 86%。
引言:CultureWash C-pro 收获公式
在我们先前的研究中(优化 Sepax™ 细胞处理系统的回收率:20 mL 最终产品体积的冲洗体积和手动提取指南),我们使用 T 细胞系(Jurkat 细胞)模型研究了 Sepax™ C-Pro 系统的 CultureWash C-Pro 应用程序在细胞收获期间实现的细胞回收率。我们发现,给定细胞总数的细胞回收率是终产物体积 (FV)、中间体积 (IV) 和冲洗体积 (RV) 的函数,并且导致细胞丢失的主要因素来自套件中剩余的死体积 (DV)。在本研究中,我们提出了一个预测公式(公式 1),以确定收获不同细胞数量所需的最小 IV。该公式假设细胞直径在决定总体压积大小方面起到最重要的作用,进而确定容纳该压积所需的最小中间体积。 我们开始检测 3 种条件(细胞总数:中间体积),并在每种条件下将 FV 保持在 20 mL:
- 20 亿:5 mL
- 40 亿:10 mL
- 60 亿:15 mL
公式 1:用于预测 Sepax™ C-Pro 套件最小 IV 的假设公式。
其中:
IV = 最小中间体积 [mL]
C = 处理的细胞总数 [细胞数量]
D = 平均细胞直径 [m](例如,16 μm = 1.6e-5 m)
1E6 = 体积单位换算常数 [cm3/m3]
1.2 = 20% 额外体积缓冲系数
例如,当 221s 的平均细胞直径为 16 μm 时,我们的公式预测收获每 10 亿细胞需要的 IV 约为 2.57 mL,包括 20% 额外体积作为缓冲区。理想情况下,这将呈线性关系,因为细胞直径在两次运行之间没有变化,因此每额外增加 10 亿个细胞应占据相同的腔室体积。然而,我们在实践中没有观察到这种关系,对此我们将在下文解释。
我们使用了与 CultureWash C-Pro 应用程序兼容的 CT-60.1 一次性套件。虽然我们通常建议对等于或小于 20 mL 的体积使用 CT-90.1 一次性套件以进行手动提取 (ME),但由于在 FV 固定的情况下无法更改 IV,因此我们不希望采用 ME — 即我们无法在 FV 保持 20 mL 的同时改变 IV。
尽管我们的初衷是证明该公式在给定细胞直径时的线性(不考虑总压积大小),但随着团块大小生长至 40 亿个细胞以上,我们观察到细胞丢失高于预期。因此,下文结果和讨论部分中指出,当最终体积为 20 mL 时,使用 CultureWash C-Pro 应用程序只能证明在细胞团块大小不超过 40 亿时,固定细胞直径的公式存在线性关系。而如果固定 FV 需要更多的细胞数量时,则需要提供更改参数集的相关办法。
总之,本研究旨在:
- 评价以下假设的正确性:如果 IV 与细胞直径之间存在函数关系,那么也与细胞团块体积之间存在函数关系。
- 评价 IV 对细胞总数回收率的影响。
- 验证当细胞团块大小增加时公式的有效性。
材料和方法
细胞培养
先前扩增的1e8个221s细胞(细胞来源:罗格斯大学,内部扩增)。冻存于1mLCS-10冻存液中。复苏后添加9mL预热的含有10%胎牛血清(FBS, Hyclone™ serum)的RPMI培养基( Hyclone™ serum),以中和冻存液。然后以 300 × g 离心 10 分钟。弃去上清液,在 T-175 培养瓶中将细胞以 5e5 个细胞/mL 的浓度重悬于完全培养基中(RPMI (1 L)、10%FBS、1% Pen/Strep(100 ×,Hyclone™ serum)、1% SG-200(200 mM Hyclone™ serum)、1.25% v/v 葡萄糖溶液(200 g/L 储备液,Gibco))。每日对培养瓶进行传代培养,用新鲜培养基稀释至5e5细胞/mL后分入新的T-175培养瓶中。在 NC-200 (Chemometec) 上每日进行三次细胞计数,同时在 Bioflex2 (Nova Biomedical) 上采集生物化学数据,以验证代谢物水平是否充足并监测生长条件。培养物的细胞总数达到 5e8 个细胞后,将细胞以 5e5 个细胞/mL 的密度接种至 10 L Xuri™ 系统 Cellbag™ 生物反应器中的 1 L 完全培养基中(参数:参数:摇动速率,6RPM;摇动角度,6°,通气速率,0.1mL/min;气源,压缩空气,5% CO2,37°C)。每日补加培养基,将培养物控制在为 5e5 个细胞/mL,直至达到 5 L 总体积。达到 5 L 最大工作体积后的第二天,使用 0.5 × 灌流速率进行灌流。在灌流开始后的第二天,将灌流速率设定为 1 ×。每次取出细胞时,均遵循这种逐步增加培养袋体积和培养基灌流速率的方法,重置培养袋中的细胞总数。只有最后两个数据点(IV 15 mL,6B,缓慢填充/提取)例外,由于扩增培养导致的过滤器结垢,我们进行了手动灌流(收获所有体积、离心细胞并在 5 L 新鲜培养基中重悬,1 × 模拟灌流)。由于运行所需的细胞数量较多,因此需要采用此补料和灌流计划,同时使用相同的 10 L Xuri™ 系统 Cellbag™ 细胞袋来完成研究。虽然我们可以在细胞数量较少的条件下去除细胞并在去除细胞后进行补料培养,但为了达到更极端情况(5 L 工作培养体积)下所需的密度,我们必须整夜灌流以提供适当的生长条件。
Sepax™ C-Pro 系统运行
在 Sepax™ C-Pro 系统运行前进行细胞计数,以计算需要从培养物中收获的体积。使用 CBCU 单元蠕动泵通过 Xuri™ 收获管线收获适当体积,并置于大小合适的 Labtainer™ 生物工艺袋 (Thermo Scientific) 中。然后对细胞进行批量离心,以除去培养基,然后重悬于 117 至 206 mL 培养基中并记为初始体积。之所以采用批量离心步骤,是因为 Xuri™ 袋中的密度不足以达到低于腔室体积 (220 mL) 所需的处理细胞数量。使初始体积低于腔室体积,可以使所有运行具有相同的浓缩步骤 (1)(不考虑细胞数量),从而消除不这样做产生的可变性,实现标准化。然后制备运行中使用的洗涤缓冲液(PlasmaLyte A (Baxter)、10% 人血清白蛋白(25% 储备液,Gemini 目录号800-120)、1 mM 乙二胺四乙酸 (EDTA)(0.5 M 乙二胺四乙酸 (EDTA) 储备液,Invitrogen))。然后使用适当的预定设置(见下表)对 Sepax™ C-Pro 系统进行参数设置,对此我们完全按照屏幕提示操作。其中有一次未按提示操作,即将管路中的样品挤压至终产品袋,连接滤器的管路和连接三通阀的管路同样挤压收获,过滤器管线与连接旋塞阀和腔室的管线也产生脱落。
表 1. Sepax™ C-Pro 参数:不同条件之间发生变化的参数以粗体显示
| CultureWash C-Pro v432 参数 | 单位 | 值 |
| 细胞总数 | 细胞 | 2e9-6e9 |
| 初始体积 | mL | 117 至 206 |
| 检测初始体积 | 否 (0) 是 (1) | 0 |
| 稀释比例 | 0 | |
| 稀释速度 | mL/min | 不适用 |
| 稀释后混合 60 s | 否 (0) 是 (1) | 不适用 |
| 解冻袋验证 | 否 (0) 是 (1) | 0 |
| 悬挂袋验证 | 否 (0) 是 (1) | 不适用 |
| 输入袋冲洗 | 否 (0) 是 (1) | 1 |
| 暂停输入袋冲洗 | 否 (0) 是 (1) | 不适用 |
| 光学细胞检测 | 否 (0) 是 (1) | 0 |
| 产品灌装速度 | mL/min | 120 (30*) |
| 废液提取速度 | mL/min | 120 (30*) |
| 中间步骤体积 | mL | 5-15 |
| 中间步骤体积 | mL | 5-15 |
| 前洗循环次数 | 循环 | 1 |
| 前洗循环离心力 | × g | 400 |
| 前洗循环离心时长 | 秒 | 300 |
| 切换洗涤液 | 否 (0) 是 (1) | 0 |
| 后洗循环次数 | 循环 | 0 |
| 后洗循环离心力 | × g | 不适用 |
| 后洗循环离心时长 | 秒 | 不适用 |
| 切换重悬液 | 否 (0) 是 (1) | 0 |
| 更换废液袋 | 否 (0) 是 (1) | 1 |
| 最终体积 | mL | 20 |
| 手动提取 | 否 (0) 是 (1) | 0 |
| 用注射器手动提取 | 否 (0) 是 (1) | 不适用 |
*仅第 4 次运行设置中的值不同,在图 1 和图 3 中标定为“-缓慢”。
回收率:
不同工艺的回收率计算,按输出细胞数量占运行细胞总数的百分比表示,根据 NC-200 (Chemometec) 三次重复细胞计数的平均值计算。使用培养基稀释在工艺/套件各部分中定量测定的细胞,使其保持在 5e5 个细胞/mL 至 2e6 个细胞/mL 的范围内,以获得 NC-200 线性范围内的最准确计数。有些终点溶液低于该最佳范围,但仍在计数器规范内(5e4-5e6 个细胞/mL),因此仍可以被使用。如果溶液低于下限(5e4 个细胞/mL),则以 300 × g 离心溶液 5 分钟,并重悬于约 1 mL 培养基中,从而使其在计数器范围内。为了获得套件中剩余的体积,我们使用手动清洗工具移动活塞,将剩余体积移入预称重的锥形管中。
分析:
我们使用 BioProfile™ Flex 2 自动化细胞培养分析仪 (Nova Biomedical) 通过离线采样监测 Xuri™ 培养物的化学成分和气体。所有细胞计数在 NucleoCounter™ NC-200 自动细胞计数器 (Chemometec) 上使用 Via1-Cassette™ 装置进行,并重复三次。在细胞计数前,将样品在培养基中适当稀释。我们通过从全袋体重量中减去空袋体重量来估计袋和管中的体积。
统计:
我们使用普通单因素 ANOVA 和 Tukey 多重比较检验以及单一合并方差,在 GraphPad Prism 8 中确定了统计学显著性。显著性在各图中的表示如下:* 表示 p < 0.05,** 表示 p < 0.01,*** 表示 p < 0.0001。
结果和讨论
细胞回收率和活力
20 亿和 40 亿细胞条件下的平均回收率大于 88%(图 1)(2B:IV5 = 90.8% ± 0.5%, 4B:IV10 = 89.2% ± 0.6%)。使用相同 CultureWash C-Pro 参数集时,IV 为 15 mL 的 60 亿细胞条件下的回收率显著较低。通过降低活塞腔的进液/排液速度,我们能够将 60 亿细胞条件回收率提高至 86.7% ± 6.2%,见下文讨论。每次运行期间细胞活力下降小于 1%,即从初始袋中的 98% 下降至终产品袋中的 97%,或从 97% 下降至 96%,具体取决于收获日期。
图 1. 各条件下终产品袋中的回收率。各柱图表示三次重复的平均值 ± SD,每次重复以黑点显示。仅与 60 亿 IV15 相比差异显著,后者细胞损失较高。
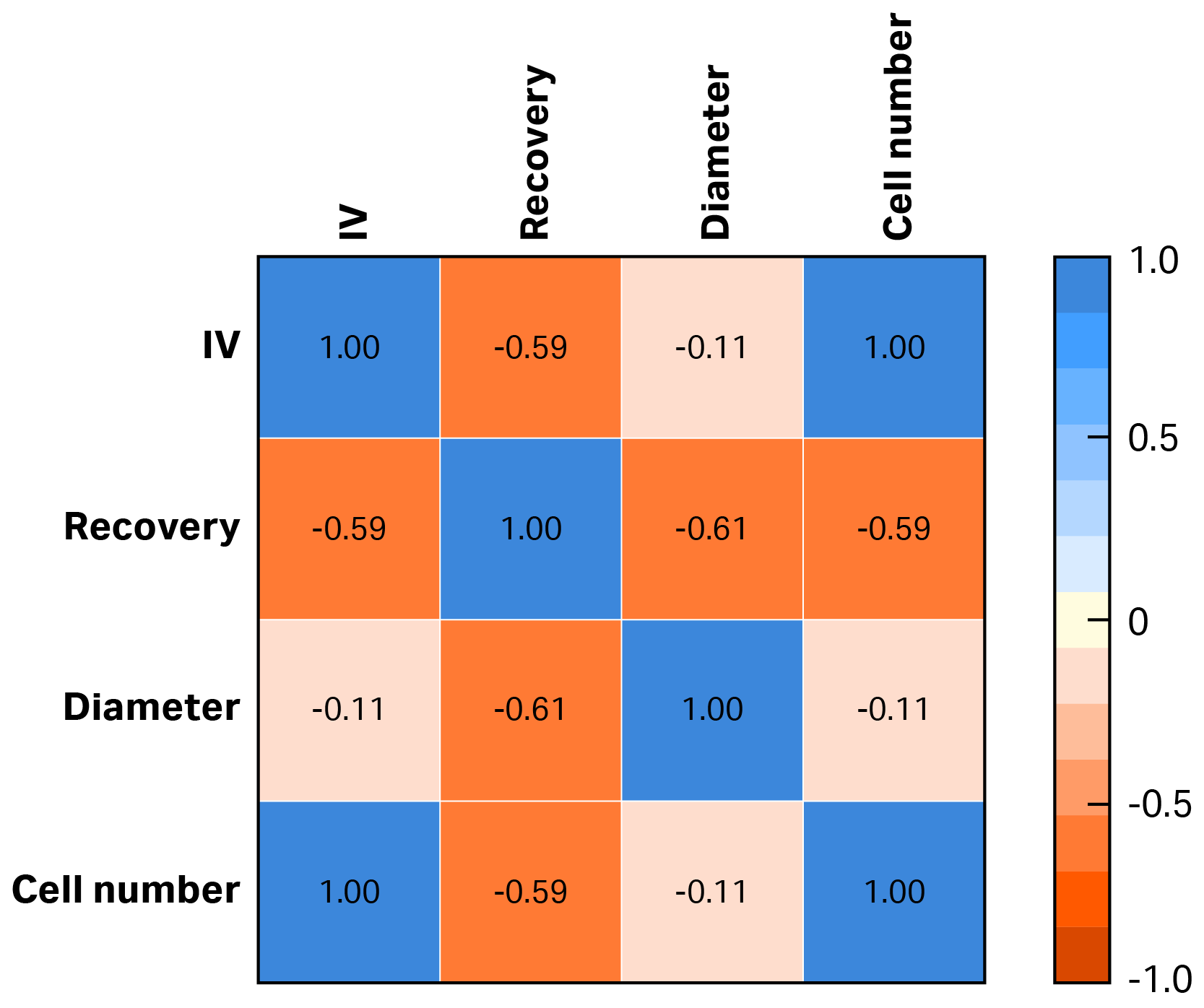
虽然我们预计根据细胞总数增加 IV 将保持较高的回收率,但我们却发现回收率与细胞总数的相关性较弱,且呈负相关关系(图 2)。随着细胞数量的增加,由于悬浮细胞无法很好地粘连在一起,细胞团块的完整性开始减弱。当团块生长到足够大时,外层细胞仅靠离心力无法牢固地保持在一起,并且在上清液提取期间更容易被剪切掉(细胞丢失的主要因素之一)。另一个值得关注因素是细胞直径。由于随着密度和培养基条件的变化,实际细胞直径在培养期间略有波动,因此细胞直径与总回收率之间也存在较弱的负相关性。其原因很容易推断,因为细胞越小形成的团块越小,更适合 IV,并且不易被剪切至洗涤液。
在我们的预测公式中,我们假设每个细胞占据一个固定直径的刚性球体体积,不考虑填充效率的影响。而实际情况并非如此,因为细胞膜的力生物学更为复杂。细胞周期、生长培养基、缓冲液、活化状态和细胞间相互作用等因素可提供生物物理刺激,影响细胞变形、直径,从而影响填充效率。虽然在缓冲液中添加 20% 缓冲液可以部分地减少这种变形的影响,但考虑到细胞类型和工艺方面因素的影响,可能还需要进行进一步的调整与测试。
图 2. IV、回收率、直径和细胞数量之间的皮尔逊相关性表。
细胞丢失总数
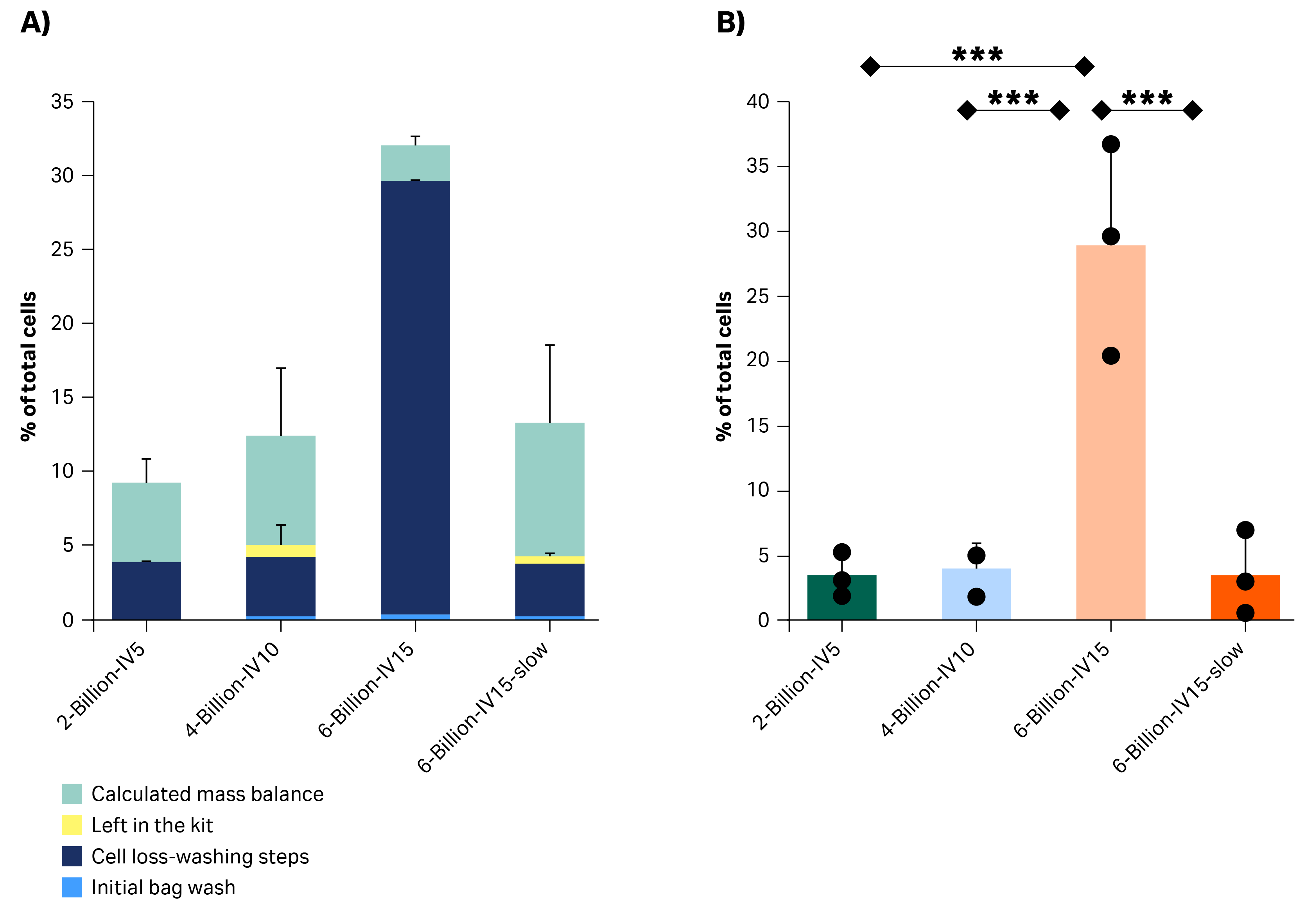
按区分析细胞残留可以阐明细胞损失发生的位置(图 3A)。在所有运行中,通过用 50 mL 培养基洗涤初始袋,测得初始袋中残留的细胞少于 0.7%。套件中丢失的细胞(通过手动清洗 Sepax™ C-Pro 离心腔提取的细胞计算得出)也极少;除 40 亿细胞条件的一次运行外,所有运行中均 < 1%。在细胞数量较低的两种条件下,丢失率约为 5%,甚至更低(图 3B)。在 60 亿细胞的初始条件下,细胞丢失率较高,增加了 37%。我们将在下一部分讨论降低丢失率的措施,解释如何将最终条件下的平均细胞丢失率降至 3.4%。为实现质量平衡,通过减法计算剩余细胞丢失率(可能包括管线/腔室中剩余细胞总计以及体积估计和细胞计数的系统误差),并在图 3A 中表示为“质量平衡 - 套件中的丢失率”。
图 3. (A) 按隔室分解的各种情况下的细胞丢失率。(B) 洗涤步骤期间的细胞丢失。与 60 亿 IV15 相比差异非常显著,后者在洗涤步骤期间细胞丢失率较高。各竖条表示三次技术重复测量的平均值 ± SD。
因参数设置过快导致细胞回收率降低
在 60 亿细胞条件的上清液废液排出(通过浓缩细胞和洗涤)期间,我们观察到可见细胞团块和混浊。虽然为了避免丢失任何细胞,我们的公式为团块上方的上清液留出了足够的冗余,但在排废液期间团块附近的湍流仍可能会导致细胞剪切。其原因之一是本研究中使用的细胞类型的生物学因素;由于 221s 来源于类淋巴母细胞系并在混悬液中生长,因此假设它们也可以容易地被剪切掉。此外,根据生长所用的混悬液培养基的不同,混悬液中生长的细胞直径可能快速出现变化,从而显著影响团块大小。还有一个因素也可能导致产生差异,即离心时细胞可能无法均匀地分布在 Sepax™ C-Pro 离心腔的外围,因此提取废液的速度过快可能会导致湍流,从而从团块中剪切掉细胞。这通过以下事实得到证实:当我们降低进液和排液速度参数时,发现回收率有所提高,与细胞总数较少的条件相当(图 1)。
有助于提高回收率的其他参数
在调整进液速度以提高回收率之前,我们检测了其他几种条件。例如,我们将 60 亿细胞条件的 IV 调整为 20 mL 进行测试(n = 1,未显示数据),以确定公式是否正确,因此需要在 IV(公式预测该条件的 IV 为 15 mL)中添加一个“容差系数”。令人感到意外的是这种调整并没有作用,其回收率与离心腔进液和排液参数较快的 15 mL 条件的回收率相似,均较低(约 60%,未显示数据)。这进一步说明,虽然 IV 中含有全部团块非常重要,但无法回收在提取操作期间剪切的细胞,可能需要考虑其他因素。
我们使用的另一个参数是将离心重力增加至 600 × g,将沉降时间增加至 10 分钟,以形成更佳的团块(n = 1;未显示数据)。结果发现回收率略微增加至 75%(未显示数据),但仍未完全达到要求。必须根据您的细胞类型调整这些参数,以避免离心力过高导致细胞死亡。
请注意,所有这些研究均在禁用光学传感器的情况下进行,这有助于确保 FV 和 RV 完全符合设置。如果细胞回收率比最终体积的最大化更重要,那么启用光学传感器可防止细胞分流到废液袋中。
未来将更深入地研究离心力和其他参数(如不同细胞类型和直径)对总体回收率的影响。
结论
在本研究中,为了保持细胞团块体积,防止被排出到 CultureWash C-Pro V432 的废液袋中,我们根据细胞总数对三种不同的 IV 条件进行了测试;即 20、40 和 60 亿个 221 细胞和 20 mL 最终体积。总体而言,在不超过 40 亿个细胞的预测公式的线性范围内(给定细胞直径约为 16 μm),回收率达到了 > 88%,这与经过调整的 CultureWash C-Pro 参数集的大团块回收率相似。
在最佳参数集条件下,洗涤步骤的细胞丢失率为 5% 或更少,这表明预测 IV 足以维持细胞团块。我们观察到,当洗涤步骤中细胞丢失率较高时,可以看到较大团块和洗涤缓冲液非常浑浊,这可能是由于进液/排液速度过快,以及从团块-上清液界面剪切了一些较松散的细胞所致。对于大于 40 亿个细胞的团块,我们建议将进液/排液速度设置为 30 mL/分钟,特别是在运行时间不如细胞回收率重要的情况下。
虽然本研究中检测的公式和参数指导有助于防止洗涤步骤中的细胞丢失,但我们建议让 CultureWash C-Pro 应用程序中的光学细胞检测参数自动运行工艺,并最大程度地减少细胞丢失的可能性。
鸣谢
Cytiva 对罗格斯大学提供此项研究使用的 721.221 细胞系表示感谢。