作者:Ben Tivey,研发科学家
简介
单细胞 RNA 测序 (scRNA-seq) 使研究人员能够更深入地研究细胞群之间的异质性。例如,临床医生可以探索罕见癌症活检的肿瘤内基因组异质性。而单核 RNA 测序 (snRNA-seq) 技术使用分离的细胞核而非整个单细胞来确定指定组织样本中细胞群的基因组图谱。细胞核通常是基因组应用的首选起始材料,因为他们可以在低温保存后进行提取和处理。全细胞容易因解冻而死亡。先前对 snRNA-seq 和 scRNA-seq 的比较研究得出的结论是,在成年小鼠肾脏中,snRNA-seq 可降低解离偏倚、消除解离引起的转录应激反应,甚至具有处理发炎纤维化组织的能力 (1)。
我们之前介绍过,VIA Extractor™ 温控型高效能组织处理器 (Cytiva) 可以将新鲜组织样本处理为产率高、活力强的单细胞悬液。在本文中,我们研究了 VIA Extractor™ 温控型高效能组织处理器将新鲜和速冻组织完全解离成单细胞核悬液(用于下游测序和后续分析)的能力。
图 1. (A) VIA Extractor™ 温控型高效能组织处理器将组织快速解离成单细胞核悬液,对原始组织样本影响较小,(B) 将 Omics 样本袋放入 VIA Extractor™ 组织处理器中,用 Omics 卡箍固定到位。(C) 将 VIA Extractor™ 组织处理器放入 VIA Freeze™ Uno 控速降温仪的顶部。
方法
从三只新解剖的 Crl:CD1 (ICR) 雌性小鼠 (Charles River) 中收集了小鼠肾脏和心脏组织。小心地将三对肾脏和六颗心脏分成两半。然后再将所有半颗心脏分成配对样本,进一步减少样本差异。每种组织类型取一半在液氮中速冻并置于 -80°C 下储存。另一半使用冰冷的 PBS(磷酸盐缓冲液)洗涤并称重(图 2)。
对于细胞核提取,采用 Fish 等人 (2) 提出的改进版方法使用 VIA Extractor™ 温控型高效能组织处理器。
对于新鲜的肾脏和心脏样本,使用 Omics 注射器 (Cytiva) 将组织注入 Omics 样本袋 (Cytiva) 中,热封,然后放入 Omics 卡箍 (Cytiva)。当对冷冻批次(已在 -80°C 下储存一个月)重复上述操作时,取出储存的每份样本,称重,并将 1 mL 组织裂解液直接添加到组织上,然后即可将样本注入 Omics 样本袋。
表 1. 每种条件下的平均小鼠组织重量,一式三份。
| 组织 | 条件 | 重量 (mg) |
| 肾脏* | 新鲜 | 235 |
| 肾脏 | 冰冻 | 289 |
| 心脏 | 新鲜 | 252 |
| 心脏 | 冰冻 | 188 |
* 两个新鲜的肾脏组织于 4°C 下保存 24 小时。
图 2. 使用新鲜或冷冻组织并结合使用 VIA Extractor™ 组织处理器与 VIA Freeze™Uno 控速降温仪的细胞核悬液制备工作流程。
使用鲁尔锁紧头注射器,将 4 mL 组织裂解液添加到 Omics 样本袋中,并用 Omics 卡箍固定。在 200 rpm 和 22°C 下处理样本 15 分钟。
使用 5 mL 鲁尔锁紧头注射器从端口取出 Omics 样本袋各部分内容物,随后通过 50 μm 细胞滤网进行过滤。离心后,去除上清液。然后将沉淀物重悬于固定液中并在冰上孵育。将一定容量的冰冷 PBS 添加到悬液中,混匀,通过 20 μm 细胞滤网进行过滤,并在相同条件下离心。将细胞核重悬于冰冷的 PBS 中,使用 Via2-Cassette (ChemoMetec A/S) 在 NucleoCounter NC-200 (ChemoMetec A/S) 上计数,并使用明视野显微镜(配合血细胞计数器)进行观察。使用 JMP 15.2 (SAS Institute) 完成了统计分析。
结果
在下面给出的数据中,我们证明了 VIA Extractor™ 温控型高效能组织处理器具有适应性,不仅适用于活细胞、单细胞解离,也适用于单细胞核分离。
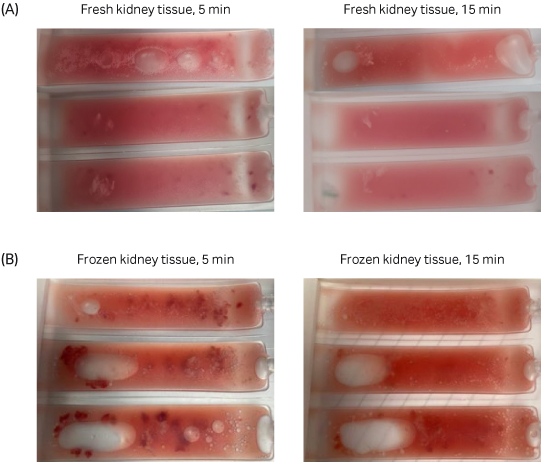
图 3. Omics 样本袋中新鲜和冷冻的肾脏组织悬液解离 5 分钟与解离 15 分钟之间的比较。使用 VIA Extractor™ 温控型高效能组织处理器 15 分钟后,新鲜和冷冻肾脏样本均完全解离。
使用 VIA Extractor™ 温控型高效能组织处理器 15 分钟后(200 rpm,22°C),新鲜和冷冻样本成功解离(图 3)。
表 2. 每种组织类型和条件下的平均细胞核聚集百分比和标准误差值。
| 组织 | 条件 |
聚集(% 和 SE) |
| 肾脏 | 新鲜 | 2.3 ± 0.7 |
| 肾脏 | 冰冻 | 2.0 ± 1.0 |
| 心脏 | 新鲜 | 1.7 ± 0.9 |
| 心脏 | 冰冻 | 4.3 ± 2.4 |
为了减轻下游的问题,在进行 snRNA-seq 时,将聚集保持在最低状态是关键。在使用 VIA Extractor™ 温控型高效能组织处理器对细胞核进行解离后,我们观察到新鲜和冷冻肾脏和心脏样本之间的聚集百分比差异极小,返回结果显示每份样本中所有平均聚集百分比均 < 5%(表 2; t 检验;肾脏 p = 0.80;心脏 p = 0.39)。
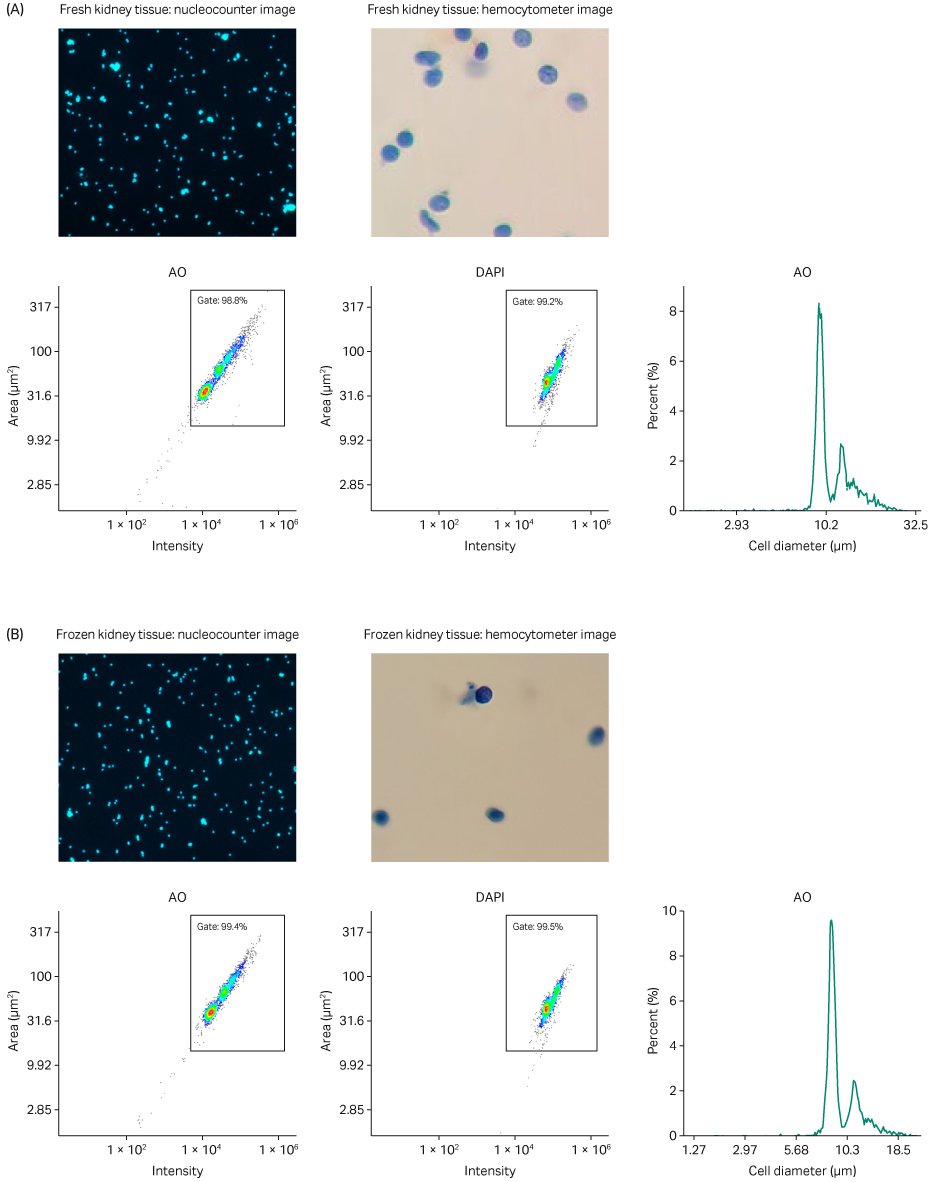
图 4. (A) 新鲜和 (B) 冷冻肾脏组织的单细胞核悬液分析。使用 NucleoCounter NC-200 和 Via2-Cassette 进行 AO 和 DAPI 合并染色;使用明视野显微镜(配合血细胞计数器)检查细胞核完整性;AO 强度与面积散点图;DAPI 强度与面积散点图;表示细胞直径估计值与样本中所占百分比的直方图(默认细胞直径代替细胞核直径)。
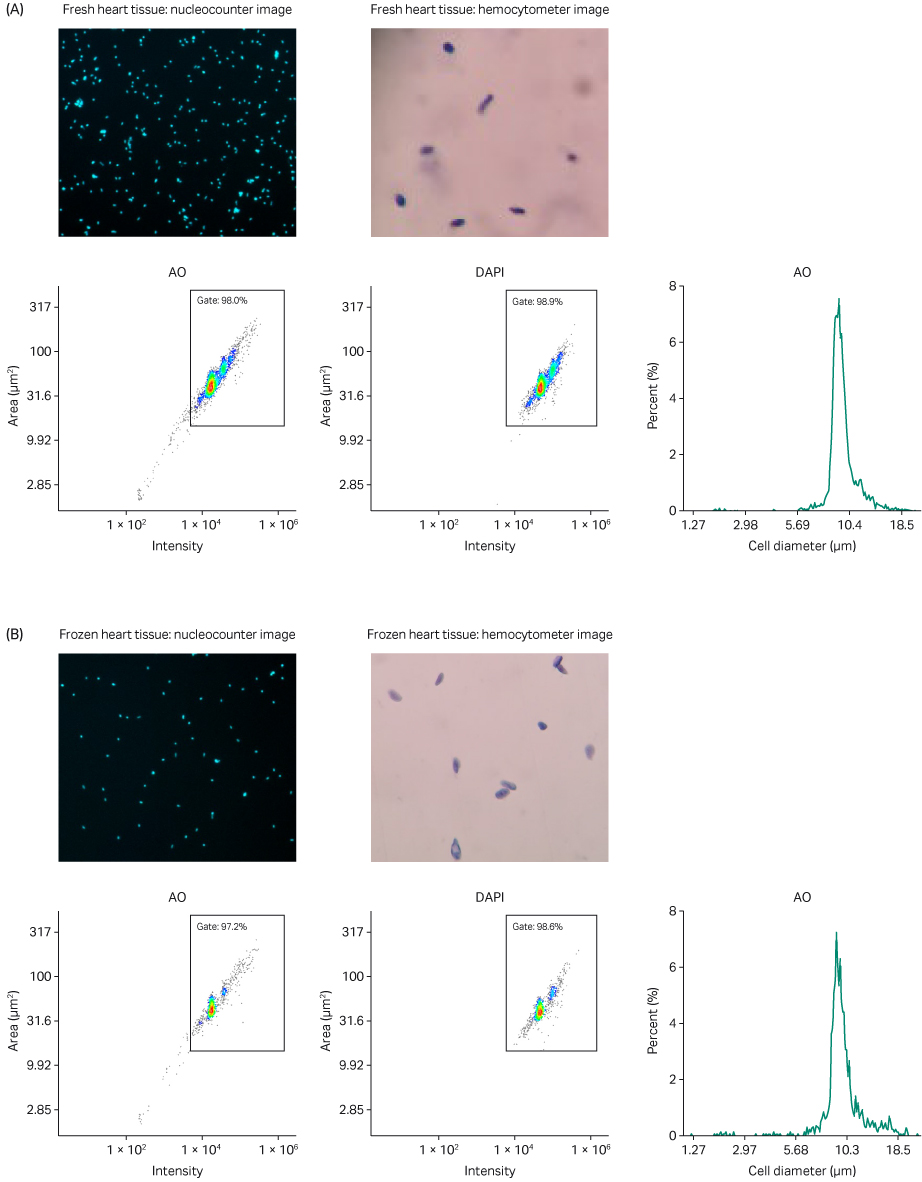
与自动计算的聚集估计数值相符,在吖啶橙 (AO) 和 4’,6-二脒基-2-苯基吲哚 (DAPI) 合并染色中实际观察到细胞核聚集情况极少(图 4 和 5)。由于 AO 和 DAPI 都对 DNA 具有高亲和力,图像显示特定细胞核及其周围邻近部分形成鲜明对比。这些数据表明,VIA Extractor™ 温控型高效能组织处理器能够从新鲜和冷冻的肾脏和心脏组织中可靠地制备出聚集百分比很低的细胞核混悬液。
结合使用明视野显微镜和血细胞计数器,我们能够评估每份样本中存在的核膜的完整性。每张明视野图像均表明核膜保持完整(图 4 和 5)。为了进一步加强我们的观察,特别是在心脏样本中,您可以很容易地发现心肌细胞核的椭圆形特征(图 5)。VIA Extractor™ 温控型高效能组织处理器可处理肾脏和心脏组织并分离单个细胞核,且不会对组织中的核膜造成损伤。
图 5. (A) 新鲜和 (B) 冷冻心脏组织的单细胞核悬液分析。使用 NucleoCounter NC-200 和 Via2-Cassette 进行 AO 和 DAPI 合并染色;使用明视野显微镜(配合血细胞计数器)检查细胞核完整性;AO 强度与面积散点图;DAPI 强度与面积散点图;表示细胞直径估计值与样本中所占百分比的直方图(默认细胞直径代替细胞核直径)。
散点图显示了细胞核大小分布和 AO 和 DAPI 的染色强度。小而暗的颗粒计数极低(散点图的左下方),这表明无论是新鲜还是冷冻样本,在两种组织类型中都存在限量的碎片。在图 4 和 5 中,流式细胞术散点图分析结果表明,无论是新鲜组织还是冷冻组织,细胞聚集程度以及获得的细胞比例均相似。
每个直方图(图 4 和 5)在大约 9 至 10 μm 的细胞/细胞核直径处均存在一个常规峰,这与典型的哺乳动物细胞核约为 5 至 10 µm 的事实一致 (4)。图 4 中直方图中主峰右侧的小峰很可能是细胞核的双峰伪影,其在样本中存在的总物质百分比明显更低。
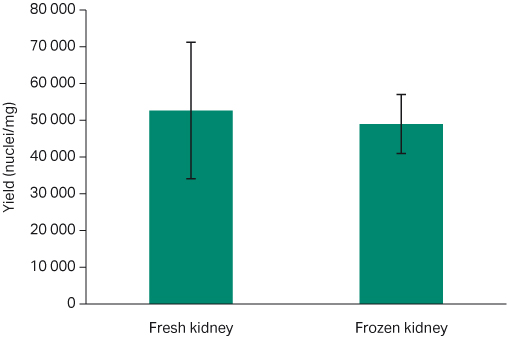
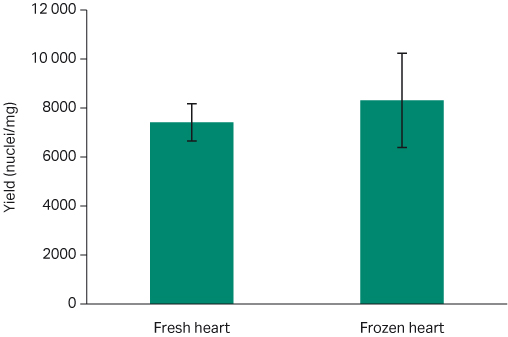
使用 Chromium Single Cell Nuclei Isolation Kit (10X Genomics) 从健康冷冻组织中获得的典型细胞核回收率约为 5,000 至 15,000 个细胞核/mg (5)。我们的结果表明,各组织类型之间呈比例一致性,新鲜和冷冻样本之间无显著差异 (P > 0.05)。新鲜小鼠肾脏样本的平均产率为 52,667 ± 18,559 个细胞核/mg,而冷冻肾脏组织的平均产率为 49,000 ± 8,020 个细胞核/mg(图 6;t 检验 p= 0.86)。新鲜的小鼠心脏组织样本的平均产率为 7,414 ± 762 个细胞核/mg;而冷冻心脏样本的平均产率为 8,316 ± 1,926 个细胞核/mg(图 7;t 检验 p=0.89)。
图 6. 新鲜和冷冻肾脏组织的每毫克平均细胞核产率的比较(带标准误差线)。新鲜:52,667 ± 18,559 个细胞核/mg;冷冻 49,000 ± 8,020 个细胞核/mg(t 检验 p = 0.86)。
图 7. 新鲜和冷冻心脏组织的每毫克平均细胞核产率的比较(带标准误差线)。新鲜:7,414 ± 762 个细胞核/mg;冷冻 8,316 ± 1,926 个细胞核/mg(t 检验 p=0.89)。
结论
我们之前介绍过,VIA Extractor™ 温控型高效能组织处理器可以得到产率高、活力强、细胞脆性低的单细胞悬液。
在本文中,我们证明了 VIA Extractor™ 温控型高效能组织处理器可以将固体肾脏和心脏组织样本处理为单细胞核悬液。无论是新鲜还是冷冻组织样本,VIA Extractor™ 温控型高效能组织处理器均能制备出一致、均质的单细胞核悬液,并且产率高、核膜完整、聚集百分比低。这些悬液可进一步用于下游的 snRNA-seq 和后续分析,确定罕见细胞群的转录情况。
该数据基于三项独立的实验,每项实验采用相同的重复次数。根据制造商的方案和建议,对所有受测样品采用相同的处理方式(对比实验中所有受试产品的重复次数均相同)。数据于 2022 年 4 月至 8 月期间在 Cytiva 位于英国卡迪夫 Maynard Centre 的研发实验室收集,并保存于此处。
参考文献
- Wu H, Kirita Y, Donnelly EL, Humphreys BD. Advantages of single-nucleus over single-cell RNA sequencing of adult kidney: Rare cell types and novel cell states revealed in fibrosis. J. Am. Soc. Nephrol. 2018;30(1):23-32.
- Fish KN, Soderberg-Naucler C, Mills LK, Stenglein S, Nelson JA. Human cytomegalovirus persistently infects aortic endothelial cells. J. Virol. 1998;72(7):5661-5668.
- Condorelli G, Morisco C, Stassi G, et al. Increased cardiomyocyte apoptosis and changes in proapoptotic and antiapoptotic genes bax and bcl-2 during left ventricular adaptations to chronic pressure overload in the rat. Circulation. 1999;99(23):3071-3078.
- Li G-W, Xie XS. Central dogma at the single-molecule level in living cells. Nature. 2011;475(7356):308-315.
- What is the expected nuclei yield recovered using the Chromium Nuclei Isolation Kit. Accessed September 15, 2022.