表面等离子共振 (SPR) 测定可用于生物制药整个生命周期,从靶标鉴定到 CQA 测定、开发和持续质量控制。本文重点介绍与后期开发以及生物疗法药物化学生产和控制相关的浓度测定。
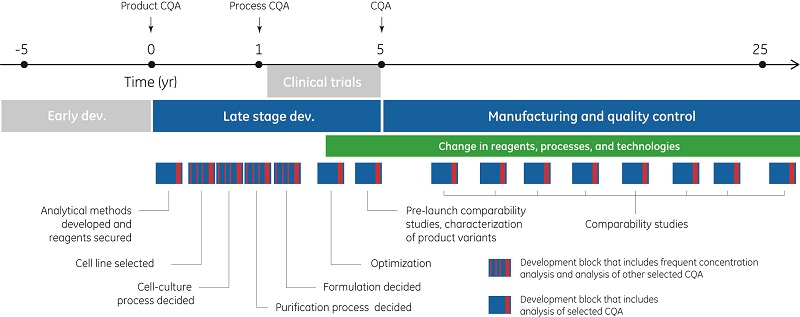
生物疗法产品的生命周期通常超过三十年。早期开发可能会超过五年,之后进入后期开发和临床试验。一旦获批用于初始适应症,有效的产品可在生产和质量控制阶段持续二十多年,随着时间的推移会用于其他更多适应症。
对生物仿制药、更复杂的抗体疗法和生物制品的需求不断增长,同时也对用于筛选、表征、可比性和放行测试的测定和技术提出了越来越高的要求。临床开发过程中候选药物的损耗是导致开发成本居高不下的主要因素。可开发性评估小组负责评估潜在的候选药物,确保具有良好毒性、免疫原性、疗效以及药理药效的新生物实体继续开发,并降低后期损耗的风险。当主要候选药物进入后期开发阶段时,要根据所需的生物学结果和功能(即作用方式)在详细的质量指标测定表中提早定义。
然后使用候选分子的综合表征来设置关键质量属性 (CQA) 的适当范围。这些特征应使用最敏感的方法进行评估,以识别药物差异并评估对作用机制至关重要的生物学功能。在整个生物制药行业中使用 Biacore 系统的表面等离子共振 (SPR) 广泛用于表征和质量控制。
关键质量属性是确保监管合规性的基础
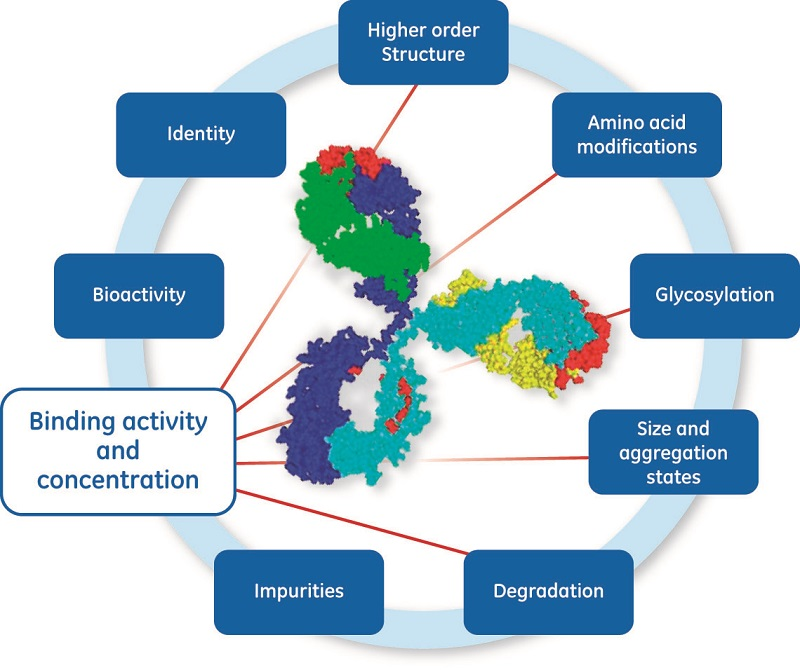
CQA 通常包括候选药物与目标蛋白相互作用的数据以及与工艺相关的 CQA,例如蛋白完整性、同质性、宿主细胞蛋白的存在,宿主细胞 DNA 以及从工艺或包装材料中释放的物质。(图 1)对于工艺中的每个步骤,确定可能影响 CQA 的关键工艺参数 (CPP) (1),并确定控制策略。为了支持此工艺,已在生物技术/生物产品监管指南 (2) 中载明了对测试程序和验收标准的要求。
在开发生物制品和生物仿制药时,测定的质量、准确性和可靠性尤为关键。目标分子的功能是开发一系列测定的关键(如图 2 所示),有助于确保药品质量和整个生命周期内的工艺一致性。CQA 分析可能会使用多种 (50~60) 不同的分析技术 (3)。酶联免疫吸附测定 (ELISA) 和表面等离子共振 (SPR) 通常用于通过测量与抗原、受体、FcR 或其他结合蛋白的相互作用来进行生物活性体外测定 (3, 4)。本文重点介绍与后期开发以及生物疗法药物化学生产和控制相关的浓度测定 CMC (5)。
在工艺开发过程中,目标是获得较高的产品产量和良好的工艺经济性,以确保维持与初始 CQA 相关的特性,并确保工艺本身得到有效控制且杂质含量低。在后期开发的所有步骤中会始终对初始 CQA 进行监控,并对可能出现的新 CQA 进行评估。在转移至生产前,将建立 CQA 的完整列表以及控制方法。生产和质量控制 (QC) 确保向市场提供质量稳定的产品。CQA 是在即定时间利用最新知识确定的,以后可能需要根据随时间累积的临床数据进行修改。监管机构对药物开发和生产公司提出的要求越来越严格,要求他们使用能保证质量的设备,遵循广泛的分析和生产程序,并维持详细的文档记录。这一控制措施是为了确保投放市场的药品的质量始终如一和可靠。
基于配基结合的 Biacore 测定
配基结合测定是表征生物疗法药物的关键。SPR 和 ELISA 是广泛使用的配基结合测定法。Cytiva 的 Biacore 系统和配基结合测定’基于表面等离子共振 (SPR) 分析,用于抗体表征已超过 20 年。
Biacore 系统读出的数据与分子量有关,无需使用标记即可检测任何结合事件。读取数据是连续的,可对整个结合事件进行质量控制。因此,可基于在一个或几个特定时间点获得的结合反应(报告点分析)或者通过比较甚至拟合整个结合曲线实施数据分析,确定动力学、亲和力以及与参比制剂的可比性。
Biacore 系统可实现高精度的活性浓度测量
浓度分析在好几个工艺开发步骤中都至关重要:确定细胞培养物随时间的产量;确定合适的层析条件;监测最终纯化工艺;用于配方研究。
最简单的浓度测量可以基于在 280 nm 波长处测得的吸光度值(A280 值)进行,但这种测量需要忽略其他吸收紫外线的物质的干扰。A280 值通常与 HPLC 研究结合使用。不过,如果产生的浓度数据不仅关联总蛋白浓度,还能关联特定蛋白甚至蛋白的功能/活性,那将可能更有意义。
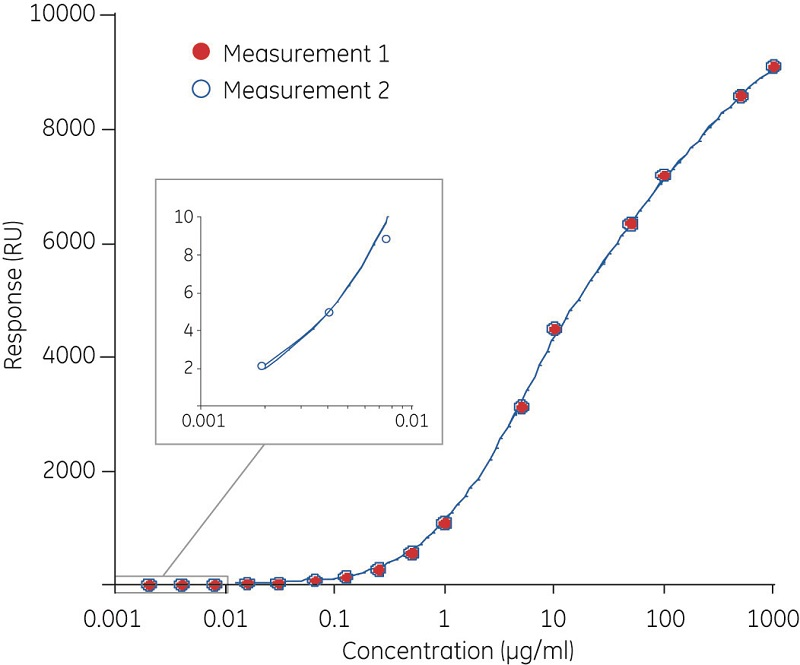
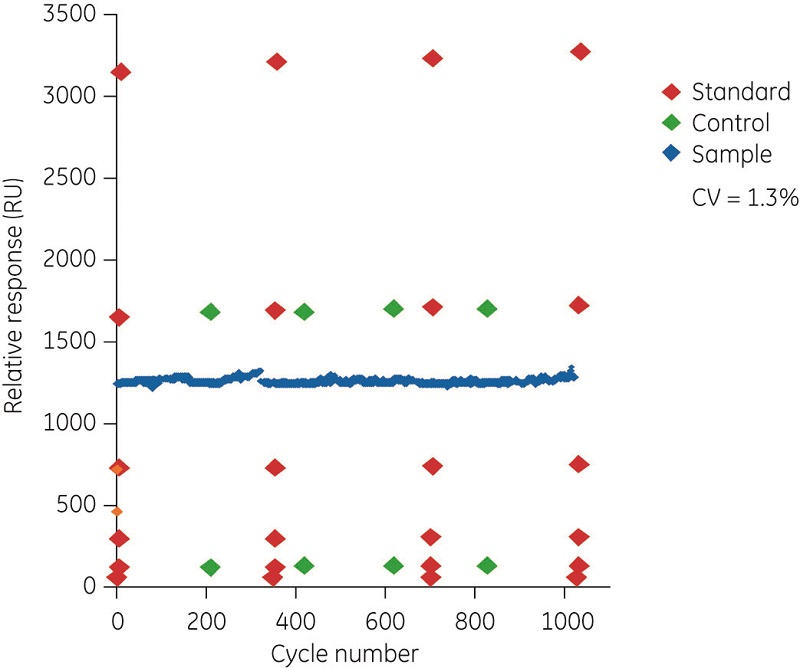
图 3 是使用 Biacore 系统进行浓度分析的动态范围和精度。测定读出数据是在样品注入结束时的报告点的数据。在这些实例中,传感器表面上固定有抗人 Fc 抗体。在图 3A 中,注入浓度为 2 ng/ml 至 1 ng/ml 的奥马珠单抗 3 分钟。插图显示了最低浓度 (2~8 ng/ml) 的响应。该测定允许微调,并且可以根据目标浓度范围调整分析时间。在图 3B 中,样品注入时间缩短到 20 秒,目标浓度范围是 0.5~50µ g/ml。该图显示了在同一表面上经过 1000 次分析循环重复注入标准品、控制品和一种选定样品而获得的数据。值得注意的是,标准品和对照样品随时间逐步稳定,重复样品的变异系数为 1.3%。
显然,Biacore 测定灵敏,具有宽动态范围的测定潜力,测定速度非常快,并且基于 Biacore 系统设计,可以多路复用,能并行运行多个测定。
新型免校准浓度分析,可实现快速浓度测量
基于配基结合的浓度分析通常需要已知活性浓度的标准制剂。但是,标准制剂并非一直可用,比如,蛋白首次表达时或者标准制剂的浓度数据反映的是总蛋白浓度而不是活性浓度时,标准制剂就不可用。在这种情况下,Biacore 分析可用于直接评估活性浓度。这种可能性最早在 1993 年被提出 (6),已通过用于数据分析的现代数值积分工具得到了完善 (7)。假设分析物的扩散系数已知并且观测到的结合率与流速相关,则图 4 所示免校准浓度分析 (CFCA) 方法可提供较精准的绝对浓度估算。
CFCA 的多种用途
CFCA 是比较浓度数据的出色工具,对于试剂表征特别有用。当动力学分析和传感图比较方法指示相互作用的变化与活性浓度的变化有关时,CFCA 也可以作为补充。使用 CFCA 分析层析馏分并指导纯化工作的内容见参考文献 8。由于 CFCA 能够轻易获得相对浓度数据,它也可以用于补充和支持效力测定。
汇总
生物疗法试剂的生命周期可以延长二十到三十年。在此期间,制造商必须开发并交付质量稳定的产品。作为支持,FDA 和 EMA 等监管机构发布了旨在确保生物疗法药物效力的指南。开发了 Biacore 系统,用于在受监管的环境中运行,此外,系统还提供和维护支持以及同时具备开发灵活性和 QC 环境严谨性和可重现性的软件。
SPR 是一种直接结合技术,在整个生物疗法药物生命周期中与广泛的应用程序相关。使用 Biacore 系统的 SPR 在早期开发中用于定义 CQA。在后期开发中,SPR 可用于细胞培养、纯化和配制工作流程中的浓度分析,而 Biacore 浓度测定是在整个生产阶段进行质量控制的有用工具。CFCA 方法为快速测量绝对浓度和相对浓度带来了新的机遇,对效力测定具有重要意义。
如需更全面地了解关于使用 Biacore 系统进行配基结合测定的许多应用程序的讨论,请参见白皮书、生物疗法药物后期开发和质量控制中的 Biacore 浓度和配基结合分析。
- Mitchell, M. Determining criticality-process parameters and quality attributes. Part I: Criticality as a continuum. BioPharm International 27, 38–47 (2013).
- European Medicines Agency ICH Topic Q 6 B. Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products. (2006).
- Lubiniecki, M. F. A. et al. Analytical lessons learned from selected therapeutic protein drug comparability studies. Biologicals 41, 131–147 (2013).
- Visser J. et al. Physicochemical and functional comparability between the proposed biosimilar rituximab GP2013 and originator rituximab. BioDrugs, 27(5), 495–507 (2013).
- Jones, S. D. et al. CMC activities for Development of Mabs, Critical steps to reach IND with a therapeutic antibody. Contract Pharma, pp 60–63 (20I0).
- Karlsson, R. et al. Analysis of active antibody concentration. Separation of affinity and concentration parameters. J. Immunol. Methods 166(1), 75–84 (1993).
- Pol, E. The importance of correct protein concentration for kinetics and affinity determination in structure-function analysis. J. Vis. Exp. 17, 1746 (2010).
- Application note: Accurate comparability assessment of a biosimilar interferon in process development, Cytiva, 29-1154-78, Edition AC (2014).