使用表面等离子共振 (SPR) 的表位鉴定可以用于早期抗体药物的筛选。本文详细介绍了如何使用 SPR 鉴定不同的抗体是否识别相同的抗原表位进行抗原表位鉴定,以及如何用它进行疫苗、治疗性抗体以及诊断试剂的开发。
表位鉴定在抗体开发过程中的作用是什么?
治疗性单克隆抗体 (mAb) 在生物制药市场中占有很大的份额,占治疗性蛋白质销售额的 50% 以上,并且还在逐年增长。在开发新疫苗、治疗性抗体和诊断试剂的过程中,选择具有适当亲和力、特异性和生物物理特性的 mAb 至关重要。
在表位鉴定中,针对同第一个抗体原的特异性 mAb 与一组中的所有 mAb 成对进行测试,以评估它们是否阻断彼此与抗原特定位点的结合。阻断与相同表位结合的 mAb 被“合并”在一起。抗体药物开发的早期阶段通常会产生许多线索,这意味着选择最佳候选药物进行进一步研究至关重要。同一个 bin 中的 mAb 通常具有相似的功能,因此表位 bin 可以将选择范围缩小到更少的候选者可供研究人员选择。。另外,尽管相同bin的抗体能够与结合相同的抗原位点,但它们可能具有不同的作用机制,这对于治疗某些类型的癌症和传染病至关重要。表位多样性对于扩大知识产权 (IP) 保护也很重要(请参见表位信息使用的当前最佳实践综述)。
可通过哪些分析策略更明智地选择抗体?
近些年,生物工程得到了快速发展,科学家目前可针对日益复杂的靶标或疾病途径设计新型抗体。抗体已从简单的 mAb 演变为更复杂的形式,例如 BITES、多特异性抗体、抗体偶联药物等。这增加了分析负担,并提高了对更先进分析技术的需求。为了应对这些挑战,生物传感器已被纳入药物发现工作流程。自 1990 年代初以来,基于表面等离子共振 (SPR) 的生物传感器已用于表位鉴定。
使用传统的 ELISA 和放射免疫分析 (RIA) 进行表位鉴定需要大量时间来纯化抗体和开发标记方法。使用无标记生物传感器的表位鉴定检测可以以相对低的成本和高通量自动化的方式筛选候选分子,从而实现高效的候选药物优化和抗体对鉴定。
表面等离子共振 (SPR) 检测方法建立
通过 SPR 进行表位鉴定有一系列成熟的方案。与 ELISA 方法及常规检测方法类似,一致SPR使用一种抗原及与之结合的两种待测抗体进行检测。Biacore 8K 和 Biacore 8K+ 与 Biacore Insight 结果分析软件相结合,并利用全新 Biacore Insight Epitope Binning Extension,提供了三种通用的检测方式:夹心法、预混合法和串联法(图 1),作为预置方案进行表位鉴定。
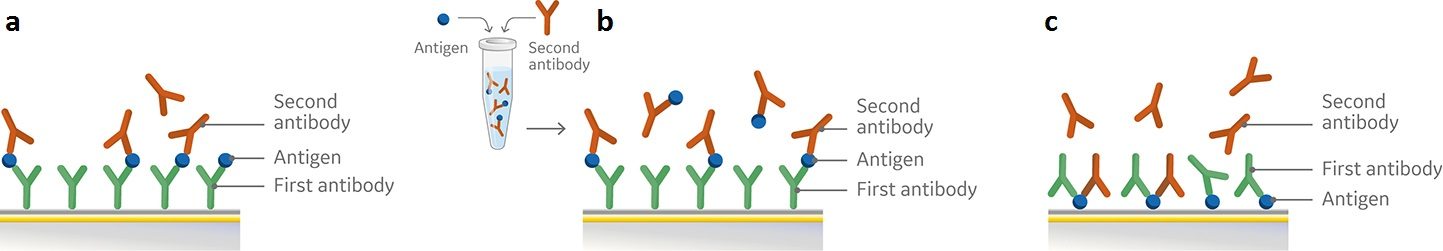
图 1. 利用 a) 夹心检测、b) 预混合检测和 c) 串联检测进行表位鉴定示意图。所有这三种检测形式都需要将第一个抗体(a、b)或抗原 (c) 固定到传感器芯片表面,然后依次按顺序进样抗原和第二个抗体(a),或进样预混合的抗体 (b) 或第两个抗体 (c)。
在图 2 所示的夹心法中,第一个抗体被捕获或共价固定到传感器表面。然后进样抗原并与第一个抗体结合。随后再进样第二个抗体。再图 3 的传感图,从 0 到 120 秒 (s) 显示了抗原与固定的第一个抗体的结合。在 120s时,开始进样第二个抗体。第二个抗体要么与抗原结合,产生“夹心”结合(蓝色),要么被第一个抗体阻断而不与抗原结合(橙色)。如果第二个抗体可以在第一个抗体存在的情况下与抗原结合,则它们具有不同的表位,因此属于不同的bin。如果第二个抗体再第一个抗体存在的条件下无法与该抗原结合,则两个抗体都属于同一个bin。
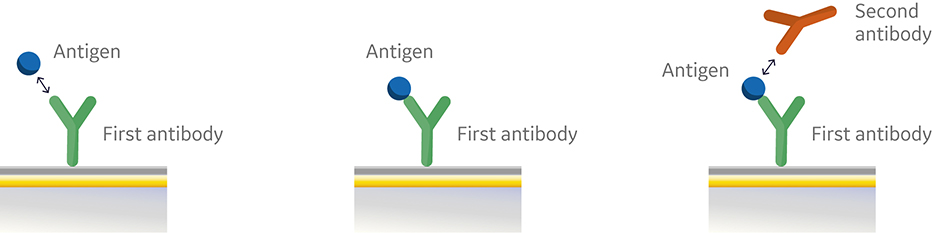
图 2. 夹心法检测进样顺序示意图
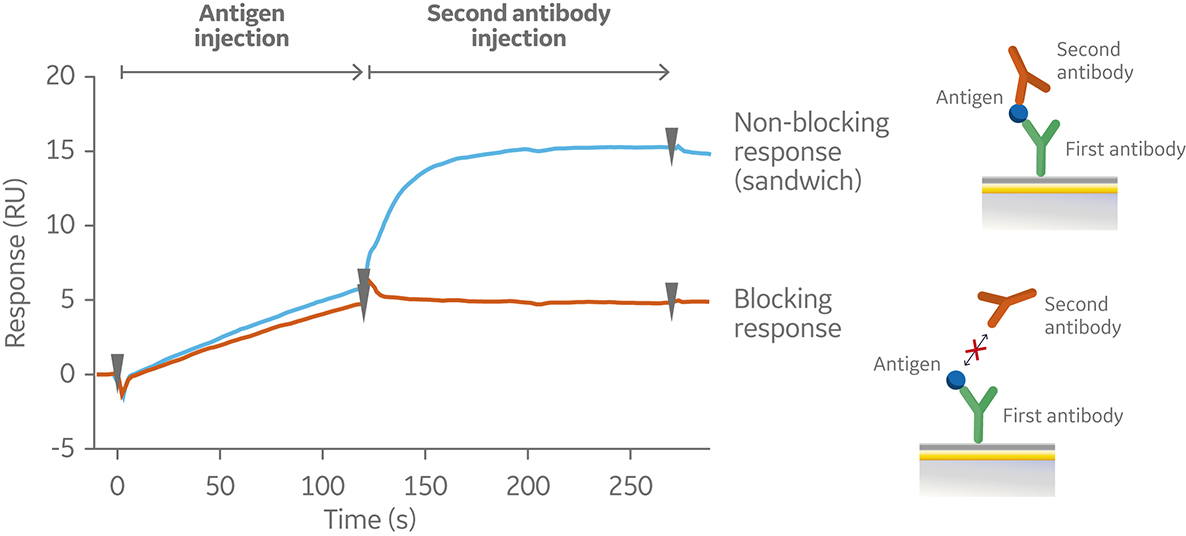
图 3. 夹心法检测结果的传感图,即两个抗体竞争(橙色)或非竞争(蓝色)结合相同抗原表位,和。第一个抗体被预先固定在传感器芯片表面上(未显示)。
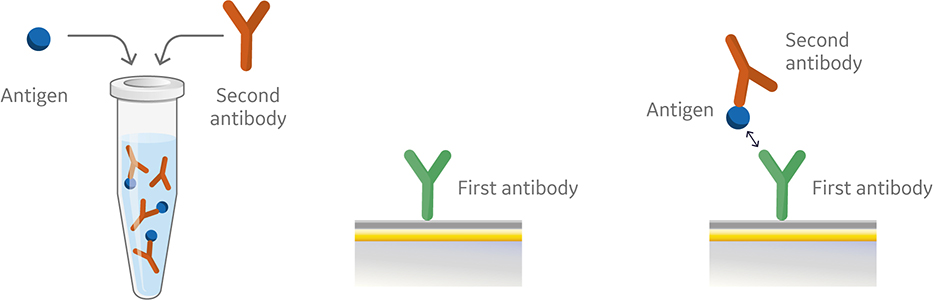
图 4. 预混合检测方法的进样顺序。
与夹心检测类似,预混合检测中的第一个抗体被捕获或共价偶联到传感器芯片表面。但是,在预混合检测中,过量的第二个抗体和抗原在进样前在仪器外进行混合(图 4)。然后,将该抗体和抗原混合液进样到仪器中。图 5 显示了预混合检测的传感图。
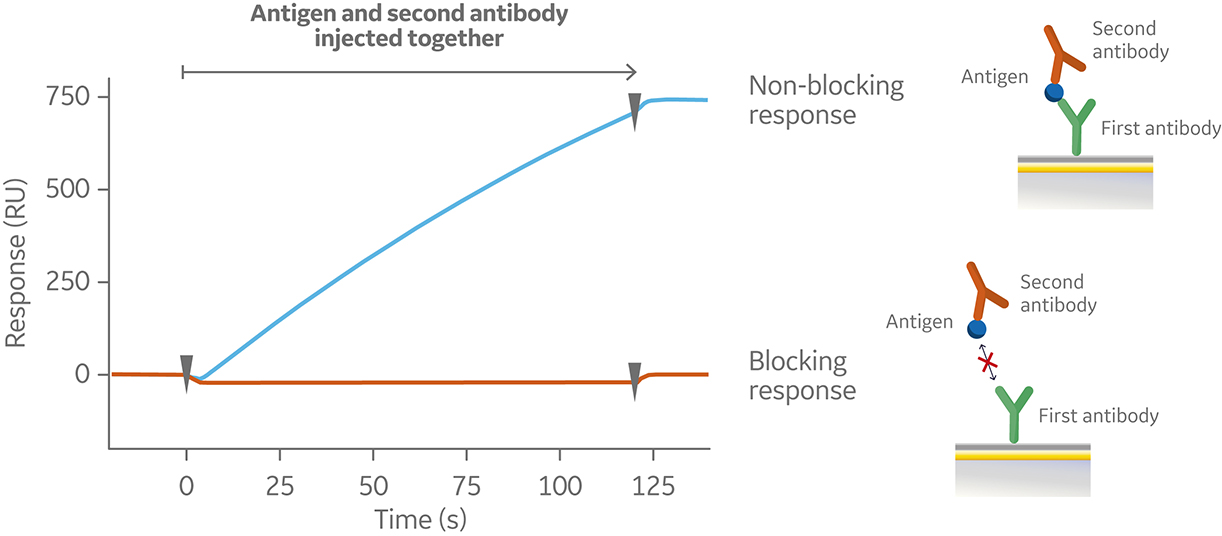
图 5.预混合检测的传感图,显示了在预固定的第一种抗体上进样预混合的抗原和第二个抗体(传感图中未显示),会产生非阻断(蓝色)和阻断的结合(橙色)。
在串联检测中,抗原被捕获或与共价偶联至传感器表面。然后,进样第一个抗体并达到饱和进样,再进样第二个抗体。图 6 显示了典型的串联检测传感图。
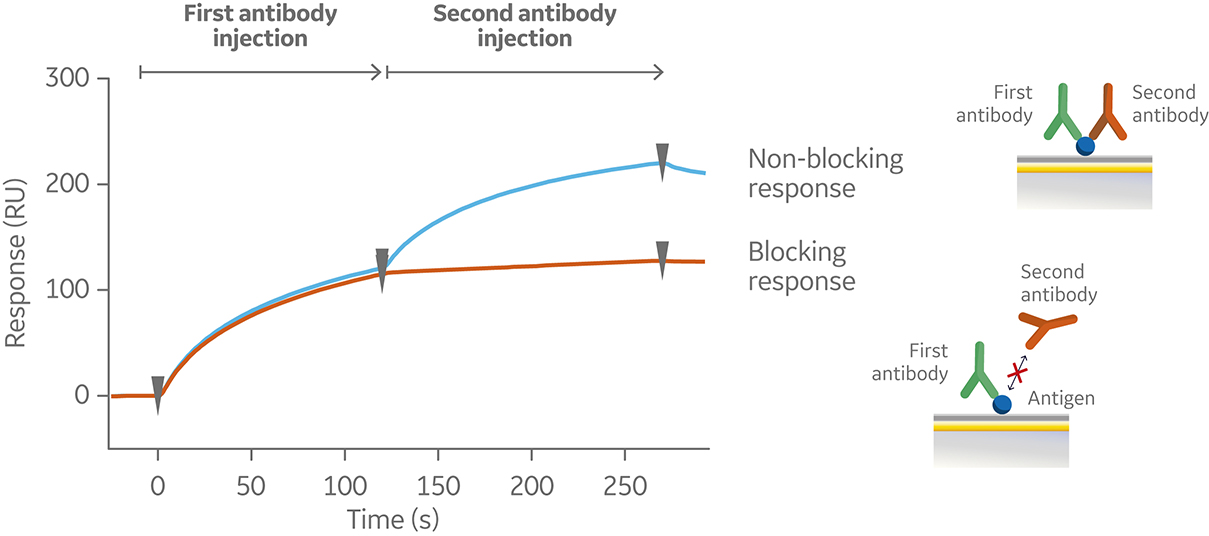
图 6. 串联检测的传感图,显示了在预先固定了抗原(传感图中未显示)的芯片表面连续进样两个抗体后的非阻断(蓝色)和阻断(橙色)响应。
不同的检测形式能够互相互补,并且具有不同的优缺点。当已知再生条件时,夹心检测的方法建立相当简单。预混合检测方式则适用于多价抗原的检测,如果需要验证夹心检测的结果,则通常使用该形式。但是,预混合抗体的浓度必须大大超过抗原浓度。
串联检测方式在概念上很简单,也能用于多价抗原的检测。但是它需要固定少量的抗原,并且第一个抗体必须能够使抗原上所有特异性结合位点饱和。
基于Biacore 系统的快速进步,实验方法的选择取决于所研究的分子和试剂,而不是仪器或技术本身。
自动进行表位鉴定分析并找到最佳bin
在给定的检测模式下,可采用对称或不对称的方式进行运行。对于对称检测,通过切换抗体与其抗原结合的顺序,对不同组合的抗体进行检测。。这种方法能够得到明确的结果,但对于较大的矩阵,对称运行将在短时间内产生大量数据。这是因为所需要检测的数量与待测抗体数呈几何倍数增长。例如,20 × 20 的表位鉴定分析将产生 400 个相互作用分析(图 7)。
或者,可以通过不对称方式对不同表位的的待测抗体或者已商业化抗体(如果正在开发新药,应避免使用已商业化药物的bin)进行检测。例如,一个 8 × 200 的检测将有效减少对称运行中需要检测的相互作用的数量。并且通过不同检测方法的互相验证(例如夹心检测,后再进行预混合检测),来提高对称检测和不对称检测结果的可信度。
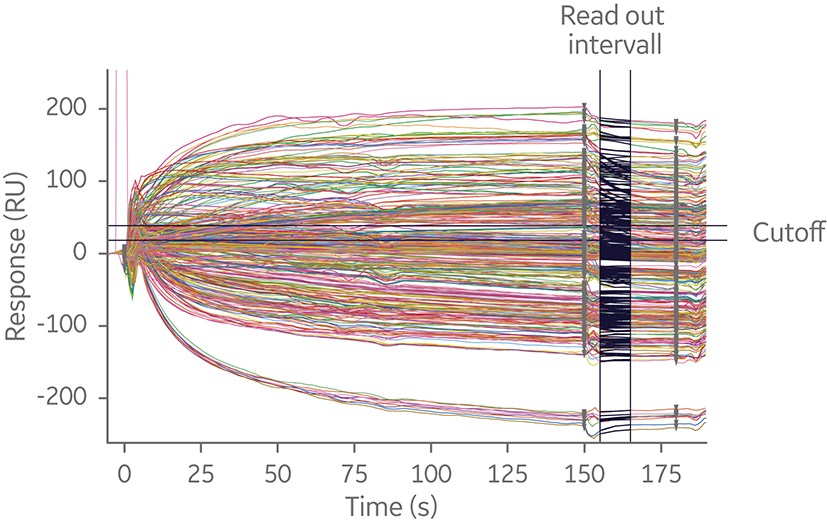
图 7. 20 × 20 的夹心法 SPR 检测传感图叠加。该实验通过捕获抗体检测方式,最大程度地减少检测方法开发所需时间。
无论在抗体药物开发的哪个环节进行表位鉴定,大量的相互作用分析都很耗时。
因此,必须要借助有效的工具对表位鉴定数据进行分析和评估。图8显示了目前常用的可将表位鉴定检测的数据可视化的两种方法:热图和bin轮图。Biacore Insight Epitope Binning Extension 中使用的热图综合展示了共表位(红色)、不同表位(白色)和不确定是否共表位的抗体对(黄色)。因此,热图可作为发现不确定结果(需要对数据进行更仔细地分析)的指南。而bin轮图则将所有检测抗体的bin的分布进行可视化呈现,并将具有相同bin的抗体用相同的颜色标注。此外,具有部分重叠表位的抗体用不同的颜色标识,并且彼此相邻排列。此外,不同bin之间的单向和双向行为都用箭头标记。总而言之,bin轮图是一种全面展示表位鉴定结果的图形。
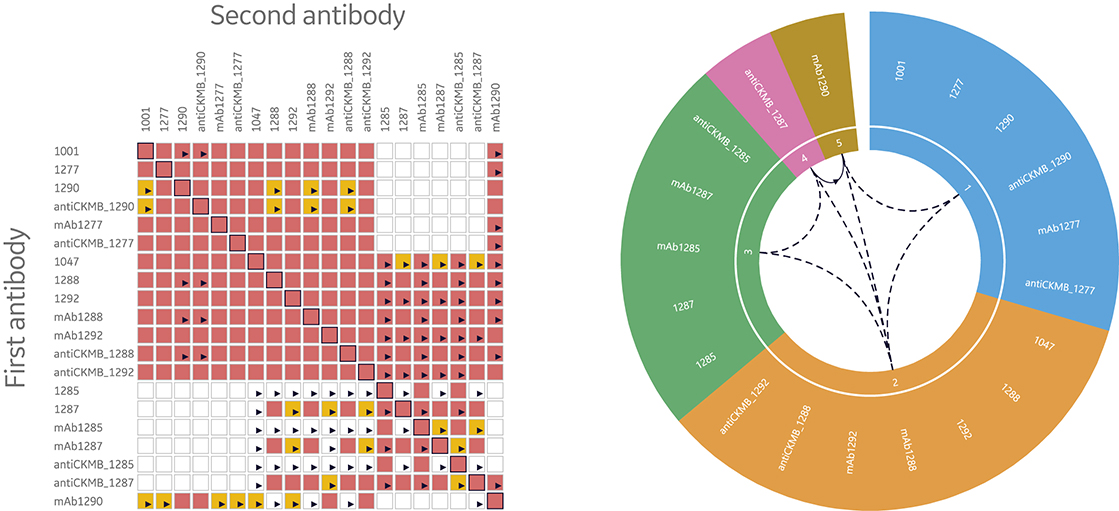
图 8. 热图和bin轮图是 Biacore Insight Epitope Binning Extension 的核心功能,通过对 Biacore 8K 系列和 Biacore T200 系统的表位鉴定结果进行自动分析和可视化,使数据分析评估更加有效。
克服抗原与第一个抗体结合的不稳定所带来的假阴性
不论采用何种技术(无标记与 ELISA),表位鉴定中的夹心法检测和串联检测都存在一个普遍的问题,即抗原与第一个抗体之间结合的亲和力低。这导致抗原在清洗过程中发生解离,并导致后续的第二个抗体的结合水平降低,从而导致将抗体并入到同一个Bin中,而实际上根本没有被阻断。
为了解决这个问题,在使用Biacore 系统时,可使用 Dual 命令进样抗原和第二个抗体。该命令会依次注入两种溶液,中间没有任何时间间隔。因此,在进样第二个抗体之前,可最大程度地减少抗原的解离。这是 Biacore SPR 系统相对于其他技术(例如 ELISA)在表位鉴定研究方面的优势之一。
通过 Dual 命令,同样可以对快速解离抗原的鉴定数据进行分析,因为它在进样第二个抗体之前最大程度地减少了抗原的解离。
图 9 显示了使用 Biacore 8K 的 8 × 1 夹心检测的传感图。将 8 个抗体分别预先固定在通道 1 至8,再依次进样抗原和第二个抗体。检测时,先进行单独进样(左),然后使用 Dual 进样命令检测(右)。8 个预固定抗体中有一个对抗原显示出低亲和力。
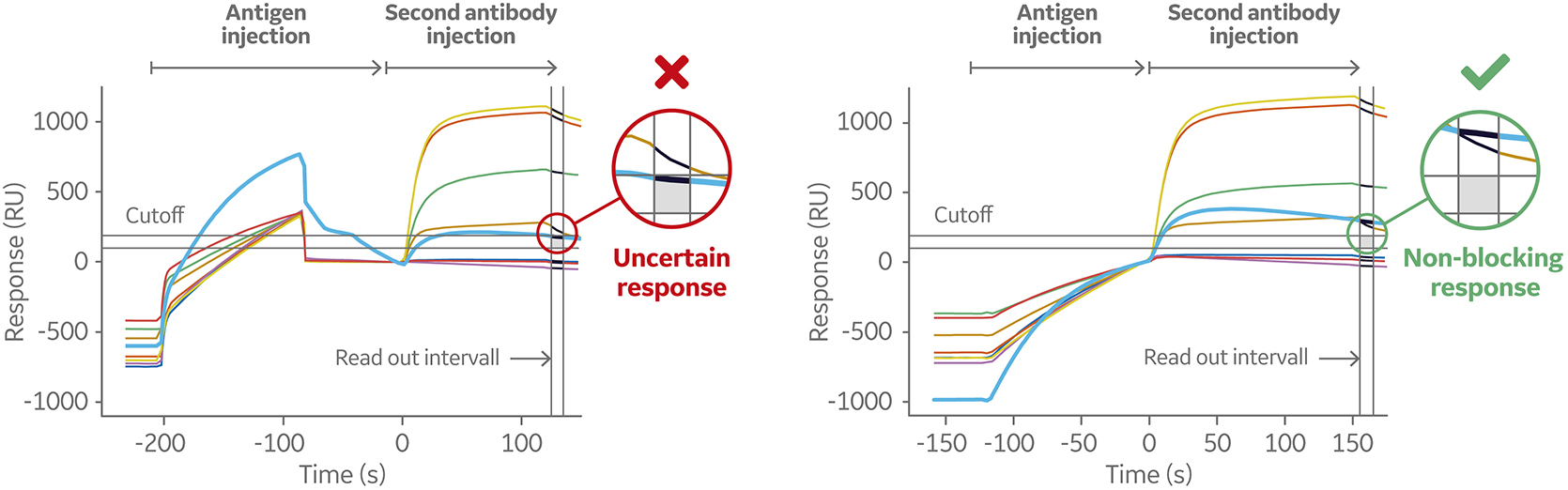
图 9. 传感图(左)显示了抗原与第一个抗体的结合较弱,这可能导致第二个抗体的结合水平降低。右侧的传感图显示了使用 Dual 命令的相同夹心检测设置。这将按顺序连续进样两种溶液,不进行中间洗涤和任何时间间隔,从而在进样第二个抗体之前将抗原的解离降至最低。
结论
药物发现和开发的一个关键部分是寻找并专注于最具前景的候选药物。使用 SPR 系统的表位鉴定分析可以在开发过程的早期为研究人员提供了有关治疗性抗体的功能信息。表位多样性对于扩大 IP 保护也很重要。但是,与表位鉴定分析相关的最大挑战是对大数据集进行有意义的评估。
Biacore 8K 和 Biacore 8K+ 与 Biacore Insight Epitope Binning Extension 相结合,提供了内置的检测方法和自动分析工具,可快速分析评估各种检测方式的的表位鉴定数据。这使研究人员可快速确定样品的优先次序用于进一步的表征,并自信地得出结论。
- Biacore 参考文献列表;详细介绍SPR 技术和 Biacore 系统最新应用的精选文章合集。