单域抗体 (dAb)、抗原结合片段 (Fab) 和单链抗体可变区基因片段 (scFv) 等抗体片段具有独特的特性,这些特性使其比全尺寸抗体更适合某些治疗条件。较大的分子可能无法穿透组织或持续存在于组织中,而较小的片段可以有效地到达其靶标。由于它们的非糖基化结构,它们也可以在微生物细胞中产生,而不需要借助哺乳动物细胞。抗体片段工作是生物制药行业的关注领域和潜力领域,但它存在一些纯化挑战。
抗体片段受到的关注增加
如何制成抗体片段
这项工艺使用多种方法,包括基因工程和蛋白水解酶切。片段可以通过共价或重组增强以添加额外的功能特性。在先前的工作中,它们与被称为抗体-药物偶联物(ADC;包括用于癌症治疗的酶、毒素和放射性核素)的多种元素偶联。
生物工艺中使用哪些类型的片段?
生物工艺中使用三种类型的抗体片段:
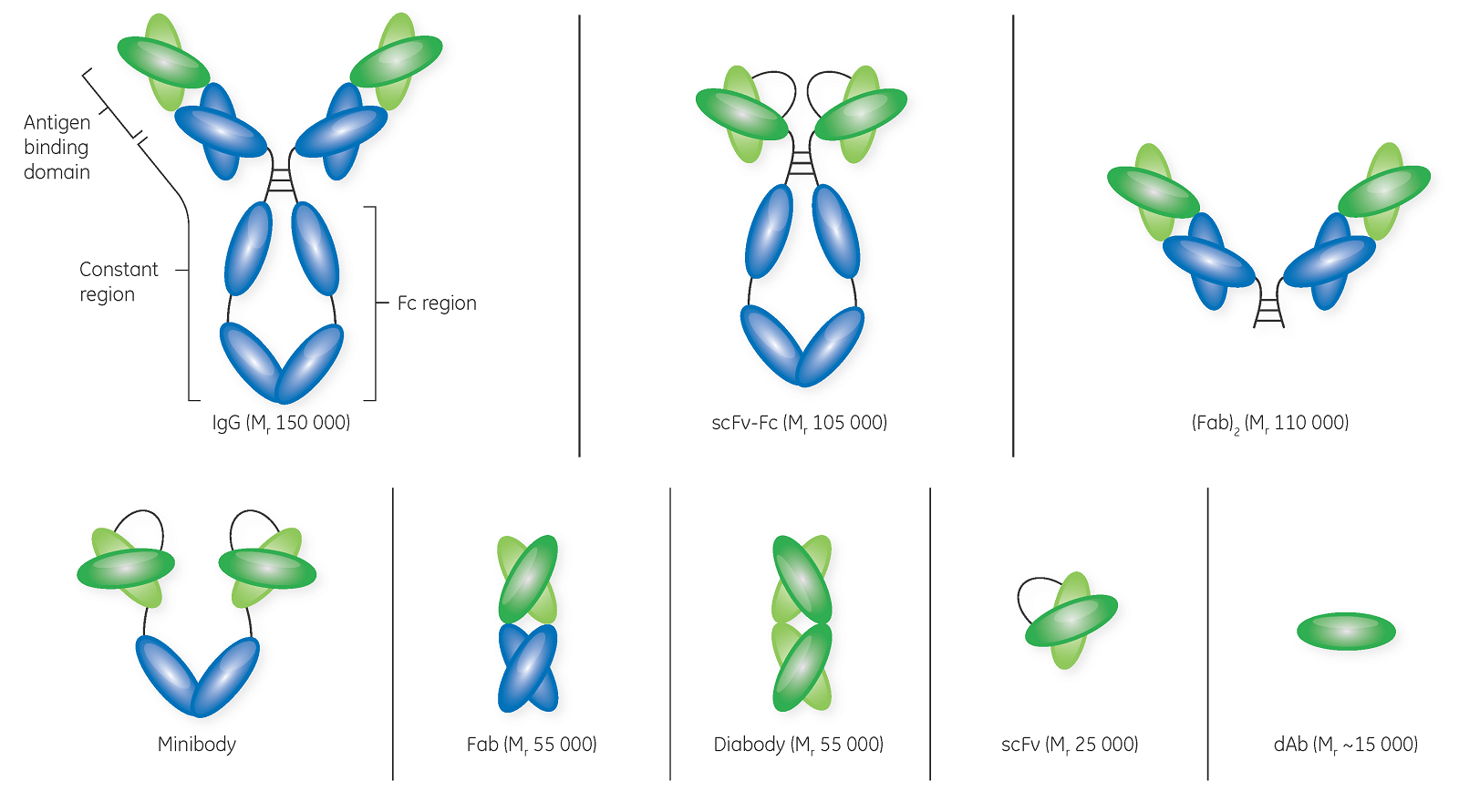
Fab 被认为是第一代抗体片段。它们最初通过使用酶(如木瓜蛋白酶)对完整的抗体进行酶切而生成,但现在是通过现代基因工程方法生产。木瓜蛋白酶酶切产生两个单价 Fab 片段,各由一个可变重链 (VH) 和一个可变轻链 (VL) 组成,通过二硫键连接并显示单个抗原结合位点。
scFv 为单价结构,对单一抗原有亲和力。scFv 的大小约为 Mr 25000,包含通过短柔性连接子融合成单个多肽链的抗体重链和轻链的可变区。scFv 包含其亲本抗体分子的完整抗原结合位点。
dAb 是一些保留完整抗原结合特异性的最小功能性抗体片段,因为它们由 VH 或 VL 结构域组成。dAb 约为正常抗体分子量的十分之一。尽管 dAb 仅包含来自亲本抗体的六个互补决定区中的三个,但它们显示出抗原结合特异性和亲和力。dAb 在严苛的温度、压力和变性化学品条件下非常稳定。
抗体片段的生成和纯化
抗体片段表达和纯化
由于抗体片段较小且具有非糖基化性质,可以使用更简单且成本更低的原核和酵母细胞表达系统。但为了满足对培养物澄清的要求,建议对粘性和高固体含量的补料采用阶梯式切向流过滤,以进行微生物发酵。中空纤维过滤器非常适合用于促进捕获。
已通过阳离子交换层析 (CIEX) 纯化了多种抗体片段,作为捕获步骤。对于复杂纯化条件,可使用支持配基与样品组分之间多种相互作用机制的填料(多模式填料)。
对于中度纯化和最终精纯,基于与基本技术(正交)选择性不同的分离可能涉及阴离子交换 (AIEX) 或疏水层析 (HIC)。
由于抗体片段的多样性和缺乏 Fc 区,需要为每个片段制定特定纯化方案。由于这种多样性,对于在使用蛋白 A 进行单克隆抗体纯化方面已经非常有效的平台方法,更难以用抗体片段来实现。
针对片段的纯化平台方法
通常,完整蛋白分子可使用平台方法纯化,其中标准单元操作和操作条件保持恒定。mAb 共有的 Fc 区意味着可能可以采用一种近似通用的方法。然而,片段比完整蛋白更多样,这意味着必须采用更广泛的方法进行纯化。
新型亲和层析填料为与抗体片段相容的平台方法提供了新的可能性。我们的生物工艺亲和层析填料具有高选择性和出色的压力/流速特性,可捕获大多数蛋白片段,包括一系列 Fab、scFv 以及 dAb λ 和 κ 轻链。
捕获含有 κ 轻链的抗体片段
因为其特殊的结合特异性,L 蛋白为抗体片段的纯化提供了值得关注的选择。天然蛋白 L 与 Ig κ 轻链相互作用,并将与大多数抗体类别的代表性抗体(包括 IgG、IgM、IgA、IgE 和 IgD)结合。它没有免疫球蛋白类别限制。哺乳动物 IgG 轻链中约 60% 为 κ 链,其余 40% 为缺乏蛋白 L 结合位点的 λ 链。这意味着蛋白 L 有望成为广泛有用的亲和配基,但可能不如蛋白 A 普遍有用。
有了 Capto L 等新型填料,以工业规模纯化抗体片段成为可能。这种填料的刚性基质支持高流速和高生产率以及低配基渗漏,所以适用于大规模生产。它对包含 κ 轻链可变区的多种不同大小的抗体片段有广泛亲和力,还可用于常规 Fab、scFv 和 dAb 的多种纯化应用。KappaSelect 是一种与 κ 轻链恒定区结合的亲和填料,可在 Capto L 不太合适的条件下用于捕获含有 κ 轻链的 Fab。
捕获含有 λ 轻链的抗体片段
或者,如果您想捕获含有 λ 轻链的 Fab,请选择 LambdaFabSelect。它是一种与 λ 轻链恒定区结合的亲和填料。
在它们之间,Capto L 和 LambdaFabSelect 几乎涵盖了所有 Fab 以及大多数较小的抗体片段。
捕获含有重链的抗体片段
如果您想捕获包含 VH3 结构域亚型的重链 dAb,您可能需要考虑 MabSelect。它是一种亲和填料,除了在 Fc 区结合外,还与人 IgG Fab 的 VH3 结构域亚型结合。
抗体片段纯化正在进行
过阅读我们的白皮书抗体片段纯化的平台方法,了解如何提高纯化效率。