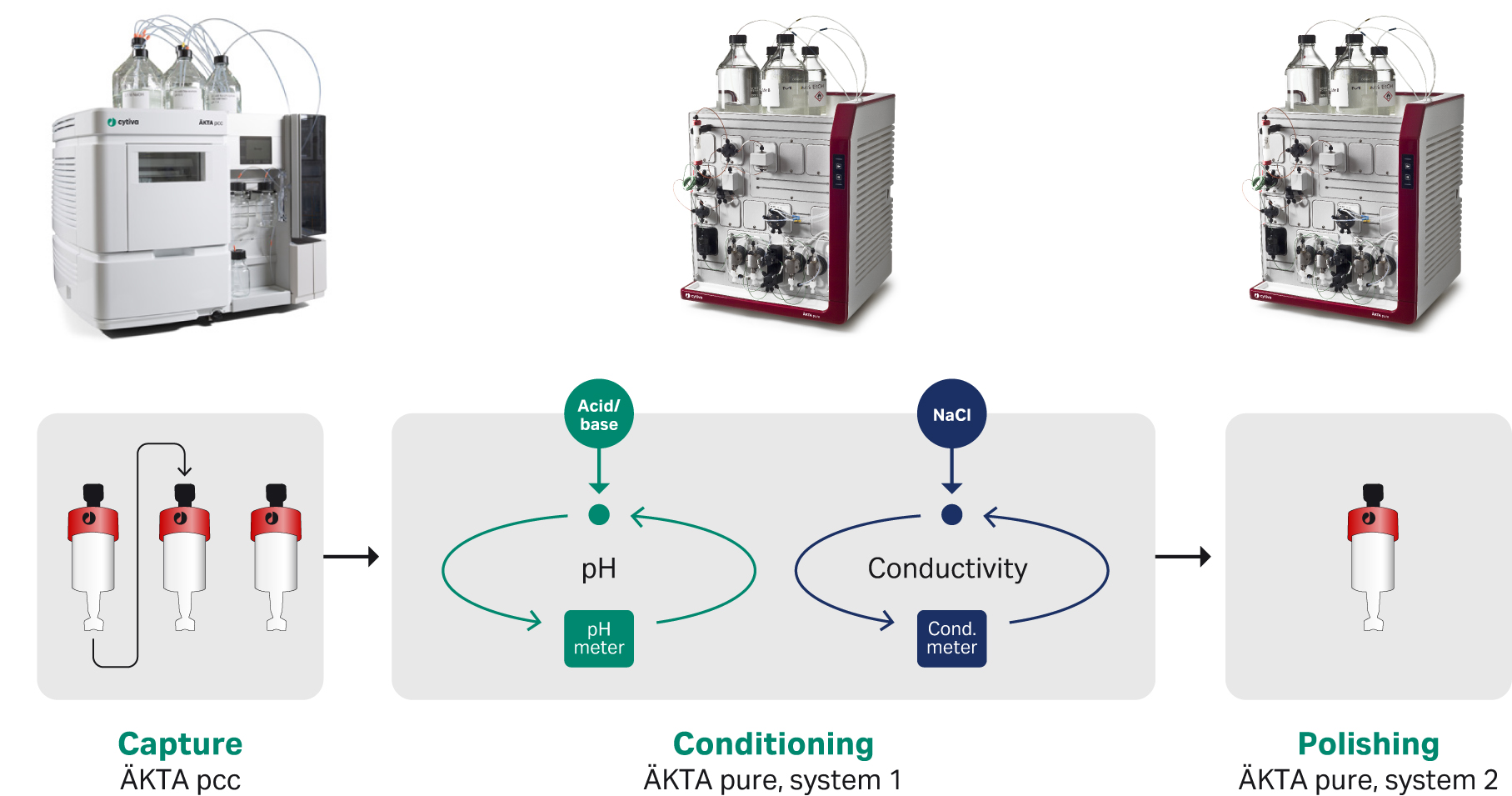
简介
临床前实验室经常需要不断评估增加容量和通量的可能方法,以应对数量不断增加的新分子实体和缩短时间线的需求。如果能够以自动化且不受监控的方式运行实验室规模工艺,便可以节省大量的时间和精力。
本研究的目的是展示实验室规模的蛋白纯化装置自动化解决方案的原理验证,并展示该解决方案会在确保保持产品质量的同时大幅缩短手动操作时间。
Cytiva 与一个后期研究团队合作,他们需要减少每周为内部开发工作纯化多个 mAb 样本所需的手动操作时间。选择的方法是实施一种基本自动化策略,该策略可以快速简便地使用现有的现成组件进行设置和设计。
本研究表明,通过在临床前实验室实施自动化解决方案,可以将科学家在下游纯化工艺上花费的手动操作时间从一天以上减少到几个小时。自动纯化工艺包括连续捕获蛋白 A、调节 pH 值和电导率以及最终的离子交换精纯步骤。
在 ÄKTA pcc 层析系统上执行 mAb 补料的连续捕获,每个洗脱峰自动转移到 ÄKTA pure 系统,并在该系统上调整 pH 值和电导率。调整后的材料转移到离子交换精纯柱中,并在第二个 ÄKTA pure 系统上收集最终产物作为单独的馏分。
图 1. 产物流经系统的示意图。以连续方式捕获 mAb 材料,并将来自 MabSelect SuRe 层析柱的每个洗脱峰调整至适合精纯步骤的目标 pH 值和电导率。
材料和方法
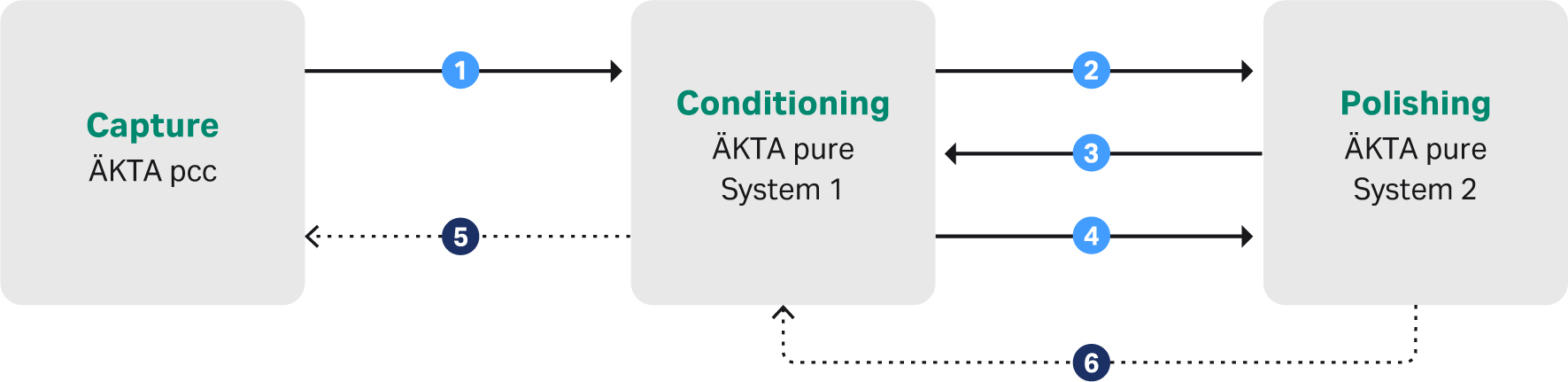
工艺由 UNICORN 控制软件进行控制,层析系统之间的信号处理由 I/O box 进行管理,参见图 2 中的简要说明。整个工艺由单独的仪器进行监控,在整个工艺中可以根据需要检查和评估数据。
图 2. 用于实现自动下游工艺的信号传递简要说明。
1.在 ÄKTA pcc 系统上完成捕获步骤后,系统会向第一个 ÄKTA pure 系统发送就绪信号。这将激活该 ÄKTA pure 做好准备接收洗脱峰并执行调节步骤。
2.调节开始后,第一个 ÄKTA pure 系统向第二个 ÄKTA pure 发送信号以打开一个流路,以便让精纯系统(第二个 ÄKTA pure)能够直接从调节步骤加载样本。
3.精纯系统(第二个 ÄKTA pure)向调节系统(第一个 ÄKTA pure)确认流路已准备就绪,可以直接注入。
4.从调节系统到精纯系统的就绪信号指示所有样本均已注入层析柱。
5 和 6。来自调节和精纯的安全信号,用于在后续步骤中发生故障的情况下停止/暂停捕获系统。
起始材料
使用多种含有 mAb(滴度约为 0.5 至 1.5 mg/mL)的不同细胞培养物作为起始材料。
捕获
在 ÄKTA pcc 上使用三个 HiTrap (5 mL) MabSelect SuRe 层析柱进行捕获。通过 I/O box 发出信号并使用 UNICORN 方法中的监视功能,将各个层析柱峰转移至调节步骤。洗脱峰准备好传输时,将会向调节单元发送信号。向标准 UNICORN 方法中添加了通过从 ÄKTA pcc 延伸到调节 ÄKTA pure 单元的管路执行样本驱赶的功能。
调节
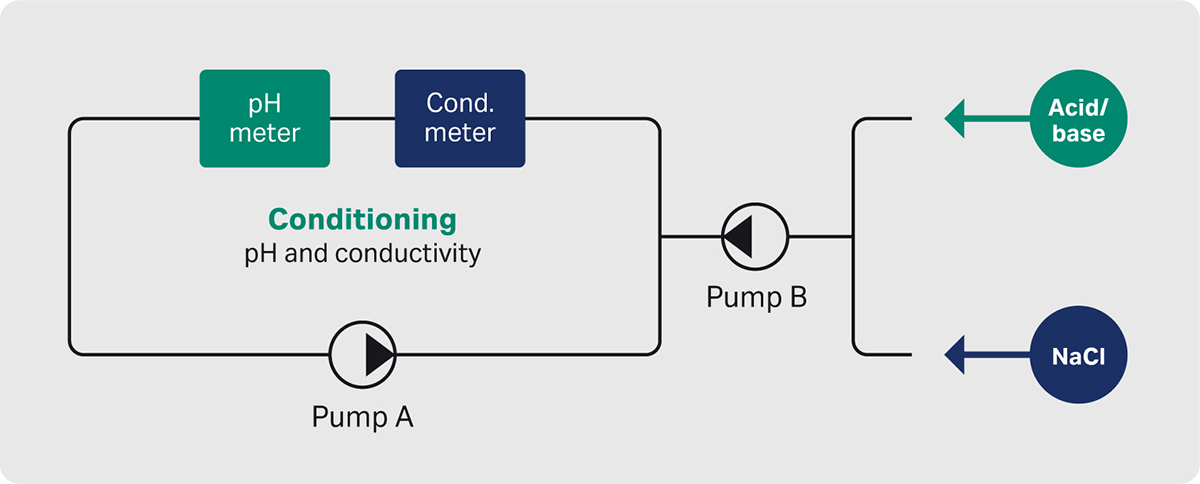
在修改后的 ÄKTA pure 系统(图 3)中执行 pH 值和电导率调整。
图 3. 调节硬件设置的示意说明。
调节 ÄKTA pure 系统从捕获步骤接收洗脱峰材料,并通过“峰分馏”功能将含有洗脱峰的 UV 引导至调节罐体。此举最大程度地减轻了产物的稀释,并确保使用正确的材料进行进一步处理。
样本调节的基本原理是将滴定剂添加到包含 pH 值和电导率检测器的循环流路中(先加入 Tris,然后加入氯化钠)。在调整过程中循环样本,并在条件稳定并满足预定标准时启动下一步。pH 滴定以单向模式进行,这意味着仅添加碱以将 pH 值提高至设定值。以同样的方式用氯化钠进行电导率的调整。
通过控制回路管理滴定剂的添加,以在不超出目标值的情况下实现尽可能快速、准确的调整。这意味着在开始时添加较大量的滴定剂以接近设定点值,然后继续添加较少量的滴定剂,以进行微调并达到预定的目标设定点。
采用单向调节是因为需要控制所调节材料的最终体积,并保持步骤快速执行,从而与连接的工艺保持一致。单向滴定方法的一个风险是有可能超过目标设定点,因为一般需要在速度和精度之间进行折衷。
精纯
在第二个 ÄKTA pure 层析系统上使用经修改的 UNICORN 方法进行精纯,以支持通信和样本传输。在流通模式下使用离子交换柱进行精纯,得到的峰单独分馏。直接从调节 ÄKTA pure 系统向层析柱注入,离子交换层析由两个单元之间的握手信号通过 I/O box 通信来启动(图 2)。
受控关机
向装置中引入了关机功能,以确保在工艺的第二步或第三步出现故障时,可以执行受控关机。
如果任何 ÄKTA pure 系统出现任何故障,ÄKTA pcc 上的捕获步骤将会停止,系统将关闭并进行清洁 (CIP)。这是为了避免浪费任何起始材料,并防止下游纯化步骤进一步受到污染。
这是通过引入状态报告功能来实现的,该功能可以让 ÄKTA pcc 系统知道调节仪器(第一个 ÄKTA pure)是否准备好接收计划洗脱的峰。此状态检查在每次洗脱开始之前执行,在调节 ÄKTA pure 系统尚未准备好接收洗脱峰的情况下,将不会进行额外的洗脱,并将启动关机程序。
要在此类关机后恢复工艺,只要下游 ÄKTA pure 装置恢复并准备好接收材料,就可以重新启动 ÄKTA pcc 系统。
结果
自动化 mAb 纯化工艺需要大约 1.5 个小时的准备工作才能开始纯化运行。可以收集产生的材料以在第二天进一步使用。自动化方法可减少纯化过程中样本的处理时间。与传统批量模式下的多次运行相比,用于捕获步骤的连续层析装置还节省了填料和缓冲液。
下图显示了稳态下纯化工艺的性能,其中显示了一致性和可重复性。与手动分步工艺相比,产品质量得以保持,如下所示。
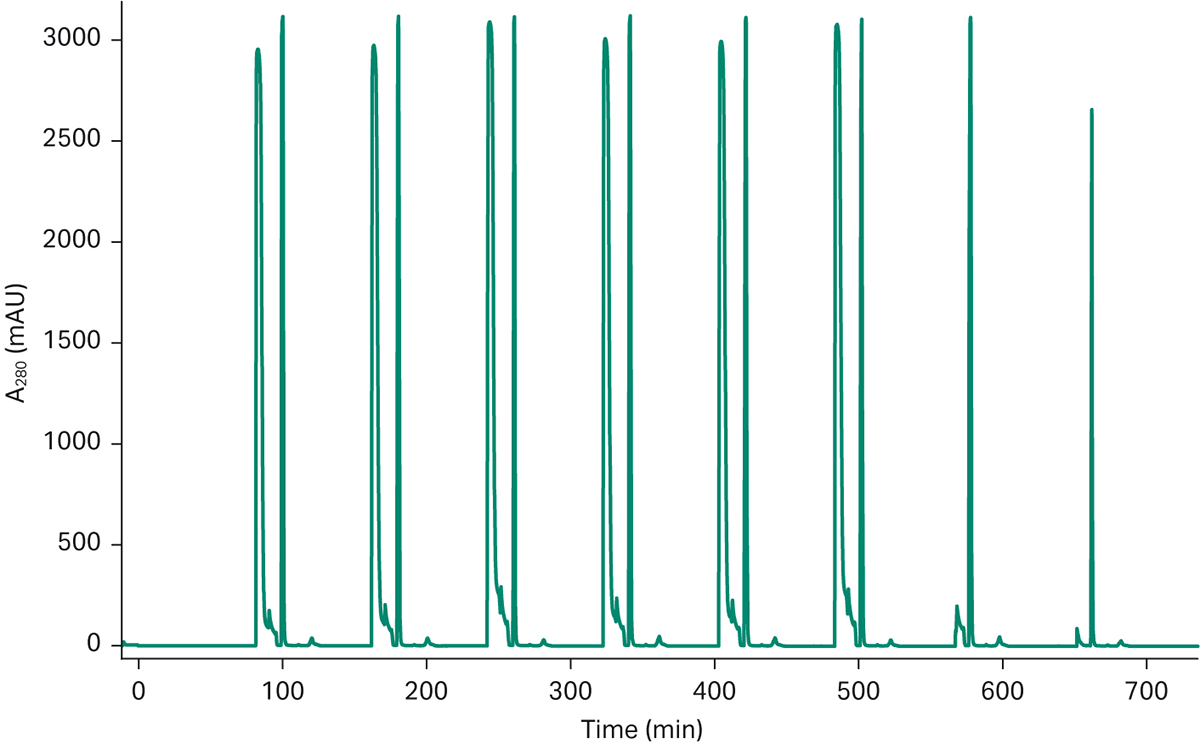
在图 4 中,您可以看到工艺中连续捕获步骤的典型层析图谱,其中显示装置产生了一致的结果,并且每次洗脱都可以得到类似的峰。这是使其余下游工艺实现自动化的良好起点。从捕获步骤洗脱的材料被转移到调节系统中,通过使用峰分选功能,含 mAb 的材料被转移到滴定环中。不含 mAb 的材料由调节系统转为废液。
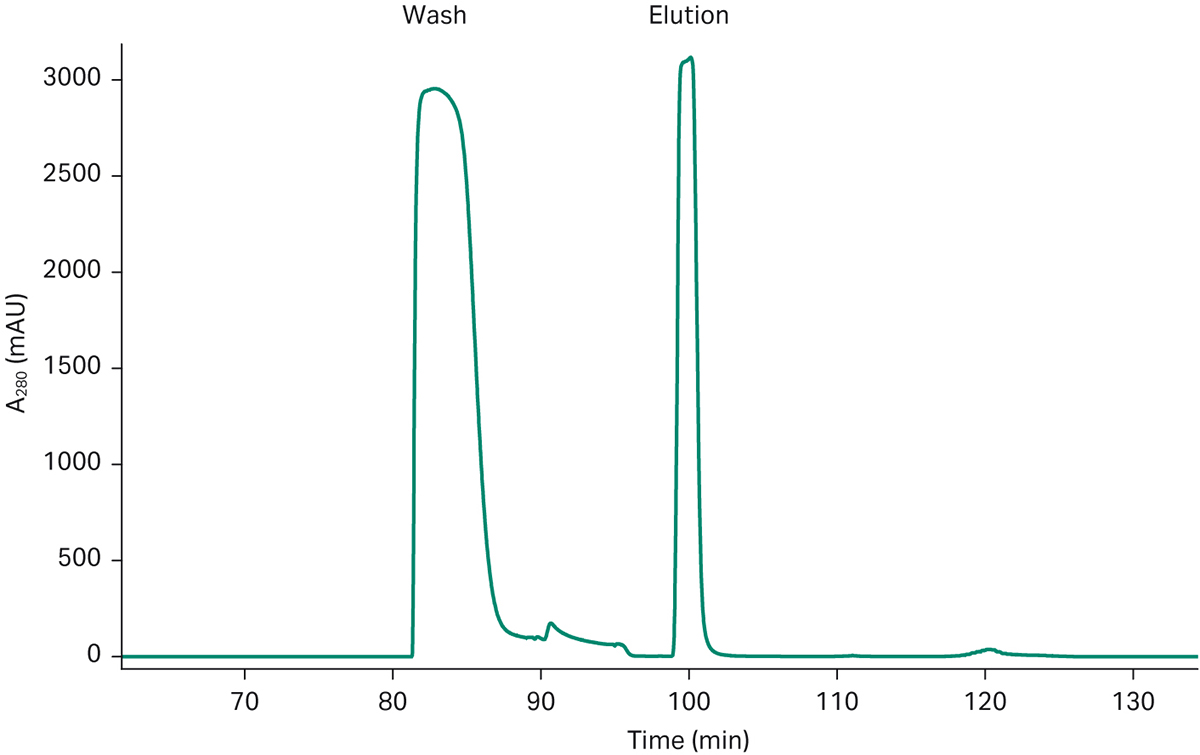
图 4a. ÄKTA pcc 上 mAb 补料的 3C PCC 运行生成的层析图谱。层析图谱显示了 6 环 mAb 捕获运行的一致洗脱模式。最后两个洗脱峰来自层析运行中的关机阶段,并非处于稳态模式。
图 4b. 一个 PCC 环的细节,显示了转移到精纯步骤的清洗和洗脱/产物峰。
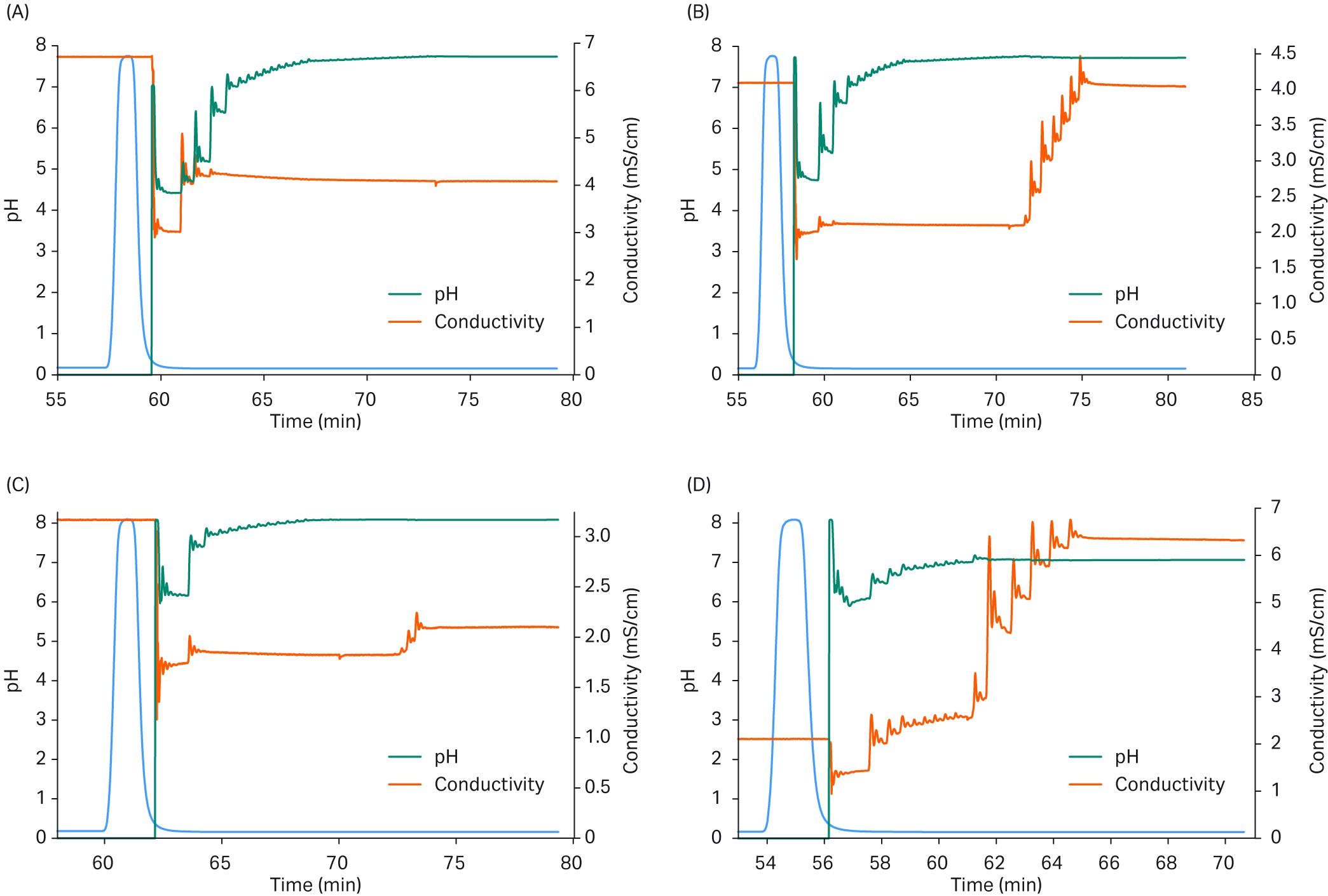
图 5 中的层析图谱显示,该装置非常适合改变条件,将 pH 值和电导率调整到不同的目标值。非常精确地达到了目标设定点,从而可以使用该装置和控制机制来筛选精纯步骤的不同条件。
图 5. 不同 pH 值和电导率调整的结果。
蓝色曲线显示了从捕获系统发送,通过调节系统进行峰分离并进一步处理的含 mAb 的材料。绿色线显示 pH 值的调整,橙色线显示电导率的调整。(a) 调节至设定点 pH 值 7.73 和电导率 4.0 mS/cm。终点 pH 值为 7.70,电导率为 4.1 mS/cm。(b) 调节至设定点 pH 值 7.73 和电导率 4.0 mS/cm。终点 pH 值为 7.72,电导率为 4.0 mS/cm。(c) 调节至设定点 pH 值 8.1 和电导率 1.98 mS/cm。终点 pH 值为 8.1,电导率为 2.16 mS/cm。(d) 调节至设定点 pH 值 7.0 和电导率 6.40 mS/cm。终点 pH 值为 7.1,电导率为 6.35 mS/cm。
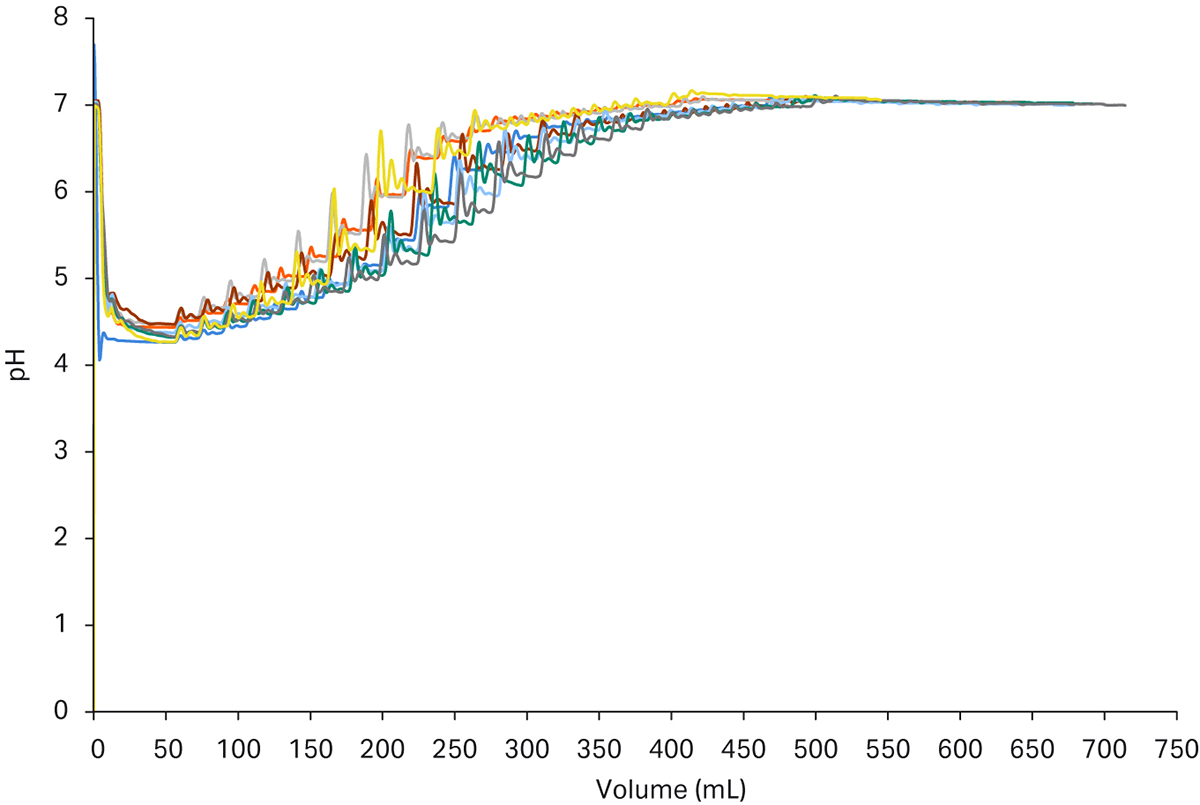
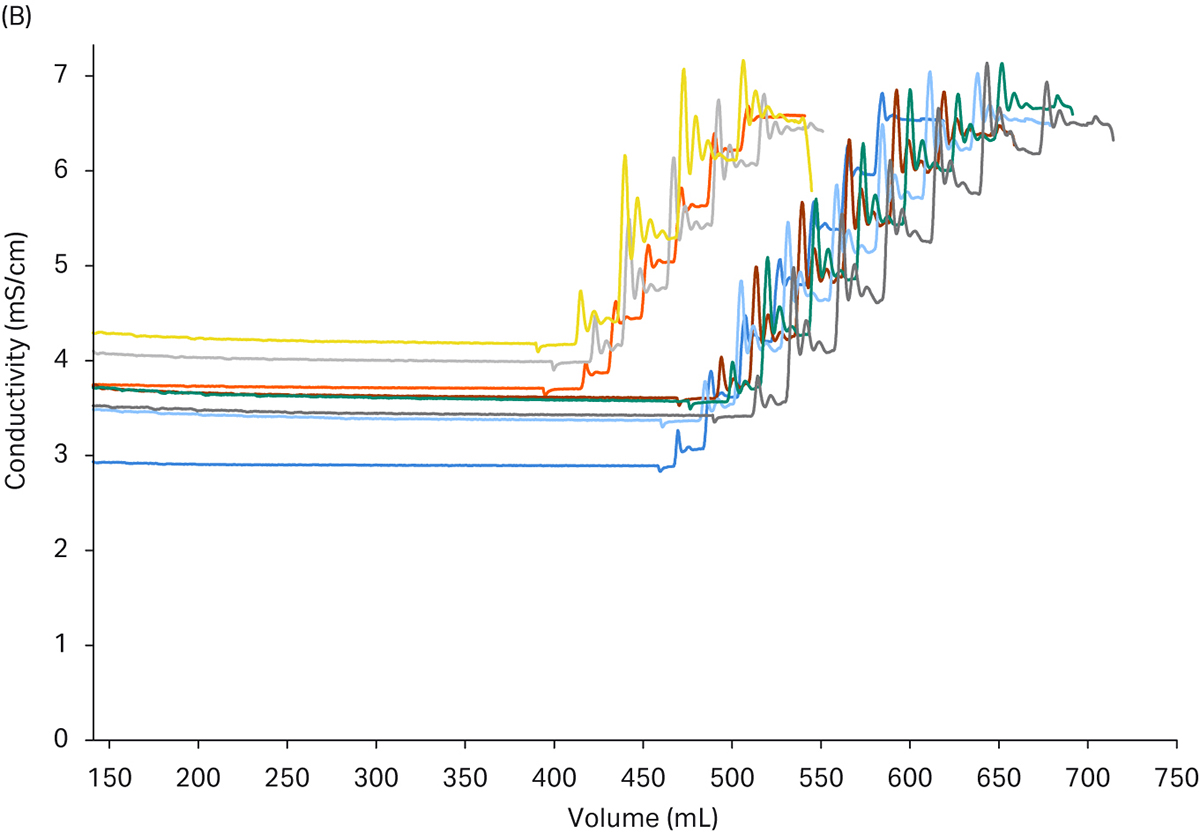
在图 6 中,您还可以看到所选装置对调节步骤的可重复性。所实现的控制功能还可确保即使在起始条件发生变化的情况下也能达到目标设定点。这可以看作是层析图谱中轻微的时间差异,不过凭借该装置的动态、在线适应性,可以给出相同的最终结果。
图 6. 6 环纯化运行的调节步骤得到的层析图谱。(a) 显示了捕获步骤中峰的 pH 值调节,结果几乎相同,并且非常精确地达到了设定点。(b) 显示了电导率的调整。在某些情况下,由于在第一次添加滴定剂时接近设定点,所以调整速度稍快。第二类添加用了更长时间进行微调,但可以看出非常精确地达到了最终值。
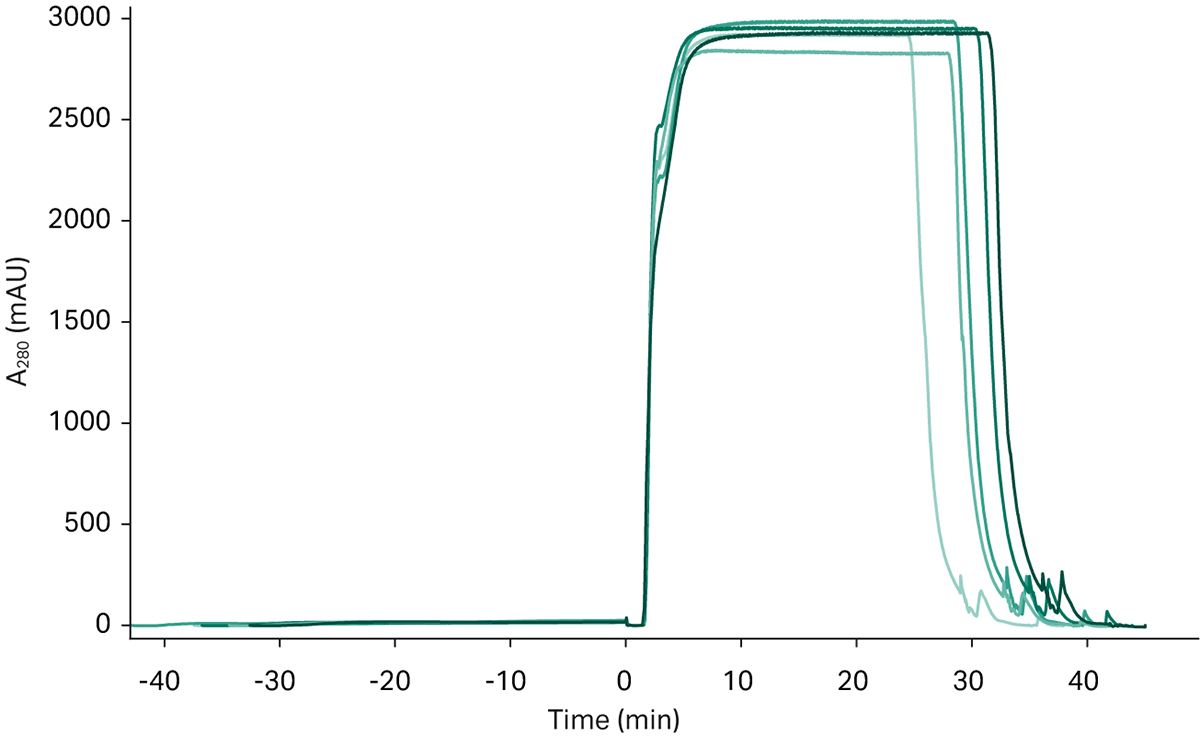
在此下游工艺中,连续捕获和调节步骤之后的最后一部分是精纯步骤。图 7 显示了六次单独的精纯运行得到的层析图谱,每次运行的图谱叠加在一起以显示各次运行之间的可重复性。
图 7. 精纯步骤的 UV 层析图谱,显示了六个不同层析图谱的叠加图。
表 1 和表 2 所示的分析结果表明,整个自动化纯化工艺的总产率为 92%,并且在最终产物中未检测到聚集体或片段。所有产品质量属性均满足预定的规格,并且与手动操作更多的装置获得的结果相当。
表 1. 自动纯化工艺的分析数据。
| 自动化工艺 | |||||||
| 馏分 | 加载量 mg | mg/mL | mL | mg | 回收率 | HCP (ng/mg) | 蛋白 A 浸出 (ng/mg) |
| 条件培养基加载 | 1110 | 1.5 | 740 | 1110 | 100% | - | - |
| 蛋白 A | 1110 | - | - | - | - | 158 | 1.4 |
| IEX 池 | 1110 | 7.9 | 129 | 1016 | 92% | 16 | 0.3 |
| IEX 条带 | 1110 | 0.17 | 42 | 7 | 1% | - | - |
表 2. 批量纯化工艺的分析数据。
| 批量工艺 | |||||||
| 馏分 | 加载量 mg | mg/mL | mL | mg | 回收率 | HCP (ng/mg) | 蛋白 A 浸出 (ng/mg) |
| 条件培养基加载 | 1110 | 1.5 | 740 | 1110 | 100% | - | - |
| 蛋白 A | 1110 | 7.7 | 142 | 1093 | 99% | 129 | 1.9 |
| IEX 池 | 901 | 5.6 | 146 | 818 | 91% | 27 | 0.3 |
| IEX 条带 | 901 | 0.4 | 50 | 22.1 | 2% | - | - |
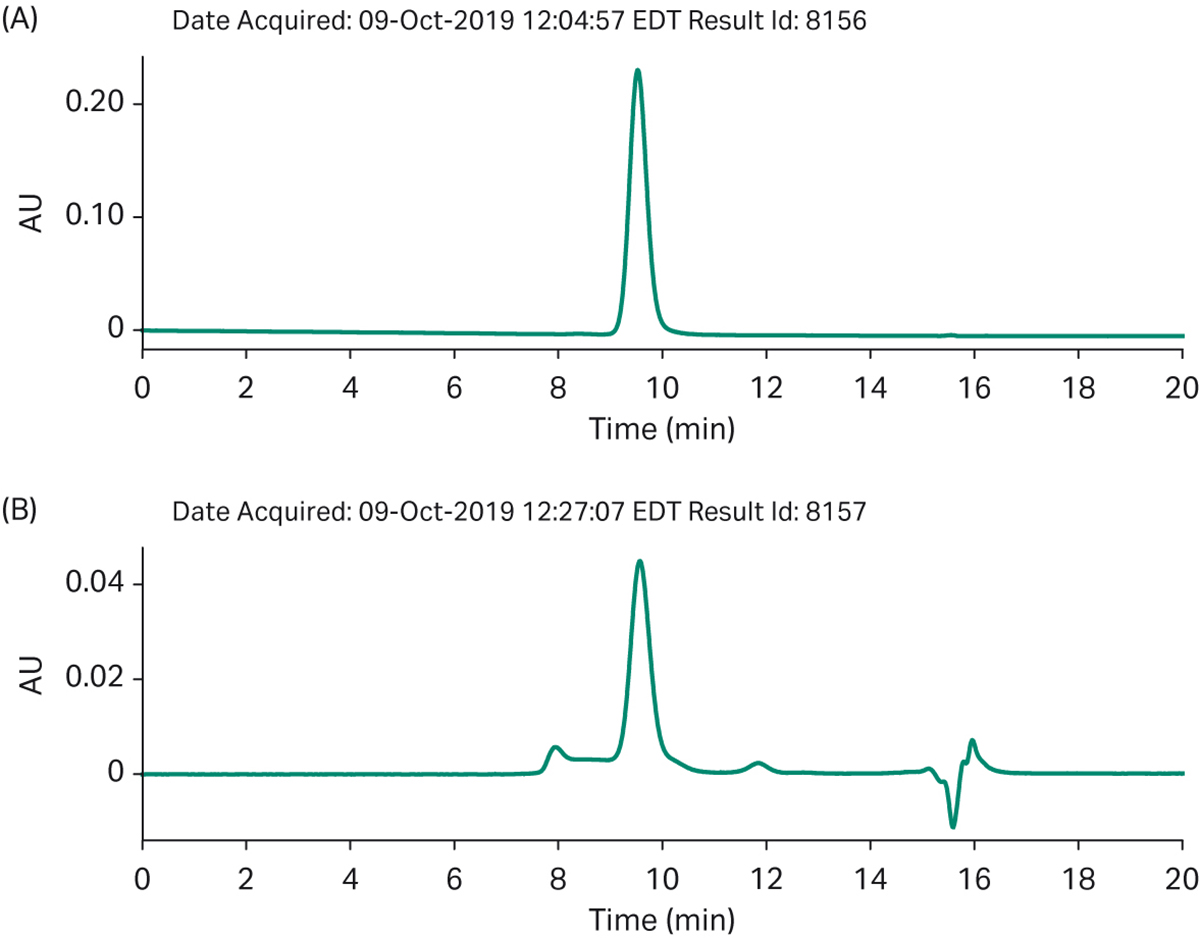
图 8. 自动化工艺 a) 纯化最终产物的 SEC 分析 b) 结合在精纯柱上的杂质。
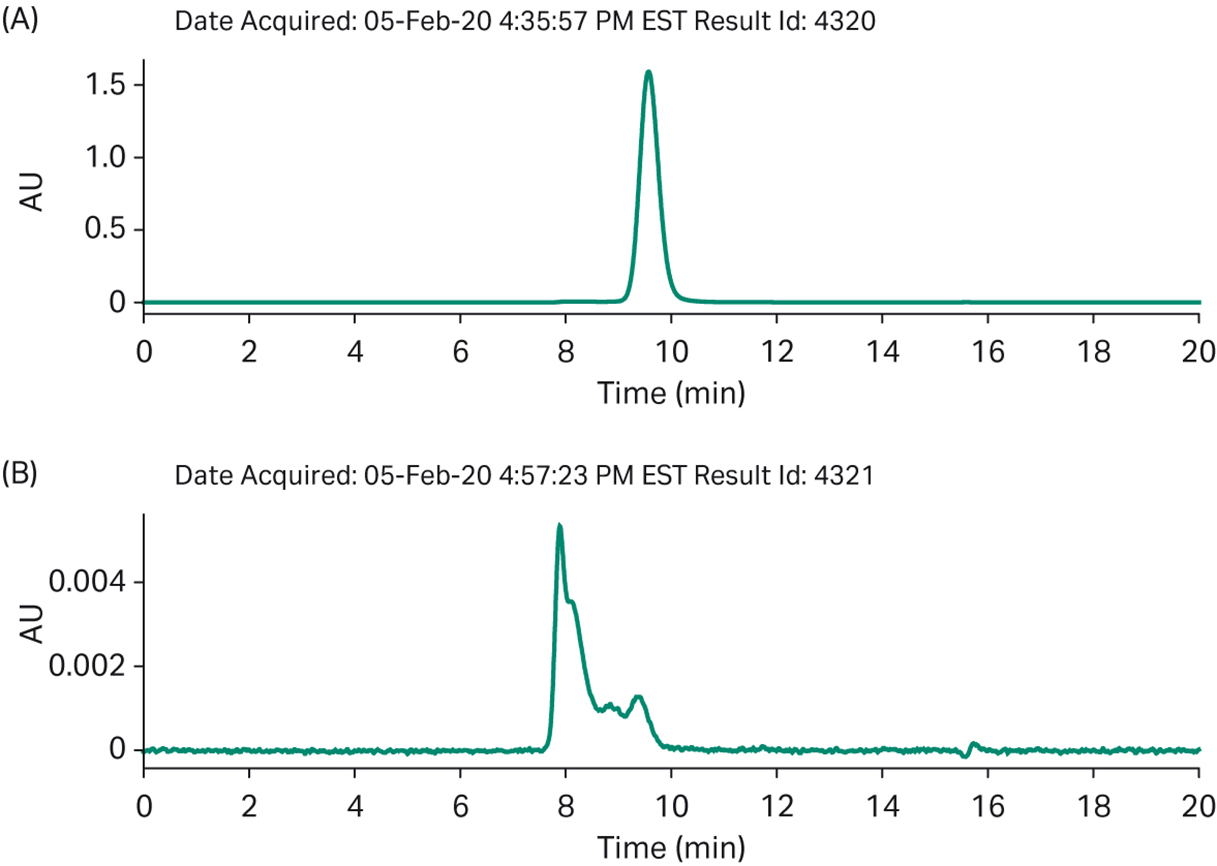
图 9. 批量工艺分析 a) 最终产物的 SEC b) 结合在精纯柱上的杂质。
结论
本研究表明,这种自动化装置可以在实验室环境中工作,并且无论在输出还是在效率方面均具有优势。可以根据纯化需求进行微调和进一步改进。
连续自动化工艺主要减少了手动操作时间。科学家只需要 1.5 个小时的准备工作来设置工艺,之后,工艺就可以自动运行一整夜。而且,产品质量和产率与手动操作更多的装置相当。
此程序的另一个优势在于,可以通过更改自动运行的每次单独捕获运行的工艺参数,来对工艺进行研究和优化。可以分析最终产物,并可以评估不同工艺条件的影响。无需科学家进行更昂贵的手工交互即可加快工艺开发。更高自动化水平的另一个优势是将人为误差的风险降到了最低。
在开发此自动化装置时,一些关键点对于成功实施控制策略至关重要:
- 从最低级别开始集成工作,将两 (2) 个单元操作连接在一起,并在添加其他步骤之前确保装置稳健
- 为了使装置保持简单,未实施其他自动化层,而是使用了 UNICORN 编程,并在系统之间建立了 I/O 信号。这有助于将开发工作和成本保持在最低水平。
- 初始装置在 Cytiva 开发和测试,然后移交给我们的合作伙伴进行其他测试
- 由于频繁进行讨论和面对面会谈,对装置的任何反馈、故障排除和调整均可快速完成
- 该工作面临的两个主要挑战是:
- 确保调节步骤可以足够快地执行以匹配工艺中的其他步骤。这通过利用快速响应时间以及 ÄKTA 平台上提供的精确传感器和组件来进行管理。
- 确定不同单元操作的尺寸以实现均衡工艺。
致谢
本自动化工艺是与美国马萨诸塞州安多弗市的 Pfizer 公司密切合作开发的。感谢 Aaron D’Antona、Ryan Jackobek、Darren Ferguson、Sara Wagman 和 Lily Zhu 热心分享数据,与我们进行了宝贵的讨论。