简介
开发和优化用于 mAb 生产的新补料分批培养工艺不一定复杂。从一开始就了解有关细胞系的一些关键知识 – 培养时间内所需的营养物质、代谢物的影响和临界渗透压 – 您可以快速设计一个易于在生产规模上执行的日常补料方案。
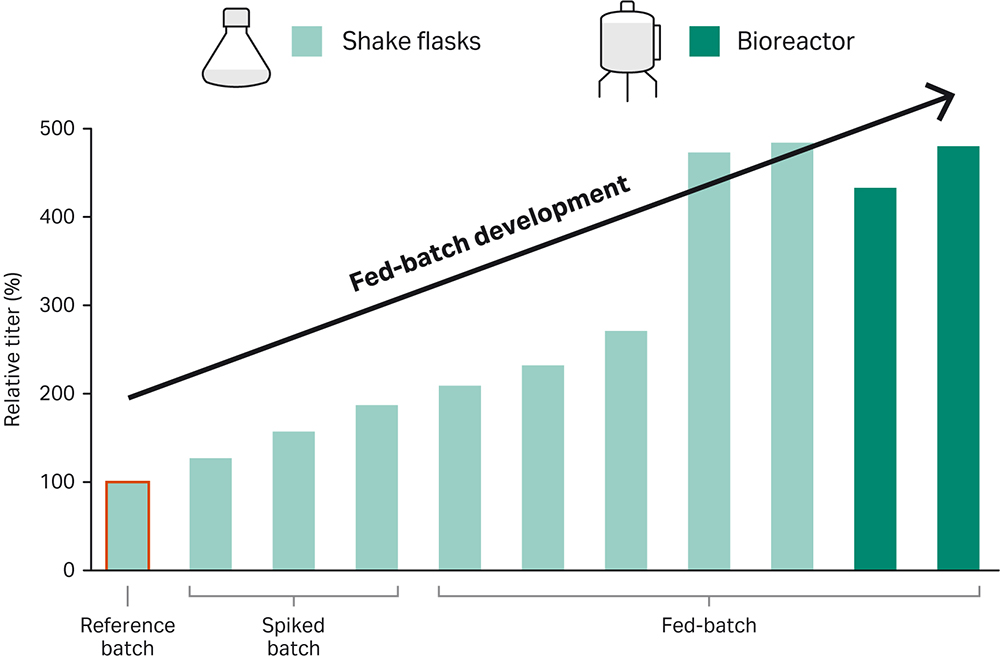
为了说明这种方法,我们开发了一种高性能补料分批培养工艺,以获得表达 IgG1 的 CHO-K1 GS 基因敲除细胞系 (GS -/-)。将细胞接种到 HyClone™ 牌 ActiPro™ 培养基中生长,并添加 HyClone™ 牌 Cell Boost™ 7a 和 7b 补料。在摇瓶 (SF) 中确定经优化的补料方案,然后放大到生物反应器 (BR) 实验。结果如何?滴度峰值比在 ActiPro™ 中单独培养时高 5 倍(图 1)。
图 1. 开发快速精简的流程,实现高效的补料分批培养生物反应器工艺。将目标细胞系接种到补充有 Cell Boost™ 7a/b 的 ActiPro™ 培养基中培养。
我们的目标是开发一种克服工作流程中会导致生产力和细胞生长停滞关键瓶颈的工艺。优化补料方案提供适当的每日营养供应,同时保留有毒副产物,包括乳酸或氨,从而保持低渗透压。
其中一种工艺开发方法是,使用基于连续或动态补料添加的复杂补料方案,包括计算营养消耗率或细胞密度增加。相反,我们选择了将补料作为每日食团进行添加的简单策略。事实上,之前的实验表明,更复杂的补料方案并不总是获得更高的收获滴度 (1)。我们使用了 KISS(“保持简单”)原则来开发易于执行的稳健补料分批培养工艺 (2)。
我们根据简单的三步法制定了策略。首先,我们使用摇瓶来检测三种不同 Cell Boost™ 7a/7b 浓度的初始加标的影响。我们还测定了营养限制和临界渗透压。其次,我们评估了将补料作为日常食团添加的六种方案,优化了摇瓶中的补料策略。最后,我们将这些经验放大到 500 mL 生物反应器,执行了两次运行。
所有分析均离线进行。分析数据包括活细胞密度 (VCD)、活力、葡萄糖、乳酸、L-谷氨酸、L-谷氨酰胺、氨、渗透压和抗体滴度。参见页面底部,获取详细的材料和方法。
结果和讨论
第 1 步:评估补料加标的影响并测定临界渗透压
为了开发新 CHO 细胞系的补料分批培养工艺,我们建议首先测试 ActiPro™ 基础培养基中添加 Cell Boost™ 7a 和Cell Boost™ 7b 的积极影响。通过在简单批量培养中测试不同的初始(第零天)加标浓度来完成这一测试。通过这种方式,您可以检测营养限制或改善营养供应的影响,您也可以估计培养基渗透压升高的影响。由于要对消耗的营养素和代谢副产物进行详细分析,因此您还可以确认添加剂的益处。
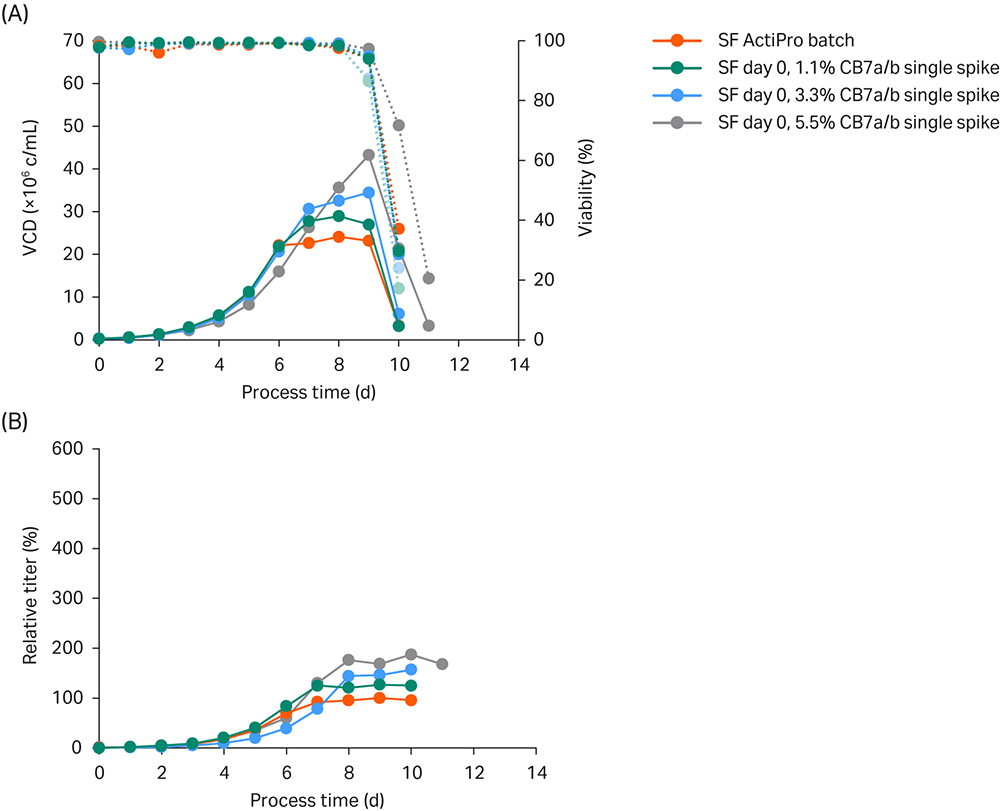
一开始,我们在第 0 天按 1.1%、3.3% 和 5.5% 分别加入 Cell Boost™ 7a/b(a:b 比例为 10:1)。我们将结果与 ActiPro™ 对照培养进行了比较(图 2)。
图 2. 在摇瓶 (SF) 中进行简单的 ActiPro™ 批量实验,评估在第 0 天加标不同 Cell Boost 7a/b (CB7a/b) 浓度的影响。(A) 活细胞密度 (VCD) 和活力;(B) 相对于 ActiPro™ 对照培养基峰值滴度的滴度值。
以 1.1% 或 3.3% 在 ActiPro™ 对照组和培养基中加标 CB7a/b,即使各自的起始渗透压不同,它们在第 6 天前均生长至类似的 VCD,即 2000 万活细胞 (MVC)/mL。以 5.5% 加标的 CB7a/b 显示,在第 6 天之前,VCD 降低和比生长率降低,这表明较高的渗透压具有负面影响。第 6 天后,由于营养素限制,ActiPro™ 对照组显示出更慢的生长速度。有趣的是,比生长率和生产力下降与残留营养物的可用性相关。
以 5.5% 加标 CB7a/b 会增加葡萄糖和谷氨酸的起始浓度(数据未显示)。结果,在第 6 天残留营养的支持下,生长率在第 7 天后升高。这导致最终峰值 VCD 逐渐增加,在第 9 天达到 43 MVC/mL,峰值滴度高达对照组的 187%。
总之,在培养基中加标 Cell Boost™ 7a/7b 可在培养后期保持较高的比生长率和生产力。结合较高的 VCD,这是积累大量 mAb 蛋白的原因。以 5.5% 加标 CB7a/b 会导致初始生长率降低,但最终峰值 VCD 值更高,第 6 天前的比生产率略高,此后细胞比生产率 (qP) 显著提高。与基础 ActiPro™ 培养基相比,早期生长阶段的 qP 增强可归因于渗透压升高,这在文献中经常报道 (3)。相反,在工艺后期阶段,生长率和生产力的提高可归因于持续的营养供应。
加标批量实验可用于评估单个初始食团加标对细胞生长率和生产力的影响,并确定在高性能补料分批培养中必须避免的关键营养限制。具体而言,对于该细胞系,在较高渗透压下观察到比生长率降低。此外,确定谷氨酸为一种重要的关键营养素,应在未来的补料分批培养应用中予以充分控制。
第 2 步:优化补料策略
最近的实验表明,与基于固定日量的简单食团补料相比,根据更复杂的补料方案,用 Cell Boost™ 7a 和 7b 并没有实质性益处 (1)。后一种策略更易于设计、计算和执行。然而,必须确定可能的关键瓶颈,包括营养限制、乳酸和氨浓度升高或临界渗透压。以及必须对工艺控制(即补料和碱添加或 CO2 剥离)进行相应调整。
为了确定最佳补料方案,在摇瓶中进行了小规模的补料分批培养实验,以测试基于固定每日食团量的不同补料策略。作为对照,进行了基础 ActiPro™ 批量培养。
加标实验
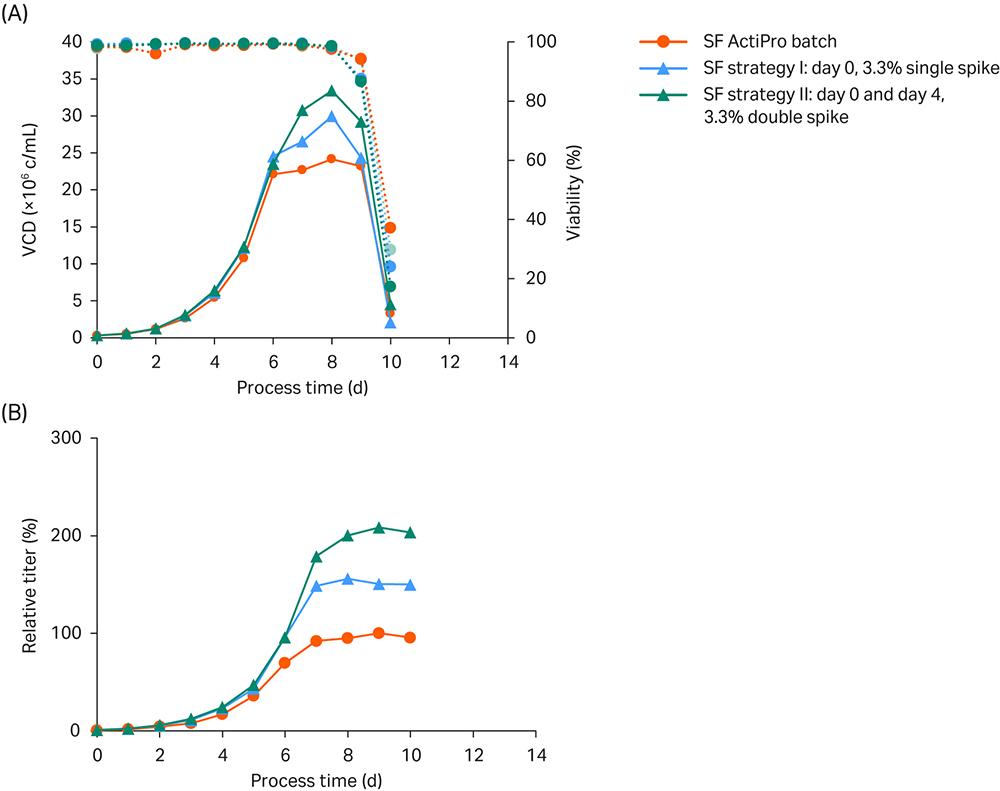
第一种策略是在第 0 天加标 3.3% CB7a/b。第二种策略是分别在第 0 天和第 4 天,分两次加标 3.3% CB7a/b。结果如图 3 所示。
图 3. 进行摇瓶 (SF) 批量实验以研究不同 CB7a/b 加标浓度的影响。(A) VCD 和活力;(B) 相对于 ActiPro™ 对照培养基峰值滴度的滴度值。
在基础 ActiPro™ 的批量培养中,峰值 VCD 达到了 24 MVC/mL,总工艺时间为 10 天。由于包括谷氨酸在内的关键营养素被耗尽,比细胞生长率在第 6 天后急剧下降。同一天,葡萄糖逐渐成为限制因素,细胞转而消耗乳酸。在第 7 天后未观察到最终峰值滴度的进一步增加,因此将该值用作 100% 峰值滴度参考。
使用单个初始 3.3% Cell Boost™ 加标(策略 I)将谷氨酸限制再延迟一天,导致 VCD 升高,峰值滴度增加至 156%。在第 4 天观察到提供的谷氨酸盐和合成谷氨酰胺被大量消耗,同时渗透压下降。因此,在策略 II 中,在第 4 天测试了第二次 3.3% Cell Boost™ 加标。这使谷氨酸盐/谷氨酰胺限制在可接受的低渗透压下又延迟了一天。峰值 VCD 增加到 33 MVC/mL,与批量培养基相比,最终峰值滴度增长一倍。但最后的工艺时间还是 10 天。
补料分批培养实验
下一步是,在四种策略 – III、IV、V 和 VI– 中评估日常食团补料,如表 1 所述。
表 1. 在摇瓶实验中测试补料策略
| 策略 |
Cell Boost™ 7a/b 浓度 |
添加补料的时间 |
| 基础 ActiPro™– 批量 | 0% | 无 |
| I – 加标 | 3.3% | 第 0 天 |
| II –双倍加标 | 3.3% | 第 0 天和第 4 天 |
| III – 补料分批培养 | 1.1% | 从第 3 天开始,每天 |
| IV – 补料分批培养 | 2.2% | 从第 3 天开始,每天 |
| V – 补料分批培养 | 1.1%/3.3% | 从第 0 天开始,每天 1.1%;从第 7 天开始,每天 3.3% |
| VI – 补料分批培养 | 3.3% | 从第 3 天开始,每天,渗透压保持在 <380 mOsm/kg |
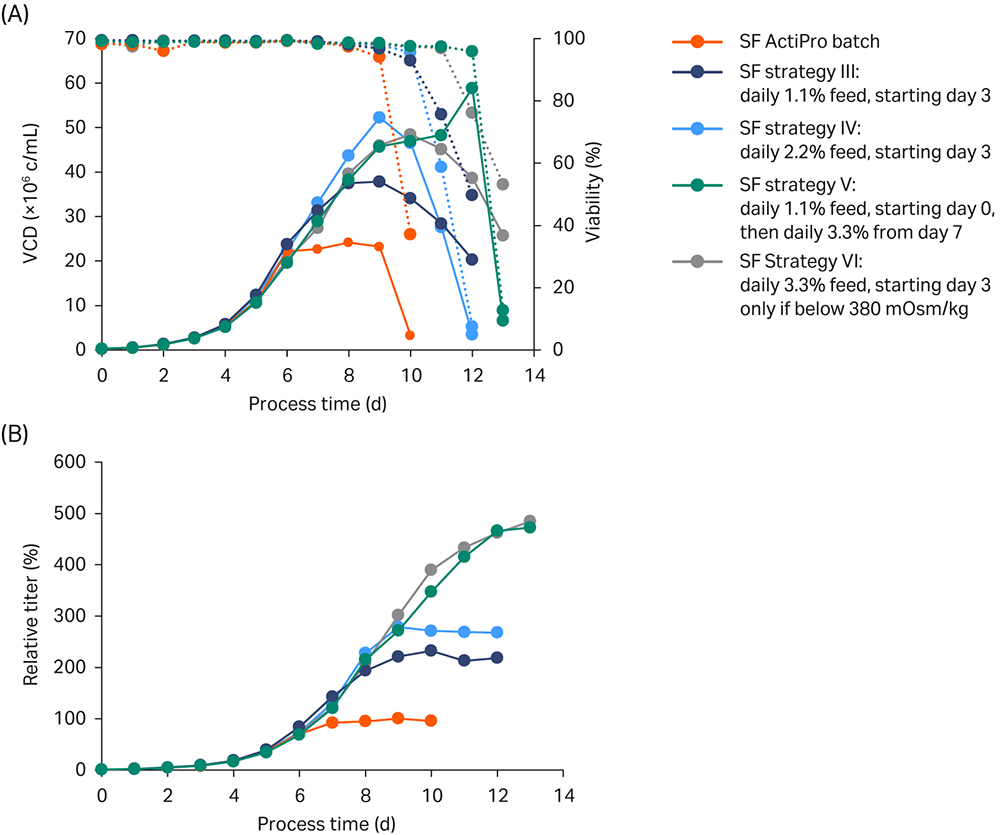
结果如图 4 所示。
图 4. 进行摇瓶 (SF) 批量实验以研究不同 CB7a/b 加标浓度的影响。每个补料分批培养均重复运行 (n= 2)。(A) VCD 和活力;(B) 相对于 ActiPro™ 对照培养基峰值滴度的滴度值。
在策略 III 中,从第 3 天开始每天添加 1.1% CB7a/b 的补料,尽管乳酸积累高达 3.5g/L,但仍保持了相对较低的渗透压。在生物反应器设置中,低渗透压可允许添加碱来调节 pH 值的降低。然而,第 6 天后每天的补料添加量并未维持在临界谷氨酸盐/谷氨酰胺水平,导致第 8 天的生长停滞在 40 MVC/mL,最终相对峰值滴度为 232%。此外,由于添加了葡萄糖储备,未观察到乳酸转化。
在策略 IV 中,从第 3 天起将每日补料添加量增加到 2.2%,导致渗透压增加,在第 6 天达到第一个峰值 350 mOsm/kg。此后,谷氨酸迅速消耗,导致第 8 天达到临界极限;再过一天后,增长和生产力均停止。直到第 8 天,该培养显示出良好的结果,突出表现为 VCD 最高,渗透压低,为添加补料或碱留出了空间。
从第 3 天开始每天添加 3.3%(策略 VI)的补料或从第 0 天开始每天添加 1.1% 的补料,并根据细胞需要调整补料添加量(策略 V),获得了最佳整体性能。在策略 VI 中,当渗透压达到 380 mOsm/kg 以上的临界水平时,停止补料;在策略 V 中,当谷氨酸盐和谷氨酰胺被迅速消耗(显示为渗透压急剧下降)时,补料增加到 3.3%。有趣的是,两种培养基的最终补料量相似。第 3 天后添加了比其他培养基高的补料量,导致葡萄糖、谷氨酸盐和谷氨酰胺峰值水平更高,因此渗透压也更高。与 ActiPro™ 批量培养基相比,策略 V 和 VI 都使滴度增加了近 5 倍。但是由于策略 VI 是从第 8 天开始添加补料,更为简单,因此我们选择用其进行生物反应器验证。
与基础 ActiPro™ 培养基相比,所有六种策略的结果见表 2。
表 2. 在摇瓶实验中测试补料策略
| 策略 |
Cell Boost™ 7a/b 浓度 (%) |
添加补料的时间 |
累积补料量 (%) |
累积 250g/L 葡萄糖储备添加量 (%) |
VCD 的相对积分 |
相对峰值滴度 |
| 基础 ActiPro™– 批量 | 0 | 0 | 0 | 100% | 100% | |
| I – 加标 | 3.3 | 第 0 天 | 3.3 | 0 | 113% | 156% |
| II –双倍加标 | 3.3 | 第 0 天和第 4 天 | 7 | 0 | 128% | 209% |
| III – 补料分批培养 | 1.1 | 从第 3 天开始,每天 | 9 | 3.8 | 259% | 232% |
| IV – 补料分批培养 | 2.2 | 从第 3 天开始,每天 | 15 | 3.2 | 297% | 279% |
| V – 补料分批培养 | 1.1/3.3 | 从第 0 天开始,每天 1.1%;从第 7 天开始,每天 3.3% | 21 | 4.9 | 369% | 473% |
| VI – 补料分批培养 | 3.3 | 从第 3 天开始,每天,渗透压保持在 <380 mOsm/kg | 23 | 3.5 | 371% | 484% |
第 3 步:在生物反应器中验证和调整
一旦确定最佳补料方案和可能的补料瓶颈,即可将该工艺转移到生物反应器验证运行。小规模振荡实验非常适合于许多不同条件的高通量优化。然而,在最后的生物反应器运行中的性能可能与振荡实验不同。一个主要原因是生物反应器中的 pH 值控制和溶解氧。前一个参数可通过不同浓度的 CO2 加气或添加碱溶液来调整,而后者则通过改变氧气浓度、气体流速、搅拌器速度和分布器设计来调整。所有这些工艺变量都可能对细胞性能产生重大影响。例如,人们广泛接受并在文献中表明,酸性环境会降低比生长率 (4)。因此,从小规模振荡实验中确定的既定补料策略开始,必须根据细胞需要,修改生物反应器中的补料方案。
同时测试两个类似的生物反应器策略(BR I 和 BR II),并在前四个培养日根据最佳振荡策略 VI 进行补料。
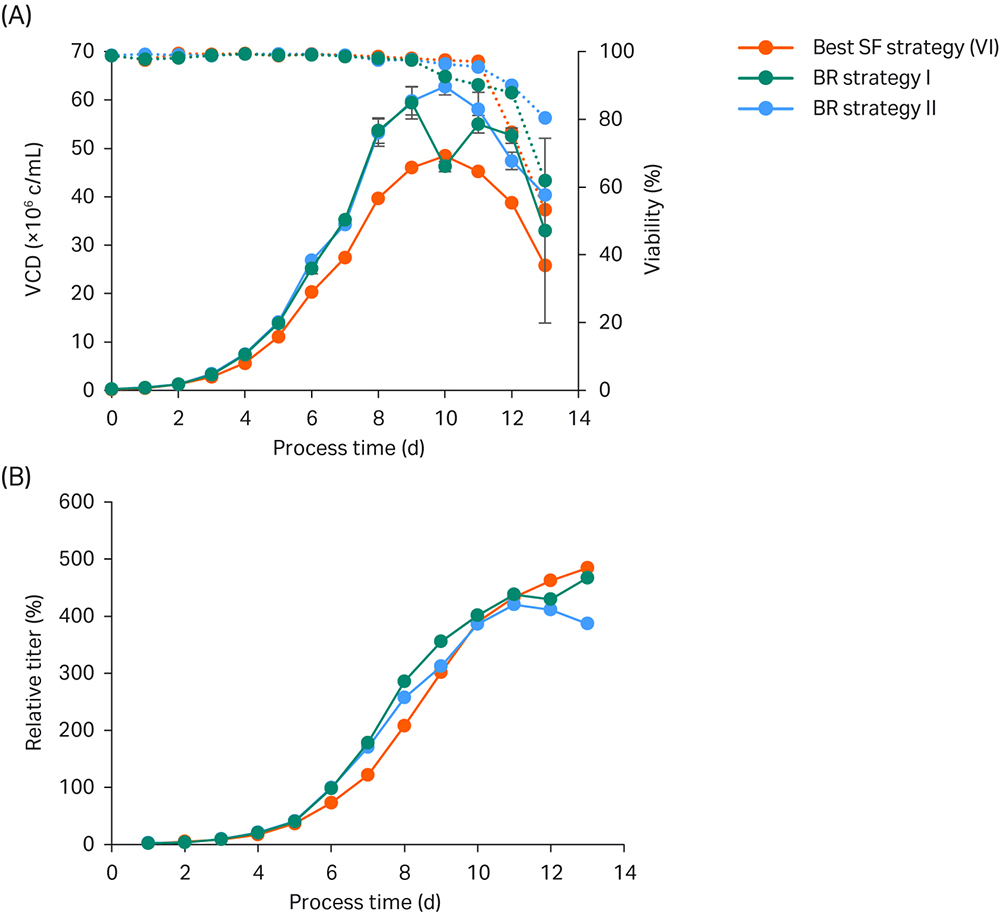
图 5. 生物反应器验证运行。(A) VCD 和活力;(B) 相对于基础 ActiPro™ 批量培养峰值滴度的滴度值。生物反应器培养基均重复运行。
在本例中,为实现最佳生长率与最少碱添加,将生物反应器 pH 设定值折衷定为 6.9。在摇瓶 (SF) 培养的前两天观察到高初始增长率。在第 3 天,SF 中的 VCD 达到 2.8 MVC/mL(图 5),并且随着培养基中乳酸积累至 1.7g/L,pH 值显著下降(数据未显示)。在生物反应器中,在第 3 天停止 CO2 添加,添加碱,将 pH 值控制在恒定的 pH 6.9(表 3)。
表 3. 500 mL DASGIP 生物反应器 (BR I) 培养的工艺控制概览*
|
CB7a/b (% w.v.) |
葡萄糖储备 (g/L) |
总葡萄糖 (g/L)(CB7a/b + 储备) |
转速/流量 (L/h) |
pH.SP/XCO2 (%)/碱积累 (mL) |
备注 |
|
| 第 0 天 | 0% | +0 | +0 | 80/3 | 6.9/15/0 | 3 个临界参数:i) 营养素 ii) 溶解氧 iii) pH 值 |
| 第 1 天 | 0% | +0 | +0 | 80/3 | 6.9/13/0 | |
| 第 2 天 | 0% | +0 | +0 | 80/3 | 6.9/10/0 | |
| 第 3 天 | 3.3% | +0 | +2 | 80/3 | 6.9/3/0 | |
| 第 4 天 | 3.3% | +0 | +2 | 80/3 | 6.9/3/9 | |
| 第 5 天 | 3.3% | +0 | +2 | 80/3 | 6.9/3/18 | |
| 第 6 天 | 3.3% | +2 | +4 | 100/9 | 6.9/0/20 | |
| 第 7 天 | 6.6% | +2 | +6 | 150/18 | 6.9/0/27 | SF:临界渗透压 BR:Glu/Gln 和 NH 4+ (!) 低 |
| 第 8 天 | 6.6% | +0 | +4 | 180/20 | 6.9/7/27 | SF:葡萄糖极限,消耗的乳酸 |
| 第 9 天 | 3.3% | +0 | +2 | 180/20 | 6.9/15/27 | BR:渗透压临界,Glu/Gln 增加 |
| 第 10 天 | 0.0% | +3 | +3 | 180/20 | 7.0/18/27 | BR:临界渗透压,无需补料,Gluc/Lac 极限(仅 Gluc),pH.SP 7.0Gluc |
| 第 11 天 | 0.0% | +2 | +2 | 120/9 | 7.0/30/27 | BR:无需补料(Glu/Gln),仅 Gluc |
| 第 12 天 | 0.0% | +2 | +2 | 120/9 | 7.0/30/27 |
* Cell Boost 7a 和 7b (CB7a/b) 的添加量表示为实际工作体积的百分比 (% w.v.)。葡萄糖浓度的最终升高以 g/L 为单位表示,包括添加 CB7a/b 或单独添加 250g/L 葡萄糖储备溶液带来的升高。还显示了其他关键生物反应器参数,包括搅拌器速度 (rpm)、气流 (L/h)、pH 设定值 (pH.SP)、气道流的 CO2 浓度 (XCO 2) 和累积碱体积 (mL)。
由于培养基 pH 值较高,生物反应器培养基在第 4 天和第 5 天显示出更高的比生长率,从而导致消耗的葡萄糖更多。乳酸水平达到了临界值 3.9 g/L。因此,我们决定在第 5 天并行测试挽救策略 (BR II),将乳酸积累、碱添加量和最终渗透压保持在低水平。根据最佳振荡策略 (VI) 对一个重复培养基 (BR I) 进行补料,而在第 5 天停止对备用培养基添加补料,导致培养物谷氨酸、谷氨酰胺和氨水平在此后一天急剧下降(数据未显示)。此外,葡萄糖水平受限,转化成了乳酸,导致挽救策略 (BR II) 与 BR I 相比,碱添加量减少,渗透压急剧降低。
在第 5 天继续以 3.3% CB7a/b 对培养基 BR I 补料。由于 CB7a 含有大约 70 g/L 的葡萄糖,因此从补料溶液中增加了 2 g/L 的葡萄糖(表 3)。在第 6 天,培养基中测得的葡萄糖降低了 1.9 g/L,这样算来,从第 5 天到第 6 天,葡萄糖消耗量为 3.9 g/L。因此,在第 6 天,通过添加 CB7a/b 添加 2 g/L 的葡萄糖,并通过葡萄糖储备溶液再添加 2 g/L 的葡萄糖,来限制乳酸积累,同时保持细胞的高活力和生长率(表 3)。
在第 6 天,由于葡萄糖、谷氨酸盐、谷氨酰胺和氨水平较低,两种 BR 策略的渗透压均比 SF VI 低。这种有利条件为添加补料和碱提供了更多空间。由于内源性谷氨酰胺的合成需要消耗大量的氨,在 BR II 的第 6 天。BR I 的第 7 天,氨水平达到临界值。因此,我们决定在 BR II 的第 7 天,BR I 的第 8 天将每日补料添加量增加到 6.6%,以防止谷氨酸和氨水平受到限制。
在第 9 天,两个 BR 策略的重复培养基都超过了 400 mOsm/kg 的阈值,并显示比生长率下降。此外,谷氨酸浓度保持稳定,谷氨酰胺在培养基中积累。因此,我们决定将补料量减少到 3.3% CB7a/b。在第 10 天,活力略有下降,并观察到氨水平急剧升高,这表明补料分批培养处于后期阶段。由于测得的谷氨酸水平继续升高,我们决定不再每天添加 CB7a/b,只在最后几天的培养日添加葡萄糖,维持临界渗透压。
使用如表 3 所示的优化生物反应器补料分批培养设置,培养基达到了 60 MVC/mL 的超高 VCD 值,并获得了与最佳小规模摇瓶实验相似的峰值滴度。这些结果是基础 ActiPro™ 批量实验结果的 5 倍。
结论
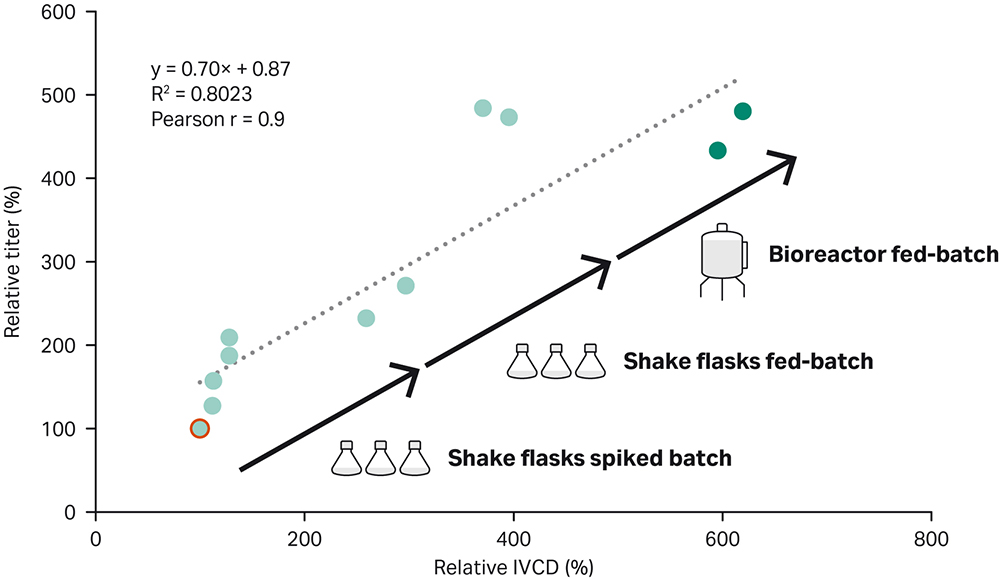
本文描述了一种实现高性能补料分批培养工艺的直接方法。该工作流程包括初始加标批量实验,然后在摇瓶中进行补料分批培养优化,最后再生物反应器中进行优化,为表达 IgG1 的重组 CHO-K1 GS -/- 细胞系提供了优化的补料分批培养工艺。滴度比简单 ActiPro™ 批量培养中的滴度高 500%(图 6)。重要的是,发现了滴度增加与活细胞密度 (IVCD) 的累积积分之间的相关性(皮尔逊相关系数 r = 0.9)。这突出说明,要显著提高收获滴度,需要提高高活细胞密度。
图 6. 使用演示的补料分批培养开发工作流程提高收获滴度以及活细胞密度 (IVCD) 的累积积分。发现滴度与 IVCD 值的皮尔逊相关系数为 r=0.9。
初始批量测试突出表明,谷氨酸是最重要的关键营养素,如耗尽,会限制细胞生长。此外,在高渗透压下观察到生长率降低。这些发现表明需要更复杂的补料方案来保持低渗透压,同时维持临界谷氨酸水平。基于 KISS 原理的简单补料方案允许在小规模摇瓶培养中进行高通量补料分批筛选。此类策略基于简单的每日食团补料量,并在优化后显著增加了收获滴度和最终 IVCD。与摇瓶培养相比,生物反应器中的细胞表现可能不同,主要是因为在生物反应器内按照既定设定值对溶解氧和 pH 值进行了控制。
将起始 pH 设定值选为 6.9 时,我们观察到生物反应器中初始生长率增加,同时葡萄糖的吸收增加,乳酸分泌增加。因此,在摇瓶中优化的补料策略通过在既定时间点停止添加补料或增加补料量来调整,以便为细胞提供足够的营养(谷氨酸),但将包括乳酸在内的有毒副产物保持在最低水平。后一点还最大限度地减少了碱的添加量并将渗透压保持在较低的浓度,这为添加更多补料留下了空间。
下载培养基选择手册鸣谢
感谢 Horizon Discovery 允许我们使用其数据进行富有洞见的讨论。
- Application note: Optimization of fed‑batch culture conditions for a mAb‑producing CHO cell line. Cytiva, CY15106-10Jul20-AN. 2020.
- Lu F, Toh PC, Burnett I, et al. Automated dynamic fed-batch process and media optimization for high productivity cell culture process development. Biotechnol. Bioeng. 2013;110:191-205. doi: 10.1002/bit.24602
- Hoshan L, Jiang R, Moroney J, et al. Effective bioreactor pH control using only sparging gases. Biotechnol. Prog. 2019;35:e2743. doi: 10.1002/btpr.2743
- Brunner M, Fricke J, Kroll P, and Herwig C. Investigation of the interactions of critical scale-up parameters (pH, pO2 and pCO2) on CHO batch performance and critical quality attributes. Bioprocess. Biosyst. Eng. 2017;40:251-263. doi: 10.1007/s00449-016-1693-7.
Routine cultivation
A recombinant CHO-K1 GS -/- cell line expressing an IgG1 antibody (HD BioT-016, Horizon Discovery, UK) was routinely cultured in HyClone™ brand ActiPro™ medium (Cytiva) without any supplements. Cells were passaged twice a week at 0.3 MVC/mL to keep them in exponential growth phase. A 30 mL cell suspension was cultured in a 125 mL shake flask in a Kuhner incubator at 140 rpm with an orbital shaking diameter of 25 mm. Temperature was 37°C and humid atmosphere had 7% CO2.
Feed addition
HyClone™ brand Cell Boost™ 7a and 7b (Cytiva) were added separately to the cultures as bolus feed on each feeding day. Importantly, HyClone™ brand Cell Boost™ (CB) 7b was always added as 1/10 of the volume of Cell Boost™ (CB) 7a by default throughout this study, as recommended by the manufacturer. As an example, a 1.1% CB7a/b feed addition means that 10 mL of cell suspension received 100 µL of Cell Boost™ 7a and 10 µL of Cell Boost™ 7b.
Batch experiments in shake flasks (SF)
Cells from routine cultivation were passaged into prewarmed HyClone ActiPro medium at 0.3 MVC/mL in a final starting volume of 35 mL in a 125 mL shaker flask. Cultures were spiked with 0.0%, 1.1%, 3.3% or 5.5% of Cell Boost 7a and 7b on day 0 and incubated in the Kuhner shaker incubator at 140 rpm at 25 mm orbital shaking diameter, 37°C, and humid atmosphere with 7% CO2.
Fed-batch experiments in shake flasks (SF)
Cells from routine cultivation were passaged into prewarmed HyClone™ brand ActiPro™ medium at 0.3 MVC/mL in a final starting volume of 60 mL in a 250 mL shaker flask. Cultures were fed with Cell Boost™ 7a and 7b once daily by a simple bolus feed volume, according to the tested feeding regimens, and incubated in a Kuhner shaker incubator at 140 rpm at 25 mm orbital shaking diameter, 37°C and humid atmosphere with 7% CO2. For the fed-batch experiments in shake flask (SF) the glucose level was controlled by addition of a 250 g/L glucose stock solution to 6 g/L once cultures reached a minimum glucose concentration of 3 g/L.
Fed-batch bioreactor experiments in bioreactors (BR)
Cultures were seeded at 0.3 MVC/mL into HyClone™ brand ActiPro™ medium in a final starting volume of 500 mL. Cultivation was started in a DASGIP bioreactor system at 37°C with a minimum stirrer speed of 80 rpm and a constant pH setpoint of 6.9. Dissolved oxygen (DO) was kept constant at 30% using an automated cascade for variable flow rate and oxygen concentration in the inlet gas flow or by manual adjustment of the stirrer speed. The pH of the culture was regulated at pH 6.9 by CO2 or 4% sodium bicarbonate solution, and foaming was prevented by manual dropwise addition of a diluted (1:100) Antifoam C solution. The pH setpoint was changed to pH 7.0 on day 10 of the fermentation to prevent excessive CO2 addition for the last three process days.
Offline analytics
Viable cell densities (VCD) and viability was measured with a ViCell instrument using trypan blue dye exclusion. Glucose, lactate, L-glutamate, L-glutamine, and ammonia were measured with a Bioprofile™ 100 plus instrument. The osmolality was measured with an Osmomat 030 instrument. Antibody titers were measured with an Octet Red instrument.