Alligator Bioscience AB 从事癌症治疗的抗体药物研发,专门研究肿瘤靶向免疫疗法的单特异性和双特异性抗体。该公司专注于早期药物开发,包括从早期概念到临床 II 期研究。
本文介绍我们与 Alligator 合作开发癌症免疫疗法双特异性抗体 (bsAb) 高效下游纯化工艺的成果。这项研究的主要发现包括:
- 将 MabSelect SuRe™ 换成新开发的 MabSelect PrismA™ 填料之后,装填能力提高了 53%(使用装填能力为 70% Qb10 的 MabSelect PrismA™)。
- 虽然 bsAb 在耐 pH 值和耐盐影响方面的稳定性限制了精纯步骤可用条件的选择范围,但可以通过条件优化在结合/洗脱 (B/E) 和流穿 (FT) 模式下对 Capto™ adhere 进行纯化。
- 就 bsAb 的稳定性而言,评估的 Capto™ adhere 洗脱条件被认为是适合采用 B/E 的良好条件。
- 该条件用于精纯步骤 — 但要采用洗脱 FT 模式,而不是 B/E 模式 — 可以显著提高收率(收率 > 90%)并且 HCP 水平和蛋白 A 清除率均达到可接受水平。
- 改进后的工艺既提高了产品收率又提高了工艺经济性。
简介
近年来,由于可以结合两种抗原,相比单克隆抗体具有独特的作用模式,因而双特异性抗体 (bsAbs) 越来越受到关注。目前,随着新型与改进型抗体生物工艺和重组技术的诞生,临床试验中双特异性抗体结构体的数量激增。截至 2019 年,1 种 bsAb 已获批,57 种 bsAb 正在进行临床试验 (1)。
bsAb 形式多样,都具有两个不同的位点,可以靶向不同的抗原。bsAb 的这种双特异性意味着可以使用一个抗原结合位点与靶细胞结合,而使用另一个抗原结合位点募集其他细胞或分子。
在纯化含 Fc 的 bsAb 时,制造商通常使用基于 Protein A 层析的平台方法来捕获抗体。然后通过后续精纯步骤获得符合终产品质量要求的产品。
本文介绍 bsAb 两步纯化的最新发展。原来的 MabSelect SuRe™ 捕获步骤改为 MabSelect PrismA™ 后提高了工艺的经济性。本研究中使用的 bsAb 是一种抗肿瘤的人 IgG1 对称双特异性抗体,有关该 bsAb 的形式见图 1。
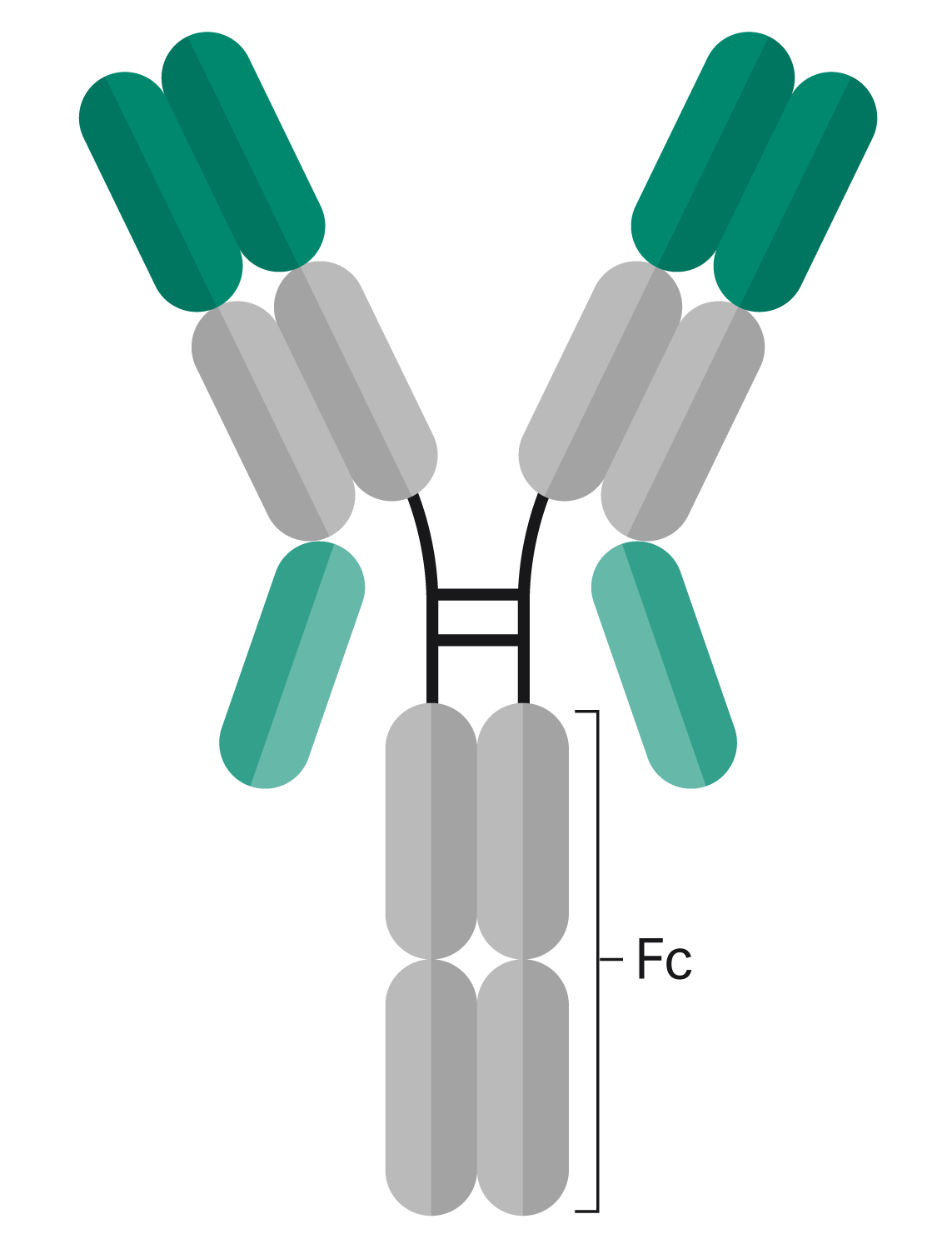
图 1. 本研究所用抗体的 bsAb 形式。重组蛋白与轻链(浅绿色部分所示)的 c 端连接,从而形成第二个结合域。抗体的 Fc 部分是没有经过任何进一步改造的完全人源化 IgG1。
目前采用 MabSelect SuRe™ 的纯化工艺
原来的下游 bsAb 纯化工艺采用常规单克隆抗体 (mAb) 常用的平台,不同的是,由于抗体对于 pH 值的敏感性,将传统的低 pH 值病毒灭活步骤改为使用溶剂/去污剂。为了立即提高 MabSelect SuRe™ 洗脱液的 pH 值,将洗脱池中的液体收集到一个用 200 mM 磷酸钠缓冲液 (pH 6.9) 预处理的容器中。图 2 所示为原来工艺的示意图。

图 2. 原来的 bsAb 纯化下游工艺。
评估 MabSelect PrismA™对于 bsAb 的捕获情况
尽管原来使用 MabSelect SuRe™ 的工艺可以获得高收率和高纯度,但为了进一步提高工艺的经济性,我们对最新开发的蛋白 A 填料 MabSelect PrismA™ 进行了评估,考察其是否可以替代前者。
由于实验采用了未经过培养收率优化的早期研究材料,所以澄清后的收获物的滴度较低 (0.8 g/L)。因此,为了减少工艺开发步骤,将停留时间 (RT) 设为 4 分钟,而不是 MabSelect PrismA™ 推荐的 6 分钟。4 分钟 RT 的前沿分析表明,MabSelect SuRe™ 和 MabSelect PrismA™ 填料在 10% 透过率 (Qb10) 时的动态结合载量 (DBC) 分别为 42 g/L 和 64 g/L。
使用 MabSelect PrismA™ 的改进型捕获步骤
使用 Tween™ 20 和磷酸三正丁酯在中性 pH 值下进行病毒灭活。Alligator 提供的含有目标 bsAb 的上清液在室温下用病毒灭活溶液处理 90 分钟。灭活后,我们用 0.5 M NaOH 将 pH 值调至 7.0,并使用 0.22 μm 滤器过滤经过病毒灭活的上清液。
我们测试 MabSelect PrismA™ 的目的是为了研究它是否能提供比 MabSelect SuRe™ 更高的装填能力。
根据透过能力,将装填能力设定为每升 MabSelect PrismA™ 装填 45 g bsAb,相当于 70% 的 Qb10。
在不同的规模下进行测试,首先使用装填 MabSelect PrismA™ 的 Tricorn™ 5/100 层析柱(柱体积 (CV) = 2 mL),得到 bsAb 的收率为 87%。然后,将规模放大到更宽的 Tricorn™ 10/100 层析柱(柱体积 (CV) = 7.4mL),得到的收率为 91%。最后,由于精纯步骤需要更多材料,因此捕获步骤使用更大的 HiScale™ 16/20 层析柱(柱体积 (CV) = 24 mL)进行,得到的收率为 95%。在下游工艺中可以观察到收率通常随层析柱尺寸的增大而增加。
将洗脱的部分收集到 50 mL 试管中。为保持 bsAb 的完整性,该试管预先用 0.3 至 0.4 柱体积 (CV) 的 200 mM 磷酸钠中和缓冲液 (pH 6.9) 处理。
改进后的捕获步骤情况如下:
| 层析柱: |
Tricorn™ 5/100(柱体积 (CV) = 2 mL);Tricorn™ 10/100(柱体积 (CV) = 7.4 mL);HiScale™ 16/20(柱体积 (CV) = 24 mL),装填 MabSelect PrismA™ 填料 |
| 样本: |
含有 bsAb 和添加病毒灭活溶液的细胞培养上清液 |
| 层析柱装填能力: |
70% Qb10 (45 g/L) |
| 平衡: |
10 mM 磷酸钠,150 mM NaCl,pH 值 7.0,柱体积 (CV) 3 |
| 洗涤: |
10 mM 磷酸钠,150 mM NaCl,pH 值 7.0,柱体积 (CV) 7 |
| 洗脱: |
100 mM 甘氨酸-HCl,pH 值 3.2,柱体积 (CV) 8(洗脱峰在 90 到 72 mAU 之间) |
| 再平衡: |
10 mM 磷酸钠,150 mM NaCl,pH 值 7.0,柱体积 (CV) 3 |
| 流速: |
4 分钟 RT |
| 在线清洁 (CIP): |
0.5 M NaOH,3 CV,5 分钟 RT |
| 检测: |
A280 nm |
| 系统: |
ÄKTA pure™ 25 |
结合/洗脱模式下的 Capto™ adhere 精纯结果分析 (Evaluation)
首先,在原来的下游工艺条件下,我们使用 Capto™ adhere 在 B/E 模式下进行精纯步骤。使用这种方法时,目标分子通过混合模式相互作用与填料偶联的配基结合。随后,pH 值发生变化,使分子从填料中释放出来,然后收集洗脱液。
所用填料为 Capto™ adhere,装填在柱床高度为 20 cm 的 Tricorn™ 5/200 层析柱中。经过 MabSelect PrismA™ 纯化的 bsAb 缓冲液更换为含 10 mM 磷酸钠、80 mM 氯化钠、pH 值 7.4 的溶液。按每毫升填料 27 mg bsAb 进行上样。收集 324 到 297 mAU 之间的洗脱液进行分析。计算得到的收率为 67%,同时 HCP (4 ppm)、浸出蛋白 A (2 ppm) 和聚集体 (0.4%) 的水平均远低于研究开始时设定的水平(图 3)。
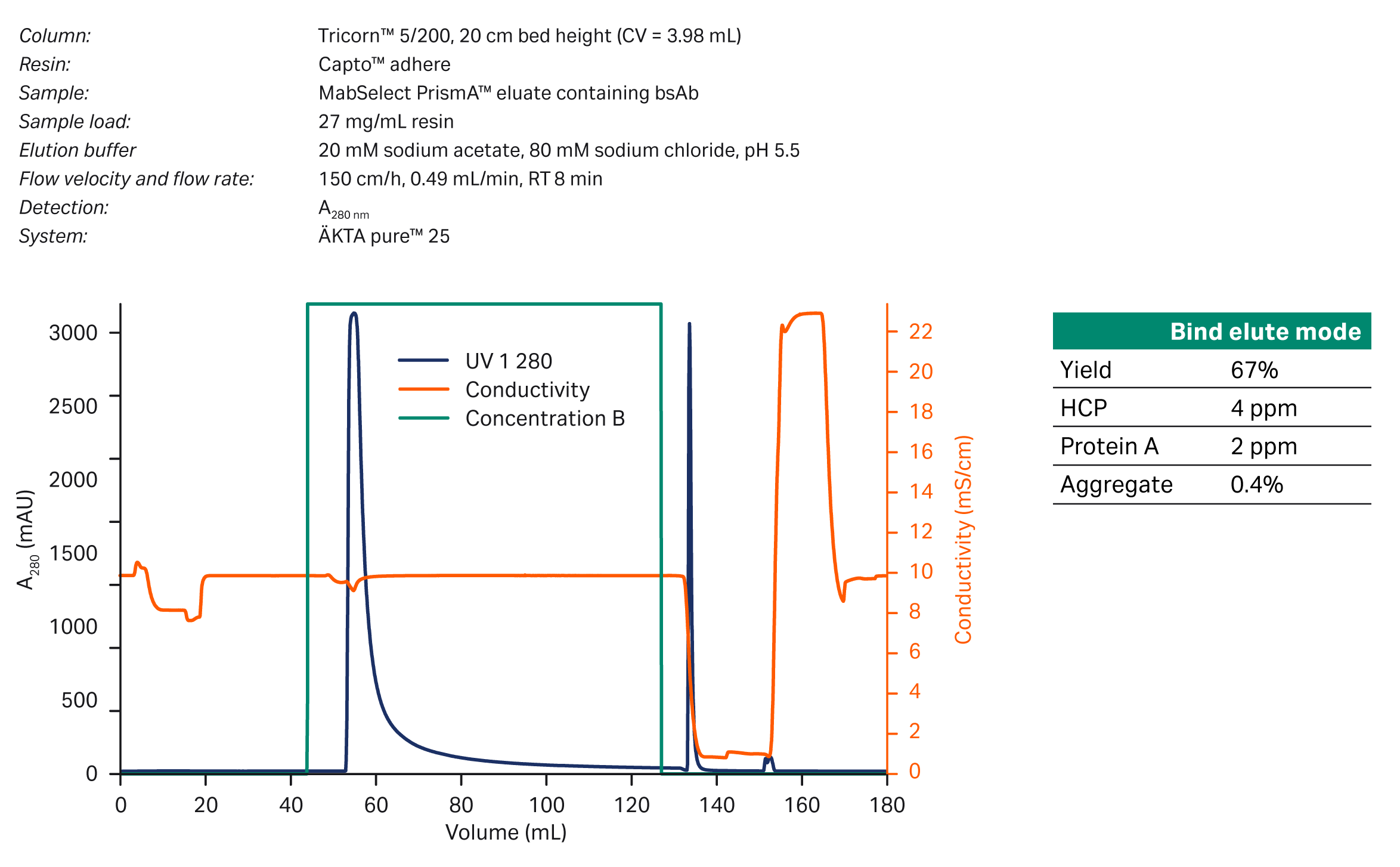
图 3. B/E 模式下 Capto™ adhere 精纯步骤的层析图谱。表中所示 bsAb 的收率达 67%。
Capto™ adhere 精纯步骤中的 bsAb 稳定性测试
为了改进 Capto™ adhere 步骤,我们使用极端的缓冲液 pH 值与盐浓度条件评估了 bsAb 的稳定性。我们通过该研究发现,bsAb 可以 pH 值 5 和 7.1 之间、40 至 200 mM NaCl 的条件下保持稳定。使用 96 孔板将纯化后的 bsAb (20 mg/mL) 用符合上述范围的九种不同缓冲条件稀释至 4 mg/mL 的浓度。将样本置于振荡器中孵育 2 小时。
将起始样本的面积与使用凝胶过滤层析法 (SEC) 分析后的样本面积进行对比,以此估算收率。在设定的条件下,我们未观测到聚集体水平或收率受到影响(图 4)。
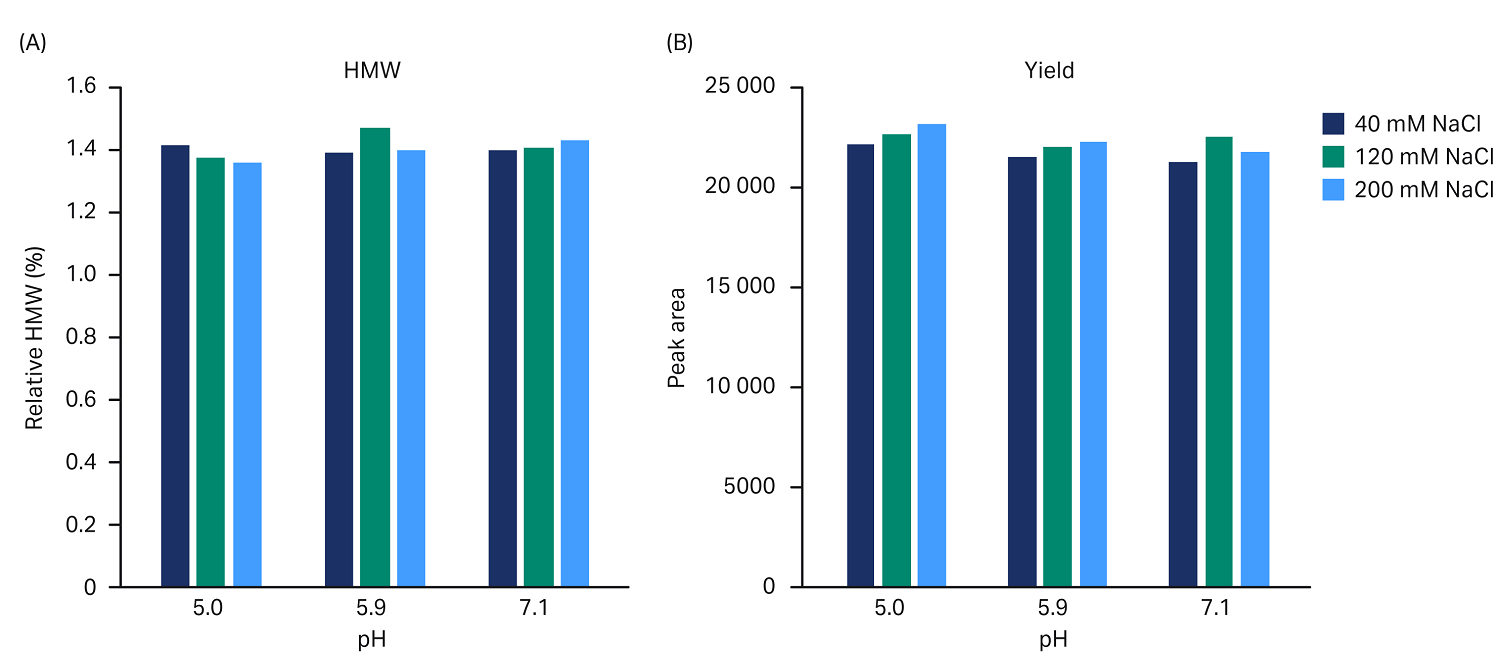
图 4. 使用 pH 值 5.0、5.9 和 7.1 以及盐浓度 40、120 和 200 mM NaCl 的不同缓冲液处理 2 小时后,bsAb 的聚合体水平及收率:(A) 聚合体水平,(B) 收率
精纯步骤:筛选实验
Capto™ adhere 也可用于流穿 (FT) 模式,使杂质与填料结合,并在层析流穿液中收集目标分子。由于装填能力明显高于 B/E 模式,因此 FT 过程的工艺经济性通常更高。
为了提高工艺收率和工艺经济性,我们使用装填有 6 µL Capto™ adhere 的 96 孔 PreDictor 板对潜在 FT 方法进行了评估。此工艺开发的目的是为了确定非结合条件下的最优层析条件,同时获得高收率并且 HCP 水平低于目标值,因为高分子量 (HMW) 物质的含量已经符合规格要求。
测试的平衡缓冲液由 pH 值为 5.0 至 7.1 的 100 mM 磷酸钠和浓度为 40 至 240 mM 的 NaCl 组成。孔用 3 × 200 µL 的平衡缓冲液做平衡处理。上样量设置为每毫升填料上样 157 mg,该上样量也可用于 FT 步骤。然后将孔板置于定轨振荡器上,速度设置为 1100 rpm,孵育 60 分钟。再将孔板的内容物全部转移到 UV 板,以 500 × g 的离心力处理 1 分钟。使用 UV 读取器读取吸光度。
bsAb 的结合载量测试结果如图 5a 中的热图所示,HCP 浓度如图 5B 所示。
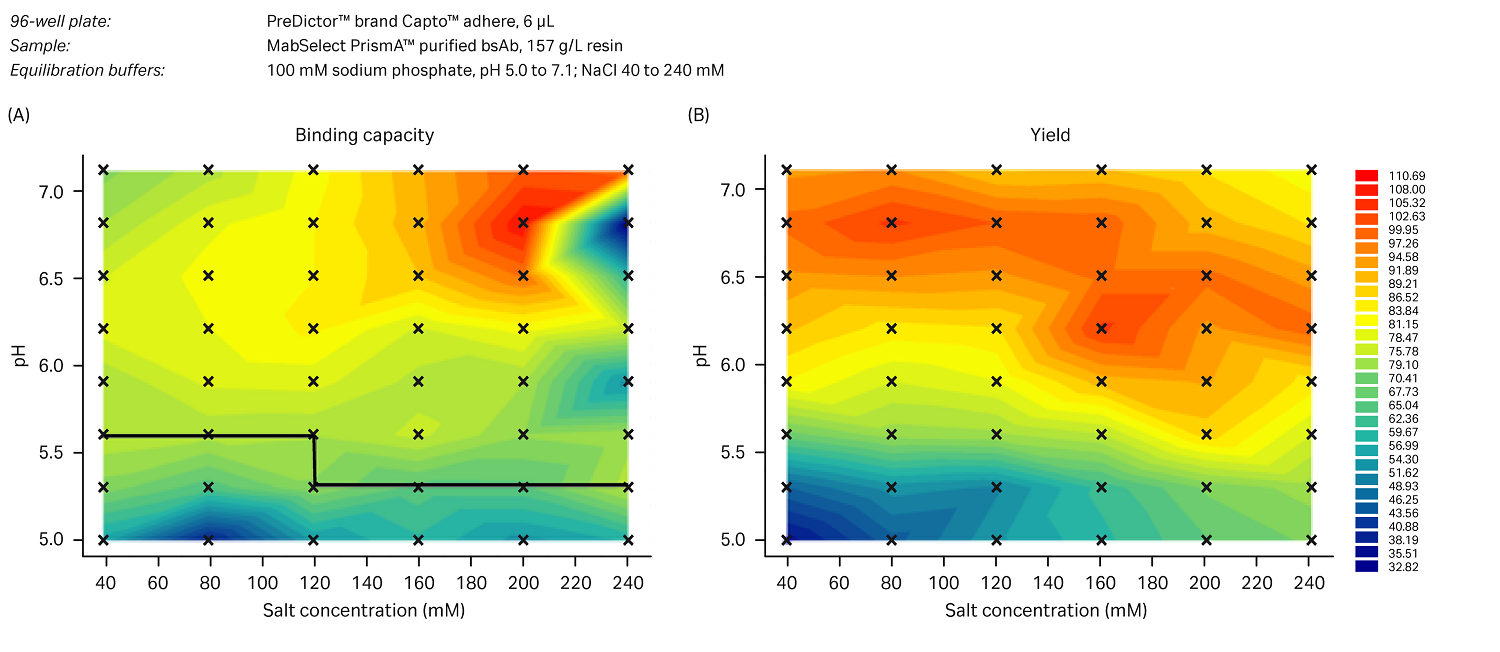
图 5. bsAb 结合载量 (A),其中蓝色表示结合载量最低(即最适合 FT 应用),红色表示结合载量最高。标记区域所示的条件为 HCP 水平 <100 ppm,即为研究设置的阈值。HCP 的收率百分比如 (B) 所示,其中蓝色表示最佳 HCP 清除率。通过孔板实验为层析柱 FT 模式选择了以下两种条件:pH 值为 5.0 的 40 mM NaCl 和 pH 值为 5.5 的 80 mM NaCl,两者都具有良好的 HCP 清除率和较低的 bsAb 结合载量。
在孔板实验中,我们观察到 pH 值/盐浓度较低的条件下 HCP 清除率更佳。然而,在早期的稳定性筛选中,我们观察到在这些条件下 bsAb 出现了稳定性问题。因此,我们决定将 PreDictor ™ 孔板研究得出的表观最佳条件(pH 值为 5.0 的 40 mM NaCl)与从工艺角度得出的更稳定的条件(pH 为 5.5 的 80 mM NaCl)进行比较。pH 值为 5.5 这一条件与原来工艺中采用的洗脱条件相同,Capto™ adhere 采用 B/E 模式。
流穿模式下 Capto™ adhere 精纯步骤的层析柱研究
在上述两种条件下,将 MabSelect PrismA™捕获步骤捕获的样本在开始和 Capto™ adhere 层析之前的缓冲液换为上样缓冲液。
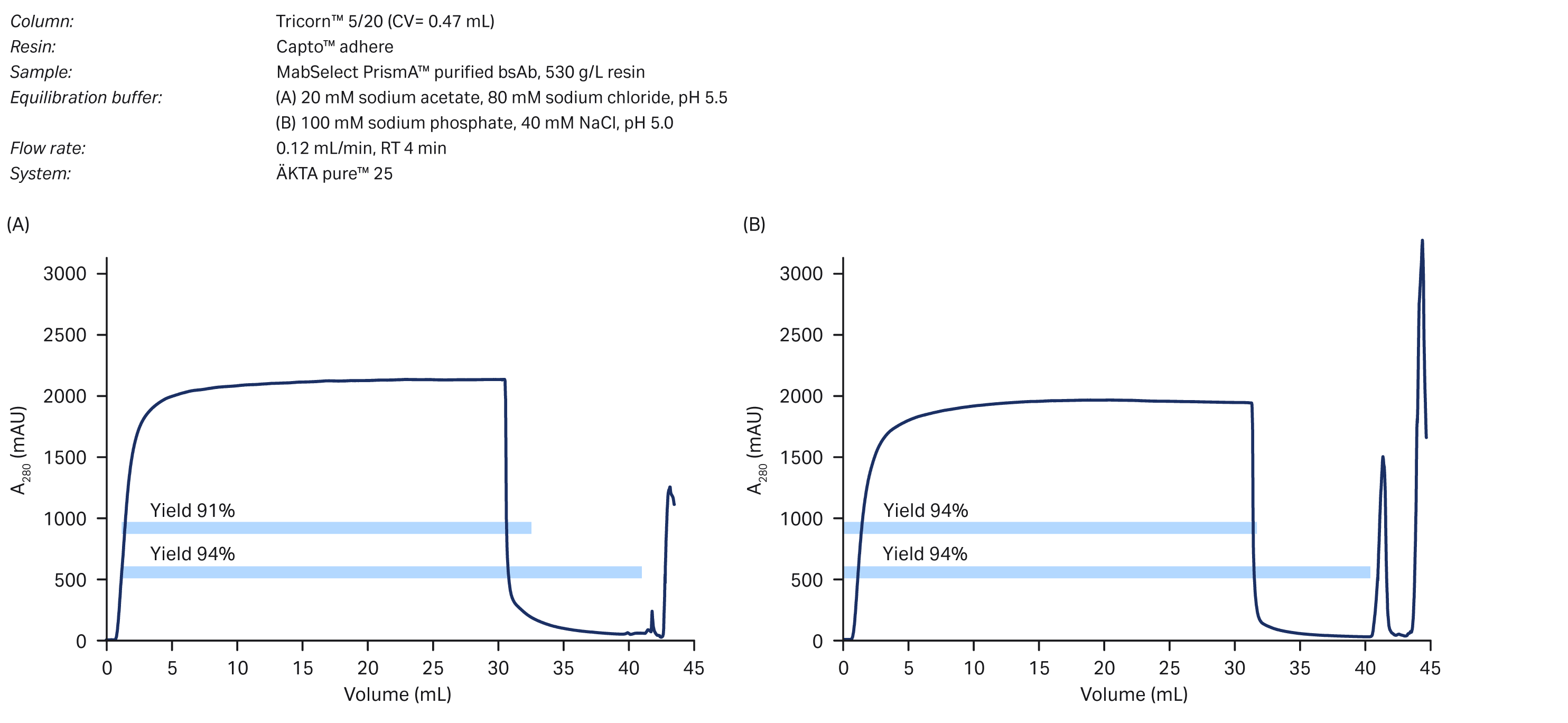
图 6. 在 FT 模式下 Capto™ adhere 对 bsAb 进行精纯纯化:(A) 使用 20 mM 醋酸钠、80 mM 氯化钠 (pH 值 5.5),(B) 使用 100 mM 磷酸钠、40 mM NaCl (pH 值 5.0)。下方横条表示包含清洗液部分在内的收率,上方横条表示不含清洗液部分的收率。
两种 FT 方法的精纯收率均超过 90%。观测发现,与原来的 B/E 工艺(见图 3)相比(收率为 67%),FT 模式的收率显著提高,达到了 94%。
聚集体、HCP 和浸出蛋白 A 分析
分析聚集体采用 Superdex™ 200 Increase 10/300 GL(柱体积 (CV) = 24 mL)凝胶过滤层析 (SEC) 进行分析。
MabSelect PrismA™ 捕获的起始样品中的聚集体含量已经很低,约为 1%。Capto™ adhere 步骤成功地进一步降低了聚集体含量,使其 <1%。(图 7)。相关层析处理中所选部分的聚集体含量在各层析图中以条形图表示,并且在本研究设定的规格范围内。
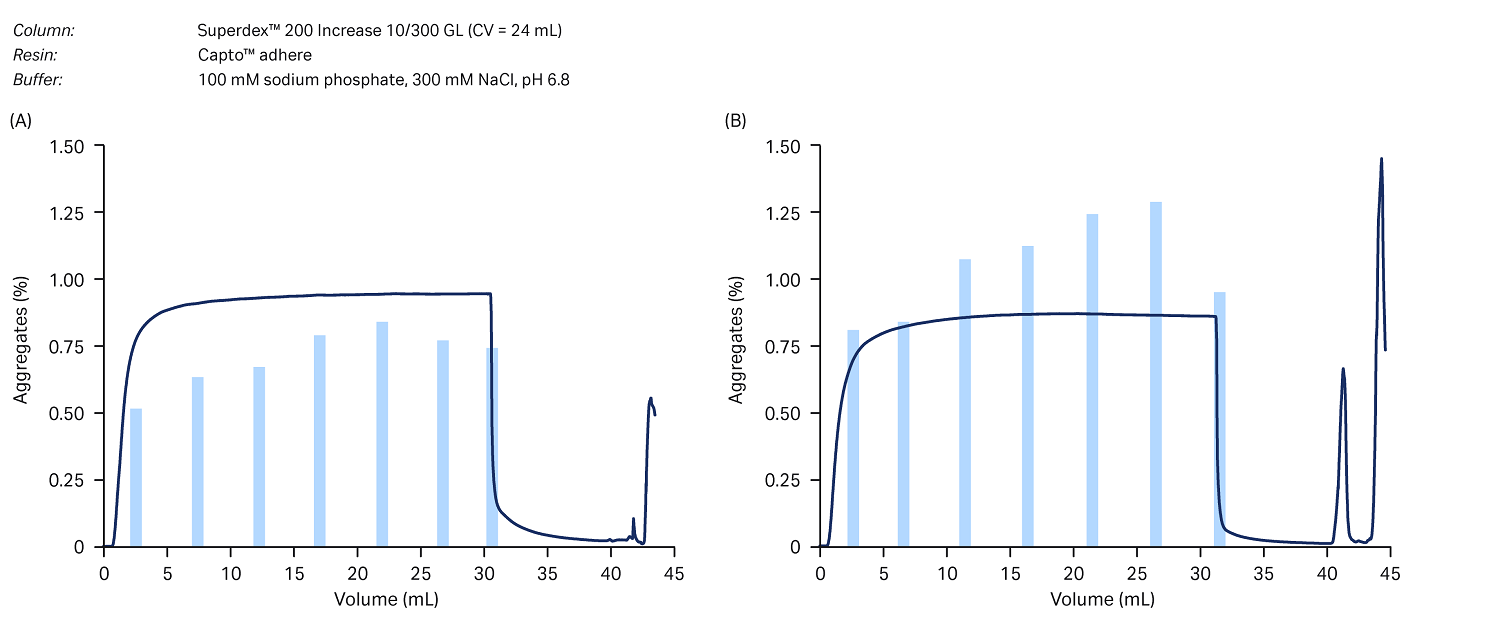
图 7. 使用以下凝胶过滤层析法进行聚集体分析:(A) Capto ™adhere 在 FT 模式下运行,使用 20 mM 醋酸钠、80 mM 氯化钠 (pH 值 5.5),(B) 使用 100 mM 磷酸钠、40 mM NaCl (pH 值 5.0)。
使用 Cygnus technologies 公司的第三代 CHO HCP ELISA 试剂(适用于 Gyrolab™ 工作站 (Gyros™ Protein Technologies)分析了起始样品中的 HCP 浓度以及B/E洗脱缓冲液步骤、FT 缓冲液步骤中的混合部分以及选定部分洗脱物中的 HCP 浓度(图 8)。
图 8A 清楚地显示了在 pH 值 5.5(11 至 110 ppm)下上样 FT 缓冲液时 HCP 浓度 (ng HCP/mL) 增加。在 pH 值 5.0 的条件下上样时(图 8B),整个上样过程中的 HCP 浓度分布更均匀。在收集的两种汇合液中,HCP 含量大致相同,pH 值 5.5 和 pH 值 5.0 对应的含量分别为 48 和 53 ng HCP/mg bsAb,低于本研究最初设定的规格 100 ng HCP/mg bsAb。此外,汇合液中可能包含洗涤液部分,由于该部分提供的 HCP 水平很低,对蛋白 A 或 HMW 含量没有显著影响。
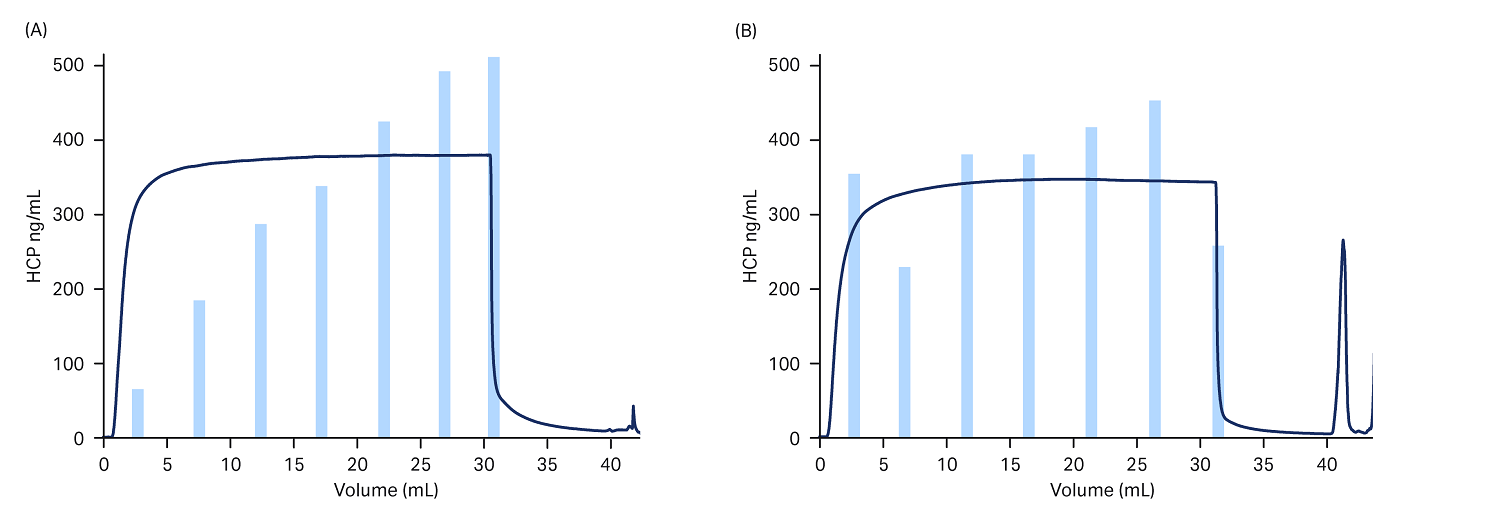
图 8. 使用 Gyrolab™ 工作站 (Gyros™ Protein Technologies) 分析得出的选定部分中的 HCP 浓度,采用的缓冲液为:(A) 20 mM 醋酸钠、80 mM 氯化钠 (pH 值 5.5),(B) 100 mM 磷酸钠、40 mM 氯化钠 (pH 值 5.0)。
Alligator 的 bsAb 纯化结果汇总于表 1 和表 2。对比操作模式(FT 与 B/E)可发现,收率的提高要以降低 HCP 清除率为代价。由于在两种 FT 条件下获得的结果相似,我们认为该 FT 方法是稳健的。为避免稳定性问题,该步骤应在 pH 值高于 5.0 的条件下操作,即 B/E 模式的洗脱条件也是 FT 模式的首选洗脱条件。
表 1. MabSelect PrismA™ 捕获步骤的结果和 Capto™adhere 精纯步骤的结果
| 使用 MabSelect PrismA™ 的捕获步骤 | 装填 70% 的 Qb10 => 每升填料 45 g |
|||
|---|---|---|---|---|
| 收率 |
93% |
|||
| 洗脱池: |
HCP 131 ppm |
|||
| 蛋白 A:11 ppm |
||||
| 聚集体:0.8% |
||||
| Capto™ adhere 精纯步骤 |
B/E |
FT pH 值 5.5 |
FT pH 值 5.0 |
|
| 收率 |
67% |
91% |
94% |
|
| 每毫升填料纯化量 |
18 mg |
485 mg |
495 mg |
|
| HCP |
4 ppm |
48 ppm |
53 ppm |
|
| 蛋白 A |
2 ppm |
3 ppm |
3 ppm |
|
| 聚集体 | 0.4% |
0.7% |
1.1% |
|
表 2. 总体收率
| MabSelect PrismA™ 收率 |
93% |
93% |
93% |
|---|---|---|---|
| Capto™ adhere |
B/E |
FT pH 值 5.5 |
FT pH 值 5.0 |
| 收率 |
67% |
91% |
94% |
| 总体收率 |
62% |
85% |
87% |
结论
本研究得出以下结论:
- 如果将捕获步骤的 MabSelect SuRe™ 换为 MabSelect PrismA™,在停留时间为 4 分钟的条件下可使上样量增加 53%。该结果可能会随着停留时间的延长而进一步增加,因为流穿曲线显示 MabSelect PrismA™ 的动力学反应比 MabSelect SuRe™ 快。
- 就 bsAb 的稳定性而言,经过优化的精纯条件被认为适用于 FT 应用。
- 尽管 FT 精纯模式采用的条件同样可以显著提高收率(收率超过 90%),但 HCP 和蛋白 A 清除率仍在可接受的水平。这为提高工艺的经济性提供了潜力。
- 比较发现,FT 精纯模式的两种条件的收率和纯度结果非常相似,因此我们有充分的理由相信 FT 模式和条件是非常稳健的。
参考文献
- Surs, F.V.et al. A review of bispecific antibodies and antibody constructs in oncology and clinical challenges.Pharmacol.Ther. 201: 103–119 (2019).https://doi.org/10.1016/j.pharmthera.2019.04.006