使用一次性设备的细胞型流感病毒生产工艺
本文说明如何将 Cytiva 一次性产品应用于疫苗生产领域。包括围绕现代疫苗工艺的简短讨论,然后提供一个案例研究,介绍使用一次性 ReadyToProcess 技术生产细胞型减毒活流感病毒的上下游工艺放大(图 1)。

简介
以鸡蛋为基础的生产是制造流感疫苗的最常用技术。该技术的局限性在于,每生产一剂疫苗需要一个受精卵。世界卫生组织 (WHO) 针对流感疫苗的全球行动计划 (GAP) 的目标是生产足够的季节性流感疫苗,以在 2015 年前为 20 亿人提供免疫接种 (1)。如果面临大流行病,全世界将需要超过 130 亿剂疫苗才能通过两次免疫来保护未成年人。从这个角度来看,2011 年,全球 25 家领先的疫苗生产商生产了 6.2 亿剂疫苗 (2)。显然需要在更短时间内生产更多剂量。
细胞型疫苗生产工艺具有良好的特性,可以满足能力需求。与以鸡蛋为基础的生产相比,它的优势还在于生产时间更短,从而提高了适应季节性菌株的能力。
市场上有三种不同类型的流感疫苗:裂解疫苗、亚单位疫苗和减毒活疫苗。每剂减毒活流感疫苗 (LAIV) 所需的病毒颗粒较少。这转化为每生产量更多的剂量,因此可以在某种程度上弥补生产能力的不足。
由于存在许多需要克服的障碍,例如生产成本、物流和生产能力,我们认为几种疫苗已经成为当今西方免疫计划的基础,但尚未普及到发展中国家。诸如流感嗜血杆菌 B (HiB)、日本乙型脑炎 (JE)、轮状病毒和肺炎球菌感染等疾病是发展中国家拯救数百万儿童生命的目标。因此,需要持续开发现有的疫苗生产工艺以改善进入发展中市场的机会、更快响应疫苗需求以及增加生产剂量。未来的疫苗需要使用新技术开发。通过使用现代技术和细胞型上游工艺,可以生产更接近本地市场的产品,以克服分销方面的障碍,并降低生产成本和工厂占地面积。
提高制造敏捷性和生产率
与传统的不锈钢设施相比,基于一次性技术的生物制造提供了极大灵活性。可以更轻松地修改生产线,以生产不同的产品,并且显著促进适应市场需求的生产量调整。此外,一次性用品可最大限度地减少生产批次之间交叉污染的风险,并且无需耗时且成本高昂的清洁和验证程序。
一次性系统在当今的制造业中已广为接受,其广泛使用是由一系列好处推动的,如资本投资减少和延迟以及从固定成本向可变成本转变。一次性系统允许在方案之间进行快速转换,并有机会每年生产更多批次。设施利用率优化是最大限度地降低生产成本和增加潜在收入的关键。
减少环境影响
在生物制造工艺中使用一次性产品对环境的影响已被广泛讨论。一种观点是,与传统不锈钢设施相比,一次性用品对环境的影响更大。在 Cytiva 与 Biopharm Services 合作进行的同行评审的生命周期评估 (LCA) 研究中,将一次性设备与传统不锈钢设备进行了比较 (3)。评估了产品整个生命周期中的环境影响:从设备组成材料和组件的生产到设备的使用和最终处置。这项研究的结果表明,基于一次性设备的设施比基于传统不锈钢设备的设施对环境的影响更低。所有调查的 18 个环境影响类别都显示了这一点。该 LCA 研究确定的最大节约是使用阶段的能源需求和用水需求。
使用一次性设备生产流感病毒
为了应对当今疫苗生产中的挑战,进行了仅基于一次性设备放大疫苗生产的案例研究。整个活流感病毒被用作模型系统。本文介绍了从实验室规模放大至生产规模的摘要。有关各个上下游工艺的更详细描述,请参阅应用说明 29043548 (4) 和 29043549 (5)。
图 2 概述了上下游工艺,包括细胞扩增、流感传播、纯化和分析。

上游处理
黏附 Vero 细胞在静态细胞工厂中扩增,以产生 10 L 种子培养物的接种物。10 L 培养物中的细胞在 Cytodex 1 微载体 (3 g/L) 中生长,由 WAVE Bioreactor 20/50 系统提供。细胞生长至约每毫升 3 × 106 个细胞的细胞浓度。随后用胰蛋白酶将细胞从微载体上分离,并用于在 WAVE Bioreactor 200 系统中接种 50 L 微载体培养物。微载体浓度保持恒定。在从 10 L 到 50 L 的工作体积放大期间,以 1:5 的裂解比可获得足够的细胞回收率。
细胞转移的一个普遍挑战是迟滞期,在此期间细胞正在适应新的培养基,并且观察到细胞数量很少或没有增加。在 50 L 培养物中,细胞重新附着并开始在新的微载体上生长而没有迟滞期。在连续三个批次的 10 L 和 50 L 培养物中,细胞生长速率表现相似(图 3)。
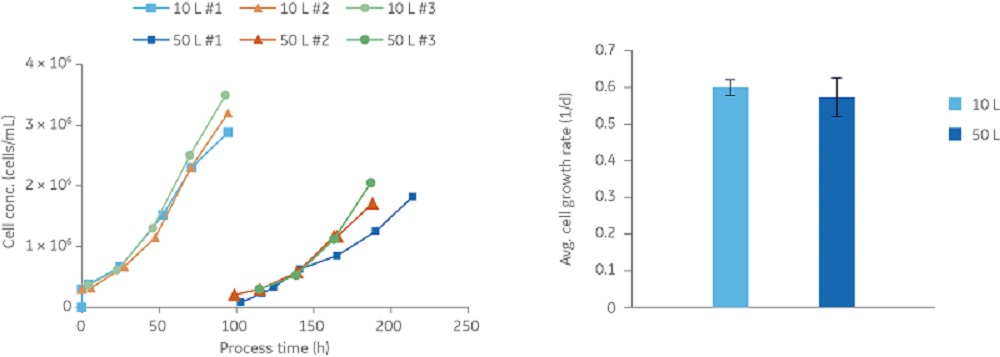
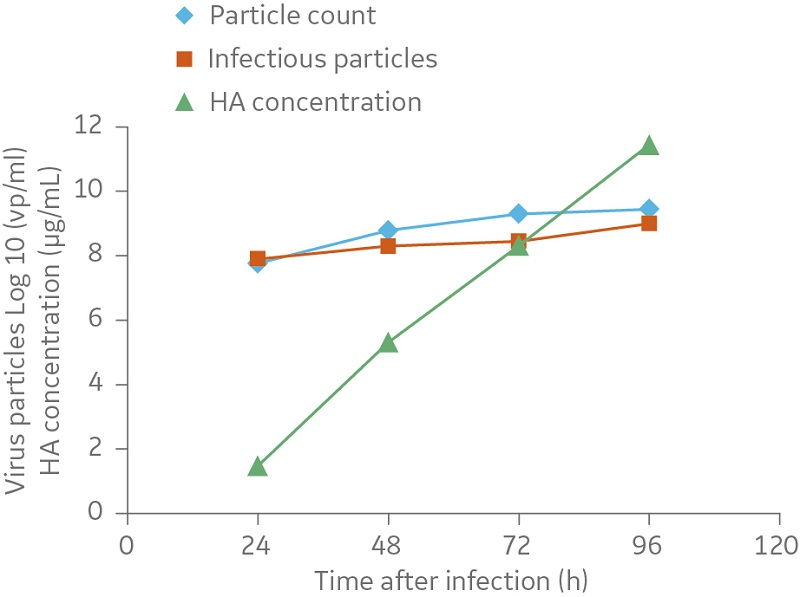
在 50 L 培养物中,细胞生长至约每毫升 2 × 106 个细胞的细胞密度。在指数生长期,细胞被甲型 H1N1/Solomon Island 流感病毒株感染,感染复数为 4 × 10-3,胰蛋白酶浓度为 2 mg/L。在感染阶段每天取样。如图 4 所示,病毒颗粒的感染性和总量最初迅速增加,然后一直保持恒定水平,直到收获时为止,此时确定病毒颗粒的数量约为每毫升 109 个病毒颗粒。
血凝素 (HA) 浓度在整个感染阶段稳定增加,收获时约为 12 μg/mL。在 10 L 培养物中测得的病毒效价和 HA 浓度与 50 L 培养物中相似(图 4)。
有关细胞培养以及病毒感染和收获的更详细描述,请参阅应用说明 29043548 (4)。
下游处理和纯度分析
对于使用标准、非一次性设备进行的下游实验室规模的纯化,使用了从上游处理中收获的约 10 L 病毒。从 50 L(剩余的 6 L 对应于微载体体积)培养物中收获了大约 44 L 病毒,用于 ReadyToProcess 设备在放大的纯化工艺中进行进一步下游处理。
在下游工艺中去除了源自宿主细胞的杂质。在第一个微滤步骤中使用 ULTA Prime GF 2 μm 和 0.6 μm 正常流量过滤器去除细胞碎片,然后使用 ReadyToProcess Capto Q 层析柱去除宿主细胞 DNA。使用 ReadyToProcess Capto Core 700 层析柱除去宿主细胞蛋白。
Capto Core 700 层析填料用于纯化工艺 (6) 的第二个层析步骤。该层析填料具有交联琼脂糖的惰性外层,阻止分子量 (Mr) 大于约 Mr 700,000 的分子进入磁珠芯。磁珠芯包含辛胺配基,可与多种物质结合,包括蛋白、肽和核苷酸片段。层析填料的多模式功能同时利用尺寸排阻和亲和力结合,通过将两种方法合而为一,减少了所需的纯化步骤。辛胺配基的特性允许杂质在宽 pH 范围、高盐浓度和各种缓冲液组合物中结合,从而使 Capto Core 700 层析填料可以在多种条件下使用,而不会损害其功能。因此,可以将先前纯化步骤中的样品直接上样到 Capto Core 700 层析柱上,而无需预先调整缓冲液条件。对于我们的研究,这些好处可以减少所需的缓冲液数量。串行连接 Capto Q 和 Capto Core 700 层析柱的可能性提高了系统利用率,并减少了总处理时间。
在无菌过滤步骤之前,将病毒颗粒浓缩,并使用 ReadyToProcess 中空纤维膜柱 (RTPUFP-500-C-9S) 通过洗滤将其转移到最终缓冲液中。最后,使用 ULTA Pure HC 0.6 μm/0.2 μm 无菌过滤器过滤进行溶液灭菌。
通过使用 Biacore 方法 (7) 测量 HA 浓度来确定病毒含量。通过测定 50% 组织培养物的感染剂量 (TCID50) 来分析感染性颗粒的数量。病毒颗粒的总量通过病毒计 (Virus Counter 2100, ViroCyt, Denver, CO, USA) 确定。通过测量宿主细胞 DNA(定量 PCR)、宿主细胞蛋白(Biacore 方法)和总蛋白(Bradford 方法)来确定纯度。
以 TCID50、HA 收率、宿主细胞基因组 DNA 与 HA 的比例以及总蛋白与 HA 的比例表示的结果如图 5 所示。在整个过程中,病毒的感染力得以保留,如 TCID50 滴度所示。有关下游纯化工艺、病毒计数和纯度分析的更详细描述,请参阅应用说明 29043549 (5)。
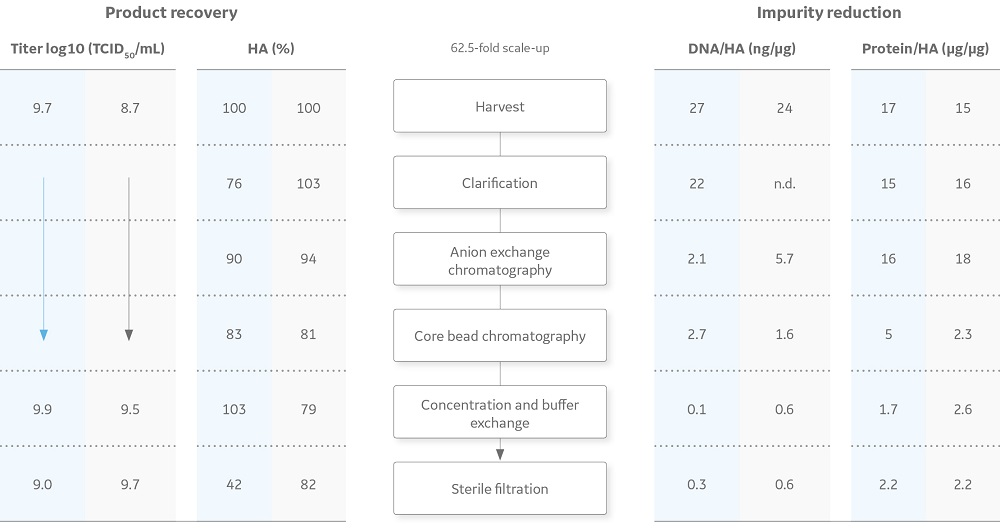
图 5 流感纯化工艺的结果摘要。蓝色值是使用 ReadyToProcess 设备放大生产的数据,灰色值是实验室规模生产的数据。放大生产中下游纯化的总工艺时间为 3 天,由此产生的流感病毒收率和纯度与实验室规模生产中获得的相当。实验室规模生产中澄清后的基因组 DNA 与 HA 比例尚未确定 (n.d.)。
与法规规范的比较
由于当今市场上没有批准的细胞型 LAIV,因此未建立有关杂质的法规要求。因此,将放大生产的产量与鼻腔喷入 LAIV 的商用规范和 WHO 发布的以鸡蛋为基础的裂解灭活流感疫苗规范进行了比较 (8)。表 1 总结了研究结果。
假设采用鼻腔给药途径和每 0.2 mL 剂量 107 个感染性颗粒的剂量条件下,放大生产中的宿主细胞 DNA 量显示低于 WHO 定义的接受水平(每剂 10 ng)。放大生产中每剂量和每株菌株的宿主细胞蛋白量也显示低于 WHO 的接受水平。放大生产的结果表明,有可能获得约每升 3000 剂的收获量,相当于 100 万剂 325 L 收获量(根据鼻腔喷入 LAIV 的规范计算)和每升 175 剂的收获量,相当于 100 万剂 5760 升收获量(根据裂解灭活疫苗的规格计算)。
表 1 单价散装的每升收获剂量放大工艺摘要
| 裂解灭活疫苗* | 鼻腔喷入 LAIV† | |
|---|---|---|
| 放大产量/每升收获量 | 175 剂,每剂 15 μg HA | 3075 剂,每剂 107 TCID50 单位 |
| 产生 106 剂的收获量 | 5760 L | 325 L |
| 蛋白杂质‡ | 30 μg 蛋白/15 g HA | 1.5 μg 蛋白/107 TCID50 单位 |
| DNA 杂质§ | 3.0 ng/15 μg HA | 0.15 ng/7 TCID50 单位 |
†比较是基于鼻腔喷入 LAIV 的商用规范。0.2 mL 剂量包含 107 个荧光聚焦单元,假定等于 TCID50 滴定度。
‡ WHO 蛋白杂质准则:每菌株最高 100 μg 蛋白
§ WHO 关于 DNA 杂质的指南:< 每剂 10 ng DNA = 3.3 ng DNA/15 μg HA。
结论
本文介绍了使用 ReadyToProcess 一次性设备放大生产流感疫苗的方法。许多疫苗生产工艺的规模适合一次性设备,与使用传统不锈钢设备相比,可以提高灵活性并优化设备利用率,从而受益匪浅。一次性设备可实现产品之间快速转换,最大限度地减少了批次之间交叉污染的风险,并减少了清洁和验证操作的需要。这样可以增加每年批生产和多产品制造的数量,从而总体上提高了工艺经济性。
本案例研究表明,一次性设备(包括一次性细胞培养生物反应器、预装填层析柱和过滤器)可以替代传统设备(包括不锈钢生物反应器、自装填层析柱和超速离心机)来生产高纯度疫苗。
本文描述的案例研究不是一个完全优化的工艺。在用于疫苗生产之前,有必要对工艺进行进一步优化。
了解有关我们的疫苗平台的更多信息
参考文献
- 全球流感疫苗行动计划 (GAP)。世界卫生组织,日内瓦。[在线] www.who.int/influenza_vaccines_plan/en/ (2011)。
- Partridgea, J. and Paule Kienyb, M. Global production capacity of seasonal influenza vaccine in 2011. Vaccine 3, 728-731(2013).
- Pietrzykowski, M., Flanagan, W., Pizzi, V., Brown, A., Sinclair, A., and Monge M. An Environmental Life Cycle Assessment Comparing Single-Use and Conventional Process Technology.BioProcess Int 24, 30-38 (2011).
- 应用说明:使用一次性生物工艺设备在 Cytodex 微载体上生长的黏附 Vero 细胞的放大,Cytiva,29043548,Edition AB (2014)。
- 应用说明:使用一次性生物工艺设备进行流感病毒的下游放大纯化,Cytiva,29043549,Edition AC (2014)。
- 应用说明:使用 Capto Core 700 纯化甲型 H1N1 流感病毒,Cytiva,29000334,Edition AB (2012)。
- Nilsson, C.E., Abbas, S., Bennemo, M., Larsson, A., Hämäläinen, M.D., and Frostell- Karlsson, A. A novel assay for influenza virus quantification using surface plasmon resonance.Vaccine 28, 759–766 (2010).
- 关于生产和控制流感疫苗(灭活)的建议。WHO Tech Rep Ser 927:103.(2005).