HyClone VaccineXpress 细胞培养基用于在无动物源性成分 (ADCF) 工艺中增殖流行性感冒病毒和轮状病毒。使用旋转瓶,通过密切监测细胞生长、活力和形态,对小规模微载体培养进行了优化。该结果被用于放大工艺,放大至 ReadyToProcess WAVE 25 生物反应器系统,工作体积为 2 L。数据表明,使用 VaccineXpress 进行轮状病毒增殖的 ADCF 工艺是可放大的,促进了感染性病毒颗粒的生成。
简介
用于活疫苗生产的无动物源性成分 (ADCF) 细胞培养基的需求量正在日益增加。为了满足这一需求,我们开发并验证了 HyClone VaccineXpress 培养基用于病毒疫苗开发,可用于贴壁细胞系高密度生长和维持。这种 VaccineXpress 培养基不含血清和动物源性组分。此外,VaccineXpress 的化学配方提高了可重现性,同时简化了生物工艺应用中重组蛋白和病毒的下游纯化步骤。
为证明 VaccineXpress 培养基适用于可放大的细胞培养应用,我们使用烧瓶对流行性感冒病毒和轮状病毒做了低容量增殖培养。然后将该工艺进行了放大,证明 ReadyToProcess WAVE 25 生物反应器系统的病毒生产效果。
材料和方法
有多种细胞系可用于在细胞培养型系统中生产疫苗,来自非洲绿猴肾细胞的 Vero 细胞 (ATCC™ CCL-81™) 通常用于生物制药行业,并因其适用于生产人类疫苗而被选择用于本研究。
在 WAVE 25 生物反应器系统中使用由 Fortem™ 膜材制成的一次性 Cellbag 生物反应器袋、Cytodex 1 γ 微载体以及 VaccineXpress 细胞培养基进行了病毒生产。Sheffield™ rTrypsin ACF (Kerry, Inc.) 用于激活和增殖轮状病毒。
维持、扩增、采样和计数
解冻 Vero 细胞,在 VaccineXpress 细胞培养基(补充有 4 mM L-谷氨酰胺)中对其进行培养,并移入 T 形烧瓶或 Nunc™ Cell Factory™ 系统 (ThermoFisher Scientific)。培养环境:37°C、5% CO2。为进行维持和扩增培养,在加入用于分离的重组蛋白酶之前,使用磷酸盐缓冲液-乙二胺四乙酸 (Sigma-Aldrich) 洗涤细胞,可使用 TrypLE™ Select (Invitrogen)、Accutase™ (Sigma-Aldrich) 或 Sheffield rTrypsin ACF (Kerry)。在分离的细胞悬液中加入胰蛋白酶抑制剂,细胞以约 5 × 104 个细胞/cm2 的浓度接种。
对于常规培养,Vero 细胞每周在 T 瓶中传代两次,使用 Nunc Cell Factory 系统进行细胞扩增。对于微载体培养,通过每天取样来确定细胞生长、活力以及形态。使用 NucleoCounter™ NC-200™ 细胞计数器 (Chemometec) 确定了细胞浓度和活力。
使用随附相机 (Nikon) 的 Eclipse TS100 倒置显微镜对细胞形态和微载体贴壁生长情况进行了评价。
旋动培养用 Cytodex 1 γ 微载体的制备
Cytodex 1 γ 微载体的最终使用浓度为 3 g/L。使用无菌玻璃或无菌 Falcon™ 离心管(采用 Sigmacote™ 硅胶化试剂 (Sigma-Aldrich) 硅胶化)于 37°C 温度下,将所需量的微载体在完全培养基中水合 2 h。然后将该溶液加入到旋转瓶中,并于细胞接种前在 5% CO2,温度 37°C 的环境中平衡处理 1 h。
生物反应器培养
与 ReadyToProcess CBCU 控制器连接的 ReadyToProcess WAVE 25 生物反应器配备有一次性 Cellbag 生物反应器,其中已充空气 10 L。将所需量的 Cytodex 1 γ 微载体直接转移至一次性生物反应器中,加入完全培养基。将含有 VaccineXpress 细胞培养基和 Cytodex 1 γ 微载体的混合物在 37°C 和 5% CO2 条件下平衡处理至少 2 h。进行 pH 值偏移校准,然后将细胞以 0.4 × 106 个细胞/mL 的浓度接种于 2 L 工作体积中。将培养物的培养条件控制为 pH 值 7.1、37°C,以及 5% CO2。摇摆设定为 100%,由于培养时间短,未使用纯氧。
培养开始时,最初 2 h 内的连续摇摆设置为每分钟摇动 6 次 (rpm),每次摇摆 8° 度,然后升高至每分钟摇摆 10 次 (rpm),每次摇摆 6° 度。接种后 2 小时,采样以确保细胞已开始附着至微载体。此后,在整个培养过程中每隔 24 h 取样一次,以测定细胞密度和形态。取样前将摇速暂时升高至 20 rpm(持续 1 min)以确保溶液均匀。48 或 72 h 后,将 50% 的工作体积更换为新鲜培养基。
当密度达到约 1 (± 0.2) × 106 个细胞/mL 时,细胞被病毒感染。培养条件为 37°C、pH 值 7.2,以及 5% CO2。
病毒增殖
流感病毒
甲型流感/所罗门群岛/3/2006 (H1N1) 用于感染。在感染前,根据病毒毒株特异性感染复数 (MOI) 计算病毒颗粒的数量。从细胞培养物中去除约 50% 的培养基,更换为 Cellbag 生物反应器中的病毒维持培养基(含胰蛋白酶和病毒的 VaccineXpress 细胞培养基),并将培养温度降至 33°C。1 h 后,加入预热的培养基至 2 L 工作体积。在发生细胞病变效应 (CPE) 时收获培养物,并分析组织培养物感染剂量 (TCID50)。
轮状病毒 A
使用来源于轮状病毒阳性患者的轮状病毒 A (ATCC VR-2018) Wa 毒株(组织培养适应株)进行感染。将轮状病毒与 Sheffield rTrypsin ACF (20 µg/mL) 在 37°C 下共同孵育 1 h,以激活病毒。在准备感染时,通过使微载体沉降,在 PBS(磷酸盐缓冲液)中用 Ca2+ 和 Mg2+ 洗涤 Vero 细胞两次。小心地去除培养基,避免任何微载体的意外损失。第二个 PBS(磷酸盐缓冲液)洗涤步骤之后,将活化的轮状病毒添加至旋转瓶/Cellbag 生物反应器中。在感染前,根据病毒毒株特异性 (MOI) 计算病毒颗粒的数量。在连续搅拌/摇摆下,在 37°C 和 5% CO2 条件下感染总培养物体积三分之一的细胞 1 h。病毒感染 Vero 细胞后,通过添加补充有 Sheffield rTrypsin ACF (10 µg/mL) 的 VaccineXpress 细胞培养基稀释接种物,以支持持续的病毒感染。当发生细胞病变效应时收获培养物。将培养物以 -80°C 至 +20°C 的循环冻融 3 次,然后低速离心沉淀(2000 rpm,10 min),目的是从收获的裂解物中去除细胞碎片。将澄清的轮状病毒转移至新的 50 mL 锥形管中,并在 -80°C 温度下储存。对轮状病毒材料进行 ELISA 检测和病灶形成试验,以测定感染性病毒滴度。
分析
TCID50 测定
TCID50 测定是一种感染性方法。结果以滴度(TCID50 单位/mL)表示,其中测量单位达到 50% 时表示存在细胞病变效应。因此,TCID50 是对引发感染能力的测量。简而言之,用 10 倍连续稀释的病毒混悬液感染在 96 孔微孔板中生长的 Vero 细胞。将微孔板孵育 5 d,对具有细胞病变效应的孔进行计数,并根据 Reed 和 Müench (1) 方法计算 TCID50 滴度。
轮状病毒酶联免疫测定 (ELISA)
轮状病毒酶免疫测定是一种定量方法。结果以稀释系数表示,并将该结果与阳性和阴性对照物进行比较。微孔板涂有抗 VP6 的单克隆抗体。该 VP6 基团是一种特异性抗原,存在于所有导致人类患病的轮状病毒中。如果样本中存在轮状病毒,将形成由固相抗体、轮状病毒抗原以及与生物素-链霉亲和素-过氧化物酶复合物结合的抗体组成的夹心复合物。
焦点形成试验
焦点形成试验 (FFA) 是一种感染性方法,使用病毒抗原特异性荧光标记抗体检测被感染的宿主细胞和传染性病毒颗粒。用非洲绿猴肾细胞(MA104 细胞 ATCC 85102918)将轮状病毒连续稀释至 96 孔板中。轮状病毒感染后,用抗轮状病毒抗体和经 FITC 偶联的二级抗体标记 MA104 细胞。使用 IN Cell Analyzer 2200 酶标板,并使用 IN Cell Analyzer 1000 Workstation 软件对被轮状病毒感染的细胞(绿色荧光细胞)进行计数。然后计算每 mL 的荧光焦点形成单位 (FFU) 的滴度。
结果
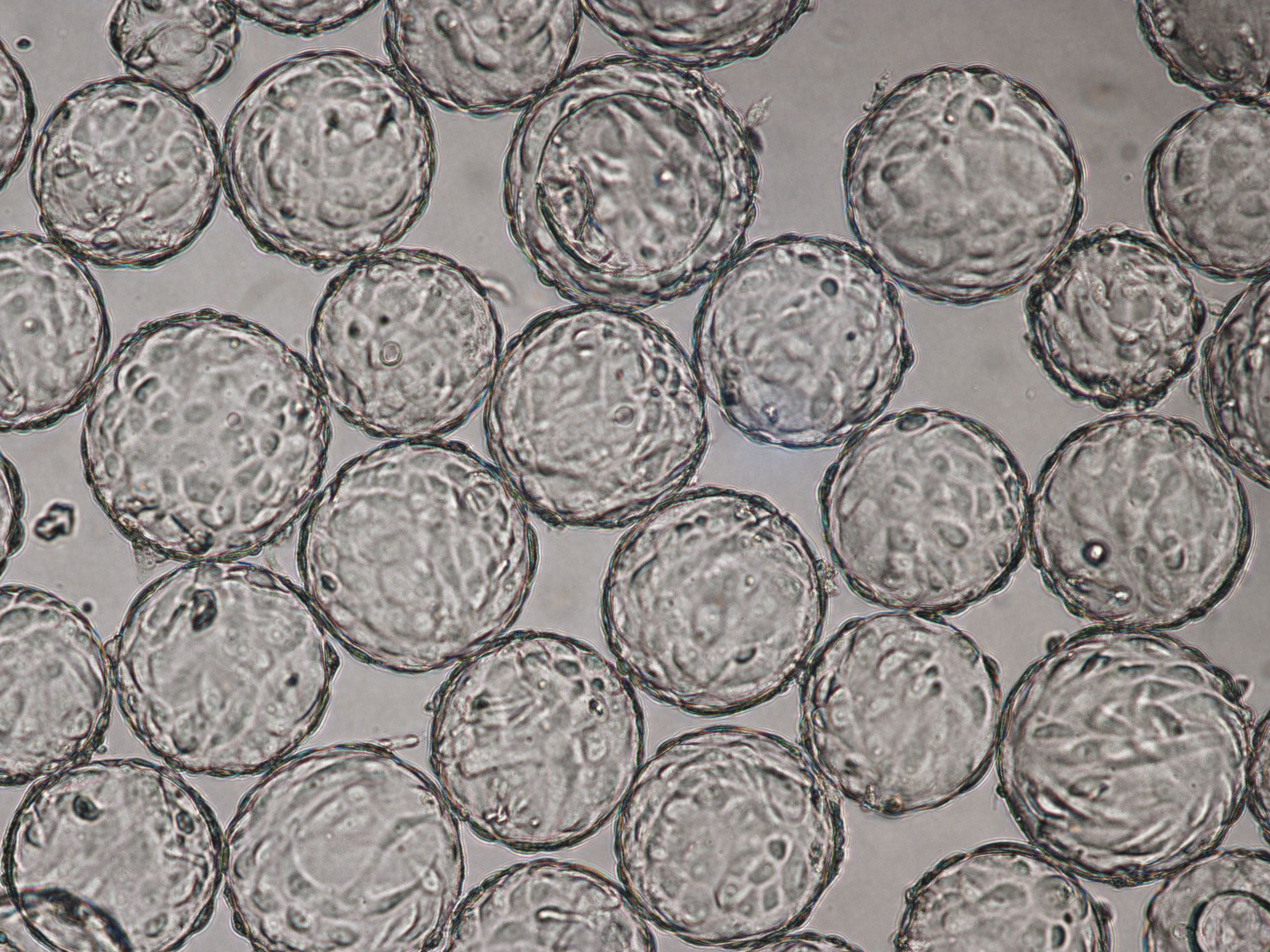
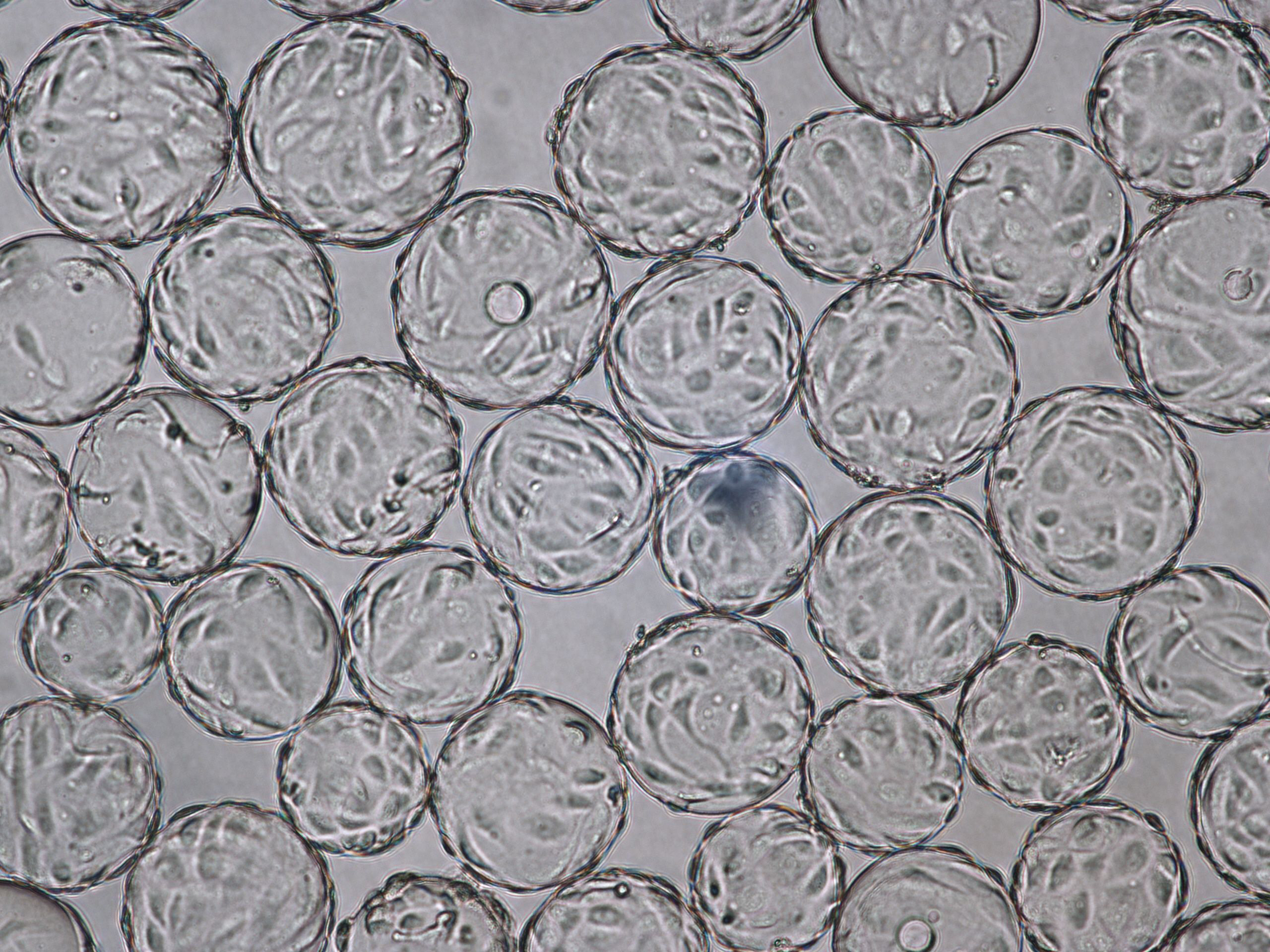
在 VaccineXpress 细胞培养基中 Cytodex 1 γ 微载体上培养的 Vero 细胞在旋转瓶中和在 ReadyToProcess WAVE 25 生物反应器中显示出相似的生长速率和形态。
图 2. 在旋转瓶中使用 VaccineXpress 细胞培养基于 Cytodex 1 γ 微载体上培养的 Vero 细胞的活细胞密度和 WAVE 25 生物反应器中的独立培养物。
流感病毒
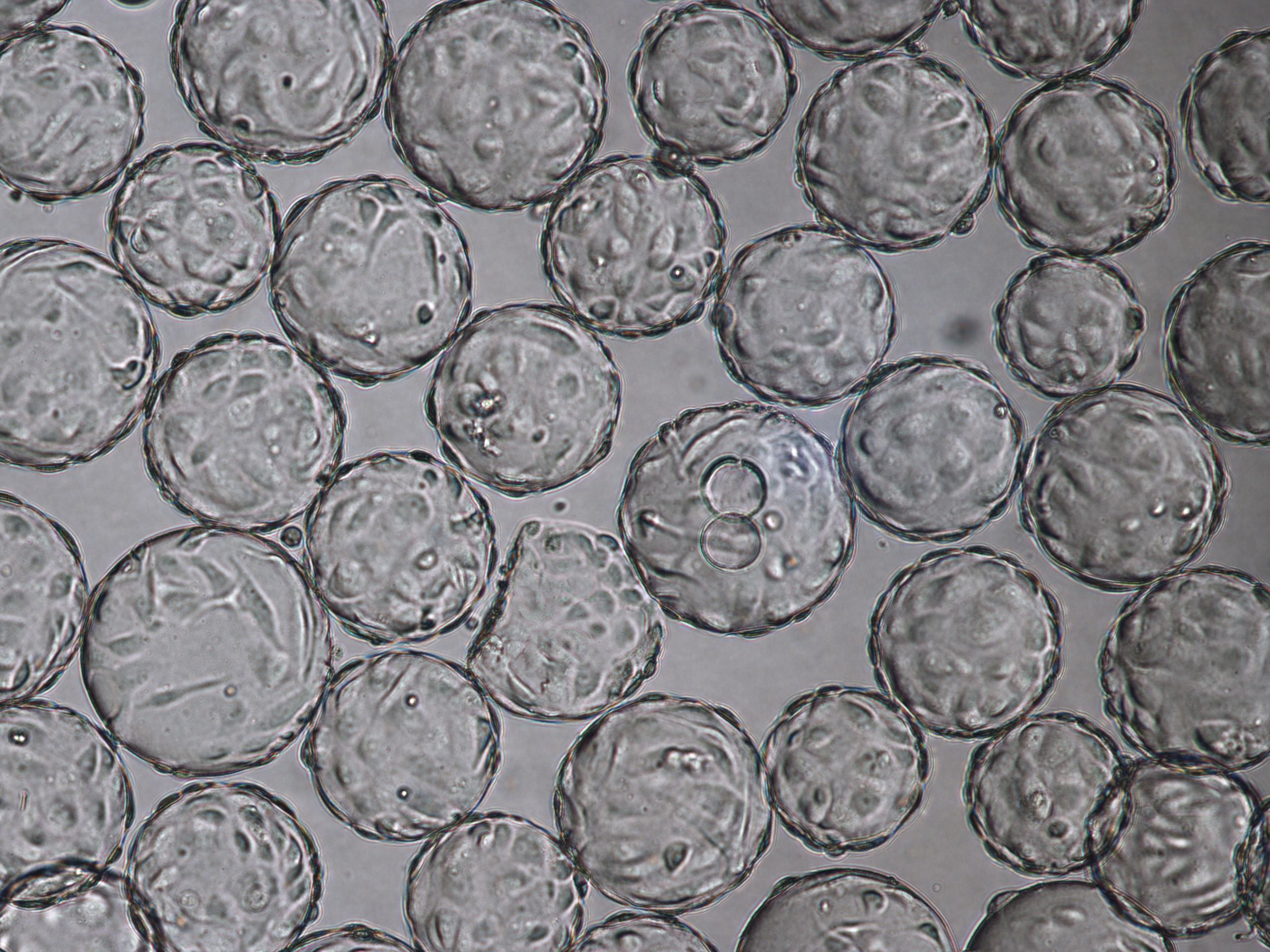
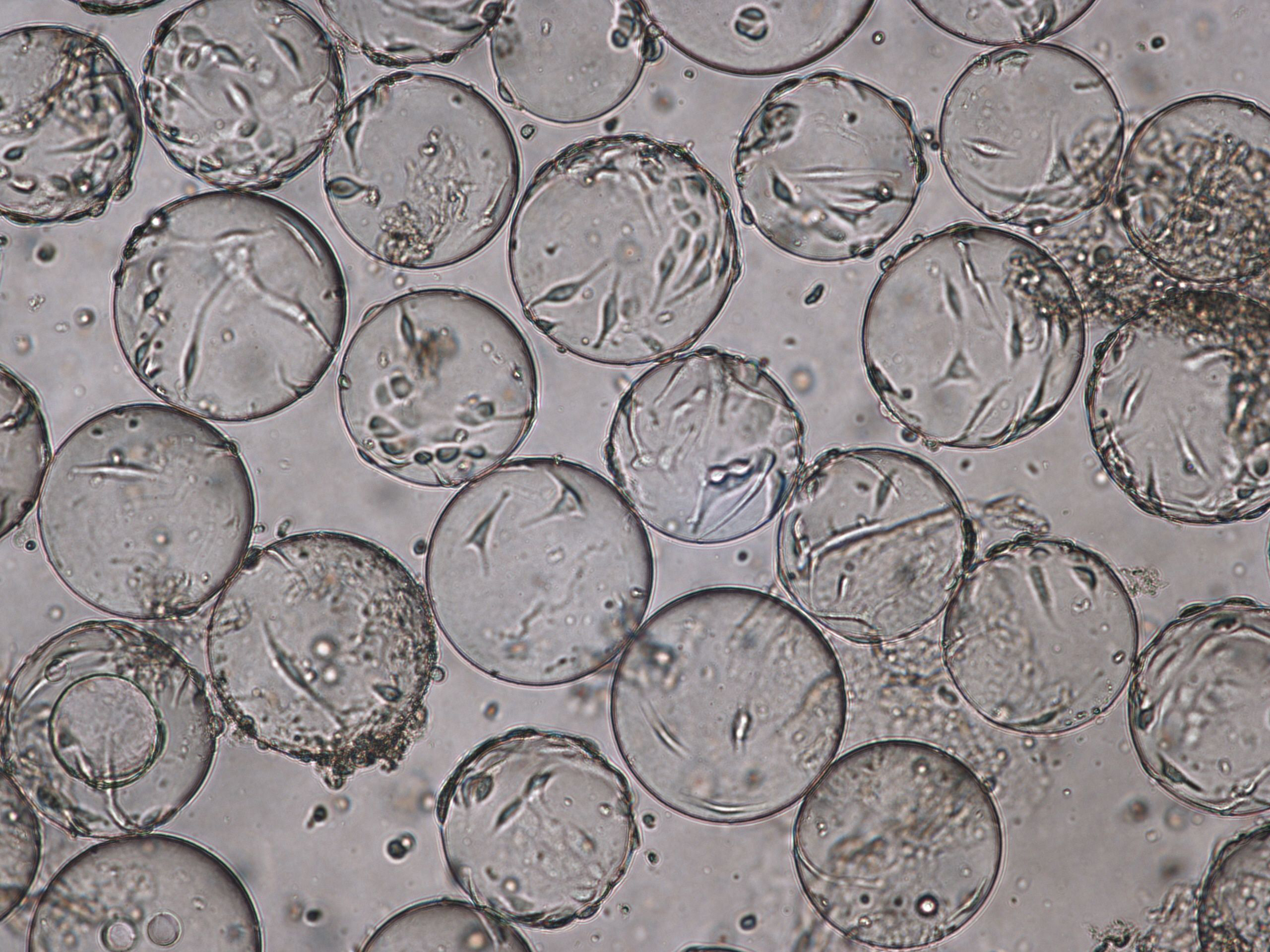
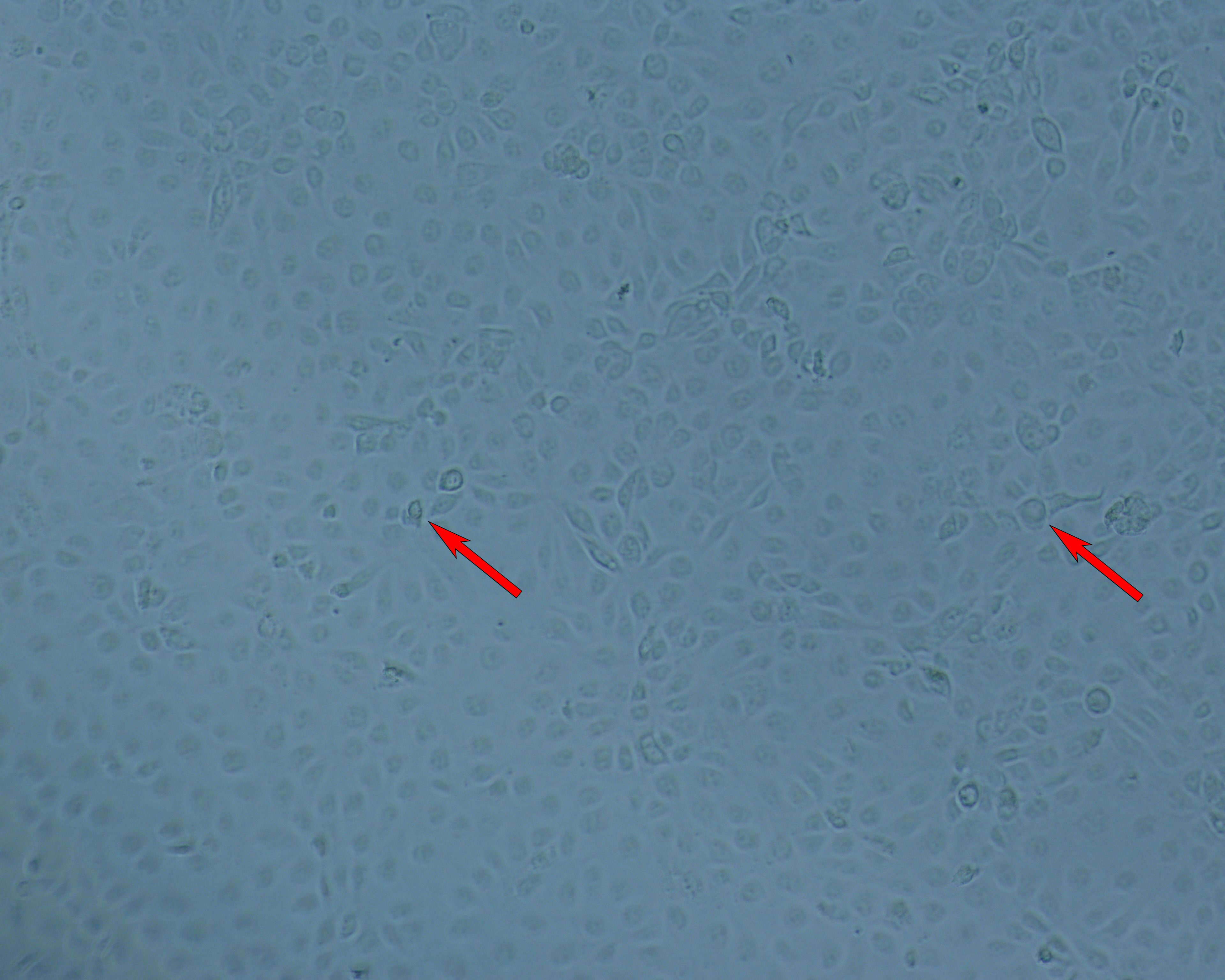
感染时 (TOI),即培养 96 h 后,在 Cytodex 1 γ 微载体上生长的 Vero 细胞的形态(图 3)。收获时流感病毒的细胞病变效应(TOH,感染后 [hpi] 96 小时,图 4)。
流感病毒可在 Cytodex 1 γ 微载体(位于 ReadyToProcess WAVE 25 生物反应器中的 VaccineXpress 培养基中)上的 Vero 细胞中增殖,如两种培养物的 TCID50 分析所示(表 1)。
(A) 在旋转瓶中培养 96 h (TOI) 的 Vero 细胞培养物
(B) 在 ReadyToProcess WAVE 25 生物反应器中培养 96 h (TOI) 的 Vero 细胞培养物。
图 3. 使用 VaccineXpress 细胞培养基,在 (A) 旋转瓶和 (B) WAVE 25 生物反应器中 Cytodex 1 γ 微载体上培养的 Vero 细胞的贴壁能力和形态相当。
图 4. WAVE 25 生物反应器中的流感病毒培养物在收获时 (TOH) (96 hpi) 的细胞病变效应。
表 1. WAVE 25 生物反应器中两个增殖流感病毒独立培养物的 TCID50 分析结果。
| 样品 |
TCID50 |
| 流感 WAVE 25 (1) | 107/mL |
| 流感 WAVE 25 (2) | 107/mL |
轮状病毒
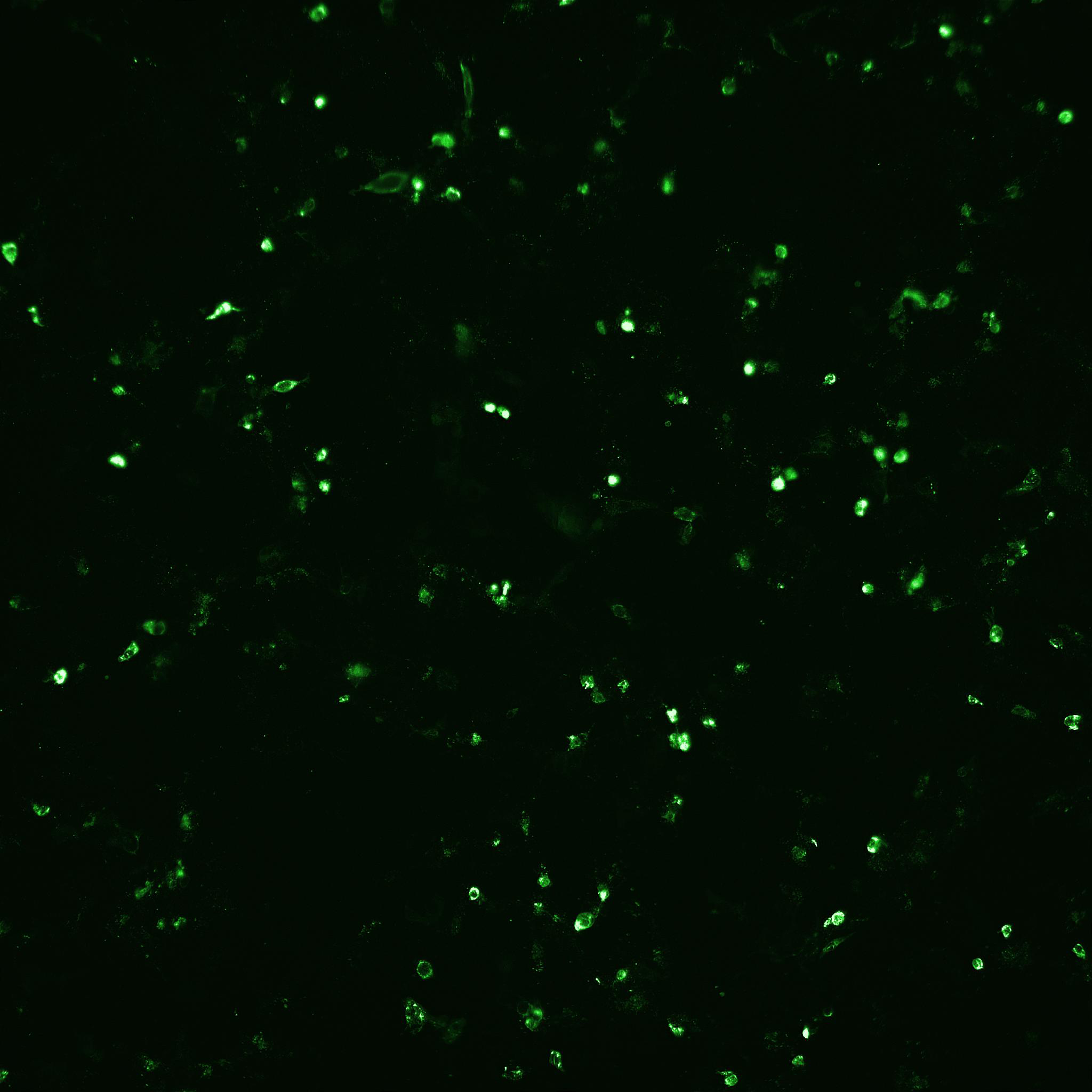
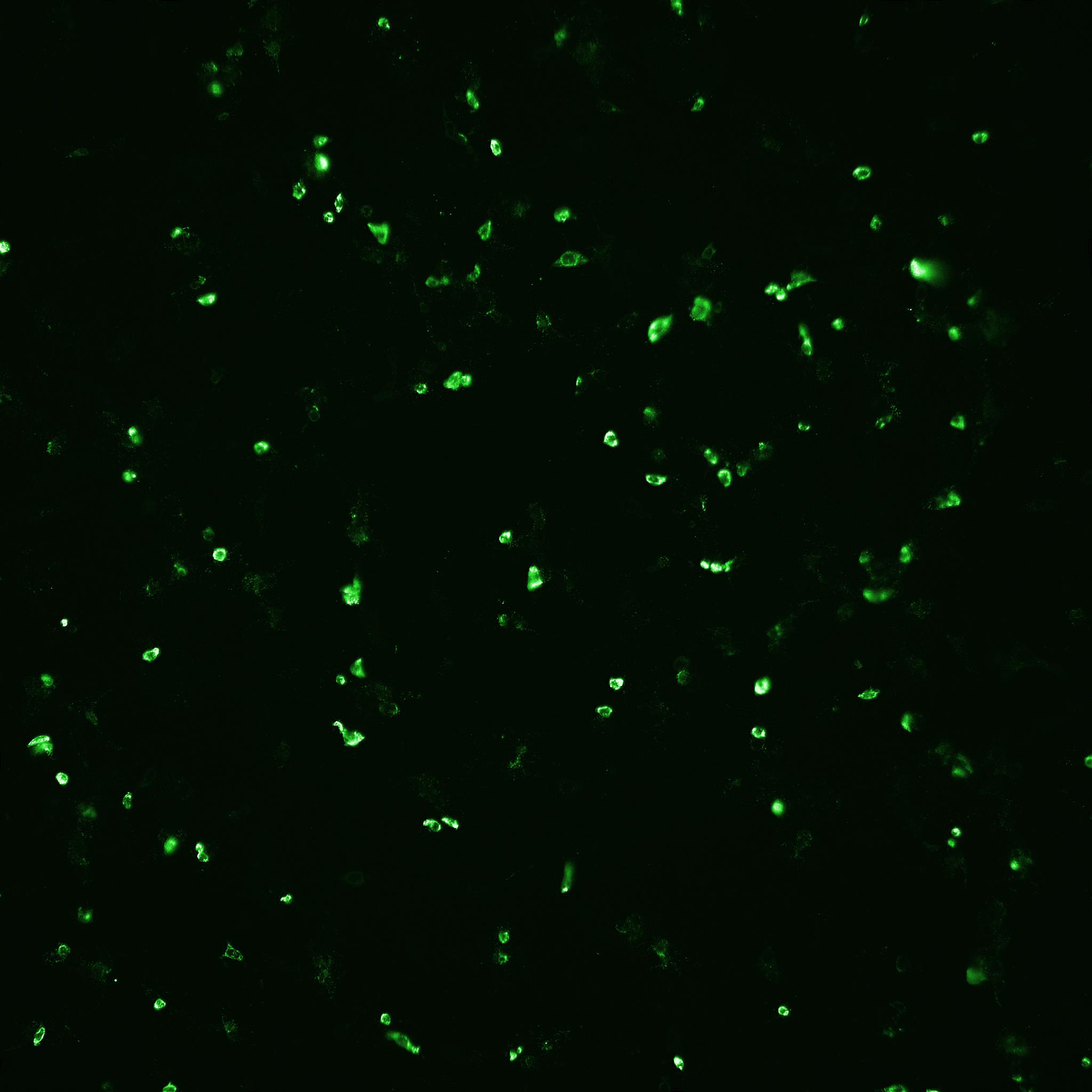
基于在 VaccineXpress 培养基中培养 Vero 细胞和增殖流感病毒所获得的阳性结果,我们有兴趣对 ADCF 工艺中增殖轮状病毒的培养基性能进行评价。在旋转瓶中使用经典猪源性胰蛋白酶和重组胰蛋白酶进行了初始研究。通过 FFA 分析(表 2)和 IN Cell Analyzer(图 5)测定,两种来源的胰蛋白酶均对高轮状病毒感染滴度有促进作用。
表 2. FFA 分析结果显示,使用含猪胰蛋白酶以及 Sheffield rTrypsin ACF 的 VaccineXpress 对高轮状病毒感染滴度有促进作用。
| 胰蛋白酶来源 |
轮状病毒传染性病毒滴度 FFA (mL-1) |
| 猪 | 8 × 105 |
| Sheffield rTrypsin ACF | 5 × 105 |
(A) 猪胰蛋白酶
(B) Sheffield rTrypsin ACF
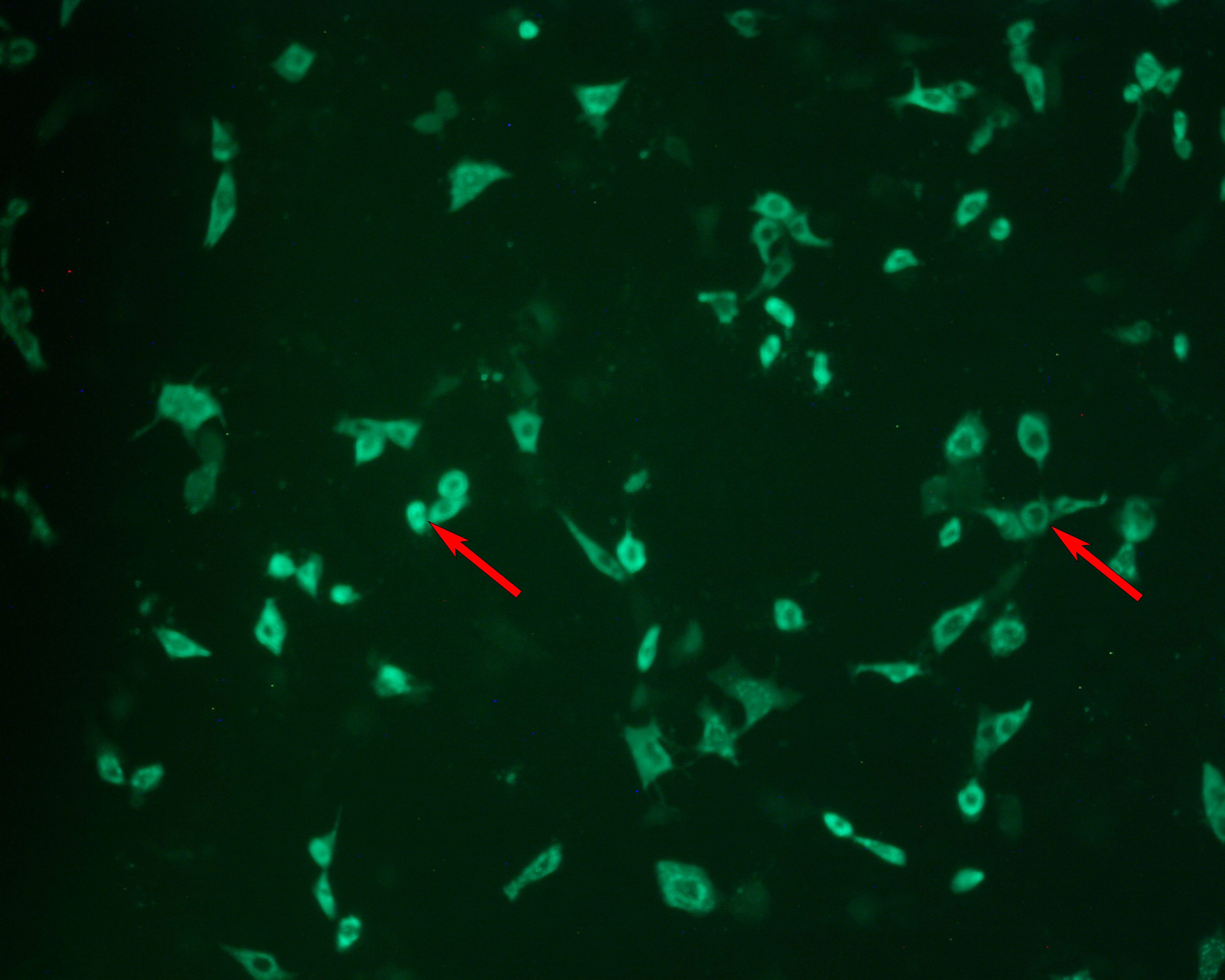
图 5. 使用 IN Cell Analyzer 2200 通过自动荧光显微镜检测轮状病毒感染后(由 (A) 猪胰蛋白酶和 (B) Sheffield rTrypsin ACF 介导)的感染细胞数目和细胞总数。
根据小规模培养获得的阳性结果,我们研究了轮状病毒生产工艺的可放大性。每日监测细胞生长和形态,并显示 TOI 和 TOH 的结果(图 6)。
(A) 96 h 培养 (TOI)
(B) 轮状病毒在 (TOH) (96 hpi) 时的细胞病变效应。
图 6. WAVE 25 生物反应器系统中 Cytodex 1 γ 微载体(使用 VaccineXpress 细胞培养基)上的 Vero 细胞在 (A) TOI 和 (B) TOH 时的细胞贴壁和形态,显示了轮状病毒增殖的细胞病变效应。
使用两种方法测定轮状病毒滴度。使用 ELISA 法测定病毒总数。使用荧光显微镜法测定感染滴度(图 7 和表 3 中的比较)。生物反应器培养物产生的轮状病毒滴度与小规模实验中的相当(比较表 2 和表 3)。
(A) 细胞层;明场。
(B) 细胞层;经 FITC 标记的轮状病毒检测。
图 7. 用于测定轮状病毒感染的焦点形成试验 (FFA)。(A) 在明场显微镜下观察受感染细胞层。(B) 在荧光显微镜下观察到与 (A) 相同的视野。使用抗轮状病毒的 FITC 标记抗体检测感染细胞。箭头表示参考点。
表 3. FFA 和 ELISA 分析结果
| 样品 |
FFU/mL |
ELISA (OD450) |
| 轮状病毒 | 5.1 × 105 | 1.2 |
| 轮状病毒参考样品 | 2.6 × 105 | 1.2 |
结论
在可放大的 ADCF 工艺中,HyClone VaccineXpress 细胞培养基可以促进流行性感冒病毒和轮状病毒的产生。使用 ReadyToProcess WAVE 25 生物反应器(2 L 工作体积)培养得到的结果与使用旋转瓶培养得到的结果相当。流行性感冒病毒生产规模放大得到的结果被用到了轮状病毒的增殖中。VaccineXpress 培养基、Cytodex 1 γ 微载体和重组胰蛋白酶组合形成了一种新型 ADCF 工艺,用于感染性轮状病毒的可放大生产。该工艺有被放大的潜能,可用于轮状病毒 GMP 生产。
参考文献
- Reed, L. J. and Muench, H. A simple method of estimating fifty percent endpoints. Am J Epidemiol 27(3), 493-497 (1938).
| Product name |
Product code |
Pack size |
| VaccineXpress cell culture medium | SH31126.01 | 1000 mL |
| L-Glutamine 200 mM | SH30034.01 | 100 mL |
| ReadyToProcess WAVE 25 Rocker | 28988000 | 1 |
| ReadyToProcess CBCU Controller unit | 29044081 | 1 |
| Cellbag 10 L Bioreactor Container with Fortem Film | CB0010L722-31-05PK | 5/bags |
| Cytodex 1 Gamma | 17548701 | 30 g |
| IN Cell Analyzer 2500 HS imaging system | 29240356 | 1 |