我们使用 TPP® TubeSpin® 生物反应器管和 ReadyToProcess WAVE 25 摇床生物反应器系统为单克隆抗体 (mAb) 灌流工艺开发了可靠的小规模模型。
- 采用 50 mL TubeSpin 细胞培养的小规模模型可优化工艺参数以提高中国仓鼠卵巢 (CHO) 灌流工艺的产量。研究的工艺参数是在不同天数和不同活细胞密度下的 37°C 至 31°C 的温度变化。
- 温度变化不影响产量。然而,与我们的标准灌流工艺相比,在较高活细胞密度下运行可将总产品产量和每日产品产量提高 40%,同时实现相似的体积产率。
- ReadyToProcess WAVE 25 生物反应器在 3 天 (d) 内的体积产率相当,为 0.85 g/L/d。Tube-spin 实验所用参数的成功规模扩大证实了小规模模型的适用性。
简介
工艺强化在大规模生产中得到应用,随之而来的是需要规模缩小模型来准确反映大操作空间的情况。灌流仍然是一种这样的操作模式,它有助于增加生产规模的效益,但同时会增加小规模方法的复杂性。
所述研究的目的是开发 ReadyToProcess WAVE 25 摇床生物反应器和 WAVE Cellbag 50 L 中灌流工艺的可靠小规模模型。目的是使用这一小规模模型筛选可提高灌流工艺产量的工艺参数。基于文献证据所表明的下调温度可能有利于提高不同 CHO 细胞的蛋白生产率这一情况(请参阅参考文献 1),本研究进一步探索了温度和活细胞密度这几项工艺参数。Tube-spin 设置的主要目的是研究从 37°C 至 31°C 的温度变化可能造成哪些影响,以及产生此温度变化的时间是否对细胞培养生产率有影响。
材料和方法
用于温度变化评价的 Tube-spin 实验
研究了在第 2 天和第 3 天(细胞密度约为 2500–3500 万活细胞/毫升 (25-35 MVC/mL))以及第 4 天和第 5 天(细胞密度约为 50–70 MVC/mL)温度变化的影响,这两个时间分别代表细胞培养物生长曲线中的早期和晚期时间点。37°C Tube-spin 批次的细胞培养在第 12 天时终止,而改变温度的 Tube-spin 培养时间延长至第 15 天。
对于 Tube-spin 实验,使用 TPP TubeSpin 生物反应器管 (50 mL) 与粉末形式的 HyClone ActiPro 细胞培养基(根据生产商的建议处理)。在 TubeSpin 生物反应器管中,在湿化摇床培养箱中培养 CHO 细胞。将管固定在摇板上的培养箱内的管架中。Tube-spin 实验的其他条件见表 1。
第 0 天,使用细胞活力分析仪测定摇瓶的细胞浓度和活力。计算在 5.6 mL 配液量中以 10 MVC/mL 的初始接种密度启动 Tube-spin 所需的细胞悬液量。在各温度变化条件下开始 Tube spin 实验,一式两份;对于 37°C 对照条件,一式三份。将所需量的细胞悬液转移至 50 mL 尖底离心管中,然后以 150 × g 对悬液进行 7 分钟的离心旋转。去除上清液(废培养基)。在新鲜 HyClone ActiPro 细胞培养基中重悬所需数量的细胞,并将细胞悬液转移至配液量为 5.6 mL 的管中。向初始培养物中添加 0.6 mL 的额外体积,以补充为分析细胞密度、活力和代谢物而提取的 0.6 mL 采样量。
从第 1 天开始,遵循相同的实验程序,采样体积除外。将 TPP TubeSpin 生物反应器管放回培养箱之前,从中采集 300 µL 细胞培养物样品。使用其中 200 µL 测定细胞密度和活力。
将剩余的细胞团块重悬于新鲜灌流培养基中。须注意,当细胞密度达到 50 MVC/mL 时,以 350 × g 离心旋转 12 分钟。
TPP TubeSpin 生物反应器管置于培养箱中在 37°C 下培养。在第 2、3、4 和 5 天,将两支管从 37°C 条件下移至 31°C 条件下,培养至第 15 天。
表 1 50 mL Tube-spin 实验的 CHO 细胞培养条件
| 参数 | 设置 |
| 培养箱搅拌速率 | 220 rpm |
| 轨道直径 | 50 mm |
| 目标接种细胞浓度 | 10 × 106 个活细胞/mL |
| 温度 | 37°C 和 31°C |
| CO2 培养箱浓度 | 7.5% |
| 目标活力 | > 95% |
| TPP TubeSpin 生物反应器管内等分试样的体积 | 5 mL |
| 培养基 | 第 0 天:Hyclone ActiPro |
| 第 1-15 天:Hyclone ActiPro、Hyclone Cell Boost 1、Hyclone Cell Boost 3 的体积比为 1:0.139:0.158 |
设置 ReadyToProcess WAVE 25 系统
根据表 2 对 ReadyToProcess WAVE 25 系统进行配置。
表 2 所选细胞培养基和添加剂的特征
| 参数 | 设置 |
| 培养配液量 | 10 L(第 0 天)20 L(第 1 天及以后) |
| 溶解氧 (DO) 控制策略 | 接种时:22 rpm,角度 6° 通过自动增加 氧气供应和提高 rpm 进行 DO 控制 设置间隔:22-35 rpm,角度 6° 至 10° |
| 灌流策略 | 当细胞达到约 4 MVC/mL 时开始灌流 维持 20 pL/cells/day 的细胞特定灌流速率 (CSPR) 通过细胞流出维持在 70 MVC/mL 的受控状态 |
| 温度设定点 | 37°C |
| *pH 值设定点 | 第 0 天从 pH 值 7.0 开始,第 2 天降至 pH 值 6.8 |
| DO 设定点 | 40% |
| 启动时气体流速 | 0.50 L/min |
| 目标接种细胞浓度 | 1.25 MVC/mL |
| 目标活细胞浓度 | 70 MVC/mL(受控状态) |
| 目标活力 | > 95% |
| 培养基 | 扩增批次培养基:Hyclone ActiPro 灌流培养基:Hyclone ActiPro,含 2 g/L 泊洛沙姆 188、 13.94% CB1(10% w/v 母液)、 15.80% CB3(5% w/v 母液) |
第 0 天在 10 L 体积中接种 CHO 细胞,使细胞密度达到 1.25 MVC/mL。第 1 天时,体积增加至最终体积 20 L。从第 3 天开始以 4.32 MVC/mL 的细胞密度进行灌流。第 9 天时,细胞培养物达到 72.5 MVC/mL,并开始流出,以使细胞培养物稳定保持在 70 MVC/mL。以 70 MVC/mL 的受控状态维持 3 天,在第 12 天时终止培养。
结果
Tube-spin 实验
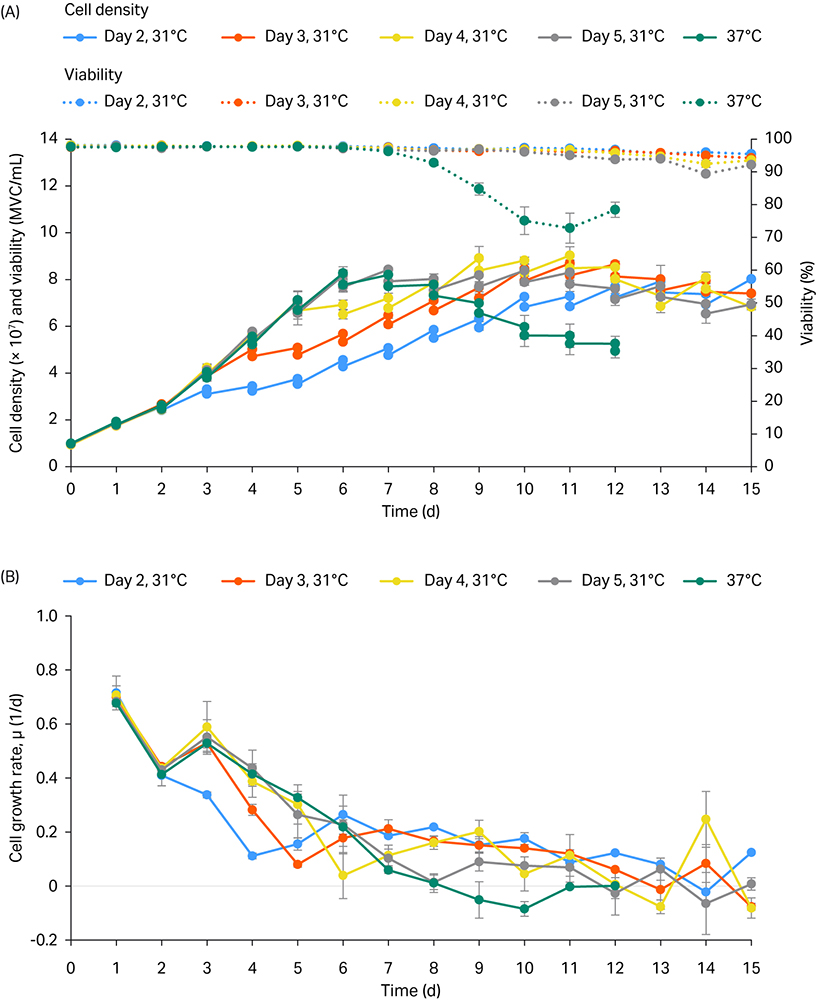
细胞生长和活力曲线见图 1,列出了各条件下一式两份或一式三份管的离心平均值。
至第 15 天时,31°C 温度变化条件下所有的培养物活力均超过 90%(虚线,图 1A),与 37°C 对照温度下的活力相比结果有利,在对照温度下培养物活力于第 7 天后下降。
总体而言,与 37°C 对照温度相比,在第 2、3 和 4 天改变温度后,温度变化第二天时的细胞生长速率有所降低(图 1B)。
图 1. 5 mL Tube-spin 实验的细胞密度和活力曲线 (A) 以及生长速率曲线 (B)。在第 2、3、4 和 5 天时改变温度 (TS),从 37°C 变为 31°C。
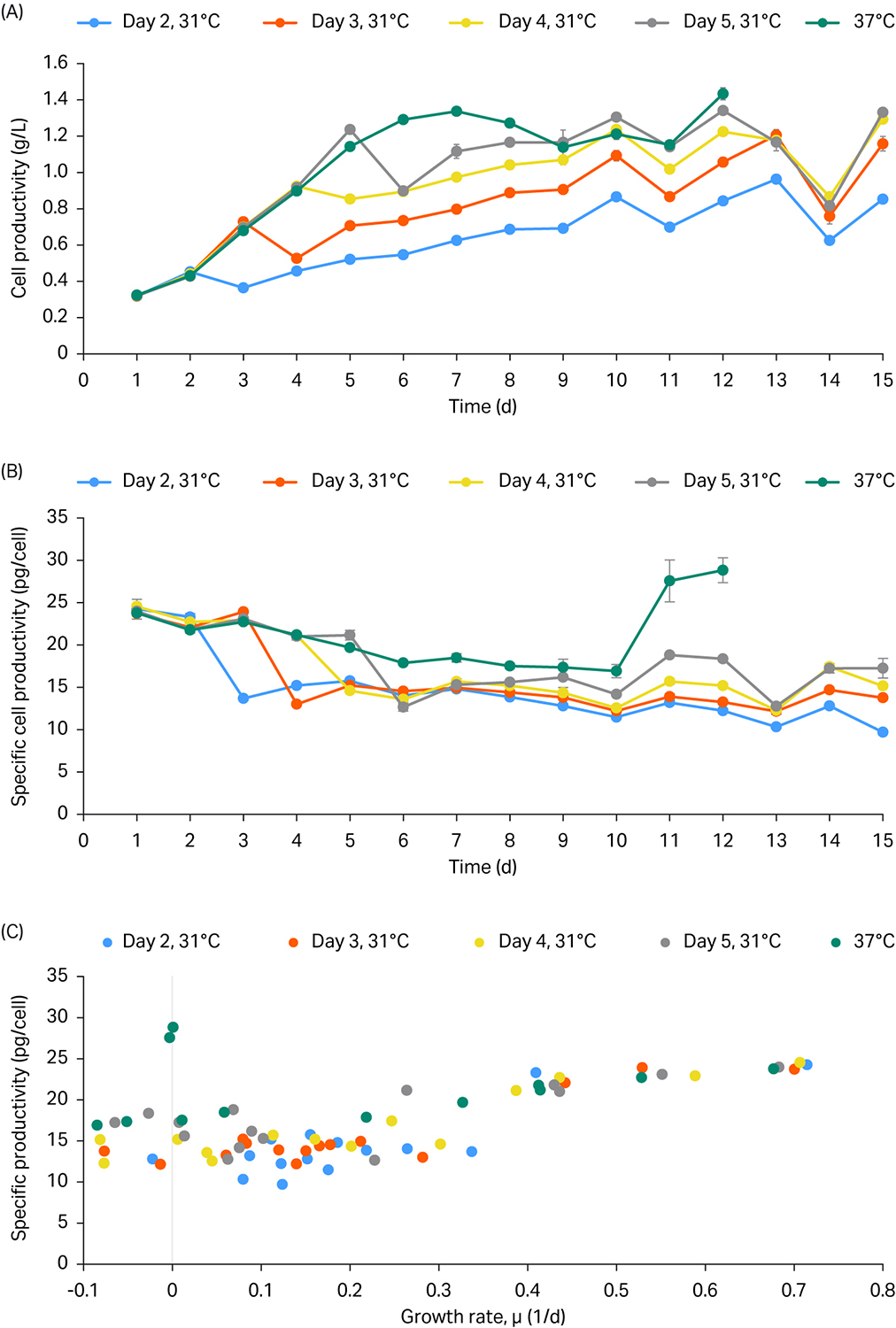
生产率和细胞特定生产率见图 2 中的 A 和 B。总体而言,在 37°C 对照条件下,生产率和细胞特定生产率最高。
与温度变化时间点无关,温度变化第二天时的生产率有所降低。降低后,生产率水平逐天增加。
最后,图 2C 显示当细胞生长速率高于 0.4 至 0.5 (1/d) 时,细胞特定生产率更高。
图 2. 每日生产率 (A)、特定生产率 (B) 和特定生产率与生长速率曲线 (C)。在第 2、3、4 和 5 天时改变温度,从 37°C 变为 31°C。
这些结果表明,与第 2 天和第 3 天的早期温度变化相比,第 4 天和第 5 天的后期温度变化对生产率的提高最为显著。总体而言,温度变化未改善生产率,因此在 37C 下运行 ReadyToProcess WAVE 25 中的灌流培养。
ReadyToProcess WAVE 25 细胞培养
在整个灌流工艺中,细胞活力高于 98%。细胞密度在 70 MVC/mL 下保持 3 天。每次采样后手动调整细胞流出,每天调整两次,第 9–12 天时运行良好。灌流液中未观察到细胞(未显示数据),表明整个灌流工艺中滤器完整。
ReadyToProcess WAVE 25 生产率
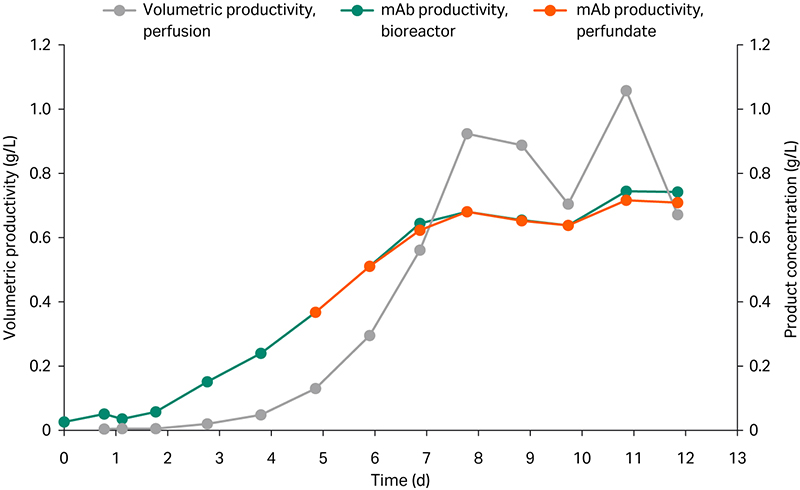
产品滴度随时间增加,在受控状态下达到约 0.7 g/L。生物反应器中与流经滤器后的灌流液之间未见显著滴度差异(图 3),表明产品未因滤器结垢而滞留。
考虑到稀释度,体积产率在一个点达到 1.0 g/L/d 以上,但在 0.7 至 0.9 g/L/d 之间波动,主要是手动流出干预所致(图 3)。
图 3. ReadyToProcess WAVE 25 生物反应器和灌流液中的 mAb 体积产率和产品浓度。
结论
使用 Tube-spin 实验建立了灌流工艺小规模模型。然后放大该工艺,并在 50 L WAVE Cellbag 生物反应器中运行总计 12 天。
- 在 70 MVC/mL 的受控状态条件下采集每日收获样品,3 天的平均体积产率为 0.85 g/L/d。
- 将 Tube-spin 实验放大至 WAVE 25 生物反应器时,我们观察到体积产率相当。这加强了该设置的设计,使其成为在受控状态下进行细胞特定灌流速率和细胞密度灌流工艺开发的合适小规模模型。
- 总之,温度变化不影响产量;另一方面,在较高活细胞密度下操作使总产品产量提高 40%。
| 产品 | ID |
| ReadyToProcess WAVE 25 Rocker | 28988000 |
| HyClone ActiPro powder medium | |
| HyClone Cell Boost 1 powder | SH30584.02, 30584.04 |
| HyClone Cell Boost 3 powder | SH30825.03 |
| WAVE Cellbag 20 L Perfusion Cellbag BioClear 11 film | CB0020L11-34 |
| Wave Cellbag 50 L Perfusion Cellbag BioClear 11 film | CB0050L11-34 |
| ReadyCircuit Disposable Assembly 50 L | 12410228 |
| ReadyCircuit Disposable Assembly 20 L | 12410224 |
| ReadyFilter NFF Capsule Assembly | 12410094 |
| ReadyToProcess Hollow fiber cartridge, 0.65 µm, 950 cm2 | RTPCFP-6-D-4X2MS |
| SciLog pressure sensor | 28979471 |