作为基因克隆常用的载体,随着基因治疗、细胞治疗以及mRNA疫苗的快速发展,质粒DNA的工业化大规模生产需求不断增加。Cytiva推出的三步层析法经众多平台与客户验证,可稳定生产百克至千克规模的质粒DNA。当然,随着新疗法发展的不断加速,以及根据不同应用对产品质量要求的不同,质粒DNA下游工艺开发时,两步法纯化工艺也被很多人期待和选择。
今天,我们将从细菌裂解与澄清、超滤浓缩以及层析纯化等多步骤,带大家沉浸式体验基于复合模式Capto Core 700与亲和层析的质粒两步法纯化工艺。
图1 基于Capto Core700与Capto PlasmidSelect的质粒两步法纯化工艺流程图
细菌裂解与澄清
采用传统碱裂解方式 [1],碱性条件下,大肠杆菌的蛋白质、RNA、宿主DNA和质粒释放至溶液中并变性。加入中和液后,大量变性的蛋白质和宿主DNA通过疏水作用结合在一起,而质粒DNA由于分子量较小可以复性并保持溶解性。需注意在碱裂解过程中应使用新鲜配置的NaOH,并控制裂解反应时间在0.5-10min,裂解时间过长会导致质粒DNA不可逆损伤,另外需采用温和高效的混合方式。
同时,以5g/L浓度在中和后溶液中加入固体NH₄HCO₃,产生的大量气体可以带动絮状沉淀上浮至表面 [2],收获的底部澄清溶液通过囊式滤器进行进一步澄清。
裂解液浓缩
碱裂解后样品体积扩大,在层析纯化前进行浓缩与洗滤,可减小样品体积并去除部分杂质。根据质粒DNA产物大小,按如下标准(表1)进行中空纤维的选择。此次选用Hollow Fiber 300 kDa,对样品进行10倍浓缩,并5倍洗滤至0.4 M NaCl, 10 mM EDTA, 100 mM Tris-HCl , pH 7.5溶液中。
表1 根据质粒大小的中空纤维选择推荐
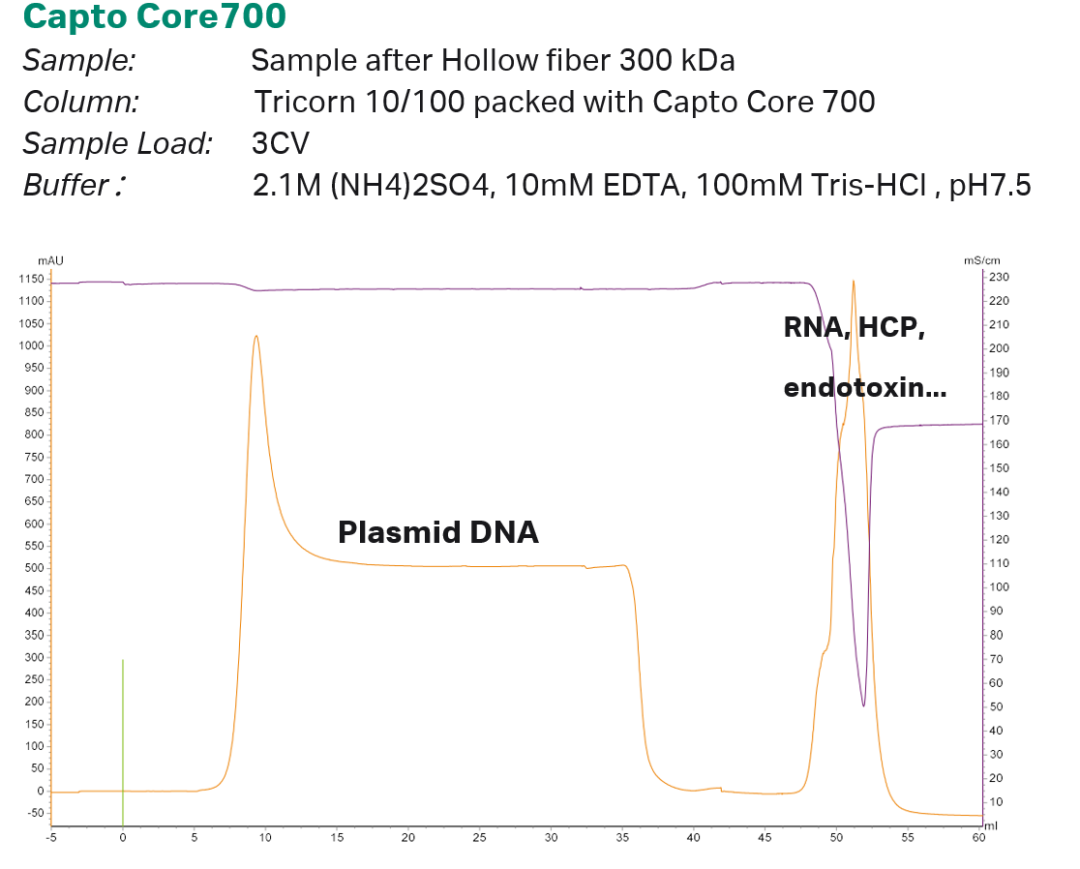
作为一款复合模式填料,Capto Core 700融合了分子筛层析、离子交换层析和疏水层析三种模式。在进行质粒DNA纯化时,由于其分子较大被排阻在填料微球外部,以流穿的模式分离,而RNA、宿主蛋白、宿主核酸及内毒素进入填料微球的内部与辛胺基团结合,达到分离目的。取中空纤维浓缩后的样品,使用3 M (NH4)2SO4与1 M Tris置换调节样品至终浓度为2.1 M (NH4)2SO4,pH为7.5的缓冲液中。上样3 CV并收集流穿,得到与宿主核酸等杂质分离后的质粒DNA样品。
图2 Capto Core 700层析实验参数与层析图谱
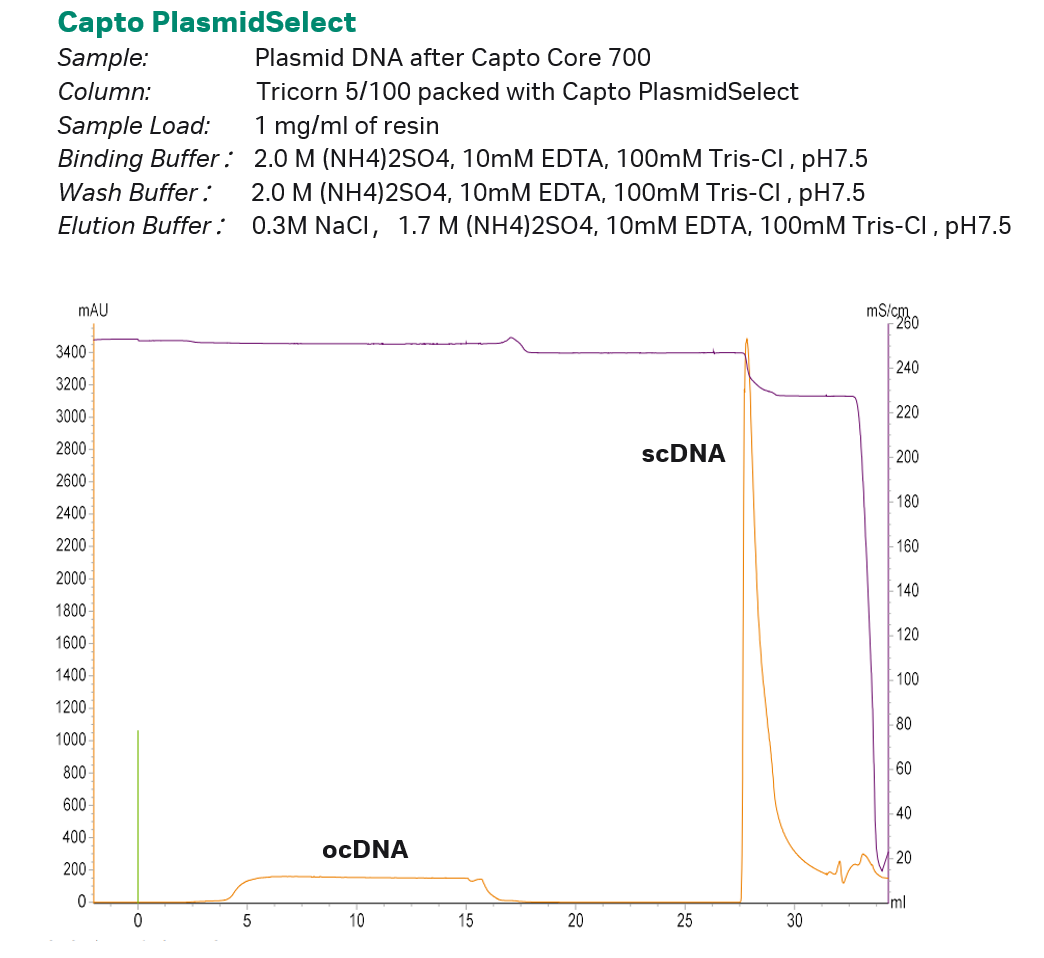
开环质粒ocDNA 与超螺旋质粒构象 scDNA 分子性质高度类似,区别在于后者具有更高的碱基暴露程度和表面电荷。Capto PlasmidSelect通过其嗜硫配基,可高效区别这两种形式的细微差别,成功用于分离制备。将第一步层析得到的质粒DNA样品上样至Capto PlasmidSelect层析柱,上样与冲洗过程中,只有超螺旋质粒牢牢结合在层析柱上,直到用含 1.7 M 硫酸铵和 0.3 M 氯化钠的缓冲液才能将其洗脱。 对于不同大小、不同序列的质粒DNA样品,使用Capto PlasmidSelect纯化的最佳条件略有区别,在工艺开发中可以采用DoE手段,对上样、淋洗和洗脱缓冲液中NaCl与 (NH4)2SO4的浓度,以及上样量进行优化,以得到最佳组合。
图3 Capto PlasmidSelect层析实验参数与层析图谱
中空纤维浓缩换液与样品检测
与裂解液的超滤浓缩一样,推荐使用剪切力低的中空纤维进行浓缩换液步骤以保护质粒DNA超螺旋构象不被破坏。
使用qPCR、HPLC等分析方法对终样品进行检测,检测结果显示经过Capto Core 700与Capto PlasmidSelect两步层析后样品超螺旋比例由90%升至97.5%,另外宿主DNA残留6.3 μg/mg(<10 μg/mg),宿主蛋白含量<0.025%(<0.5%),这表明两步法质粒纯化工艺可以高效得到高质量质粒DNA样品。
小结
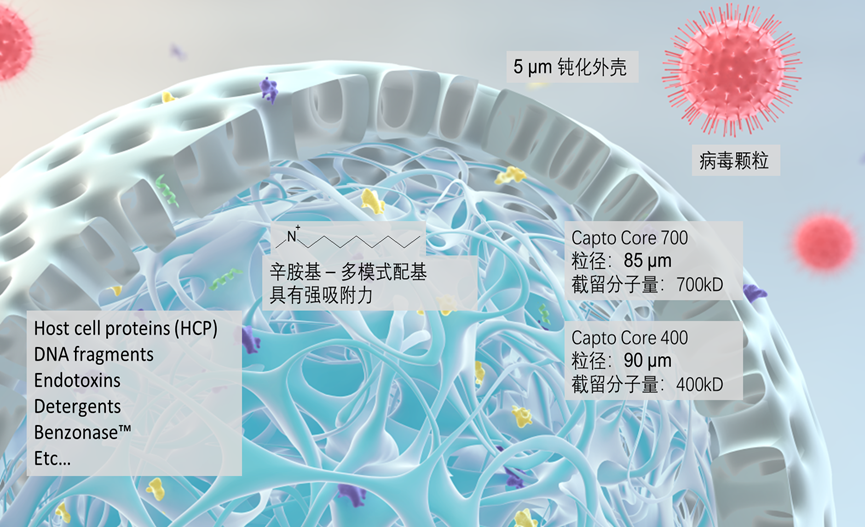
在此次工艺流程中选用由配基活化核心和惰性外壳组成的Capto Core 700复合模式填料,其中惰性外壳不允许大分子通过外壳的孔进入核内,而核内的辛胺基团可以结合进入核内的较小杂质。因此由于其分子排阻作用,较大的质粒DNA分子在微球外部以流穿模式流出,同时RNA、宿主蛋白与核酸等杂质结合在介质上,达到分离目的。如下图所示,与传统的分子筛模式相比,Capto Core 700有着更高的上样量、更快的流速与回收率优势,这也将大大提高质粒纯化工艺的效率。当然,如果我们面临需要同时纯化多种不同长度、不同性质与不同杂质含量的质粒,亦或是样品本身比较复杂或批次间不稳定时,稳健的传统质粒纯化三步法仍然是我们的不二之选。
图4 Capto Core 700结构示意图以及与SEC对比示意图
更多内容,欢迎扫码观看Cytiva学堂课程
课程题目:mRNA Manufacture Solution
课程介绍:
1. mRNA 市场概览和展望
2. 质粒的制备工艺
3. mRNA制备工艺
1. Garde D. The story of mRNA: How a once-dismissed idea became a leading technology in the COVID vaccine race. StatNews. 10 Nov 2020. https://www.statnews.com/2020/11/10/the-story-of-mrna-how-a-once-dismissed-idea-became-a-leading-technology-in-the-covid-vaccine-race/
2. Brandessence Market Research and Consulting Private Limited. mRNA vaccines and therapeutic market size is projected to reach USD 2911.9 million 2026, says Brandessence Market Research. PR Newswire. 5 Apr 2021. https://www.prnewswire.com/in/news-releases/mrna-vaccines-and-therapeutics-market-size-is-projected-to-reach-usd-2911-9-million-2026-says-brandessence-market-research-885706800.html
3. Roots Analysis. mRNA Therapeutics and Vaccines Market, 2020-2030. https://www.rootsanalysis.com/reports/mrna-therapeutics-and-vaccines-market.html. Jan 2021.
4. Centre for Process Innovation. CPI joins national taskforce to develop COVID-19 vaccine. https://www.uk-cpi.com/news/cpi-joins-national-taskforce-to-develop-covid-19-vaccine. 20 Apr 2020.
5. Macdonald GJ. UK government-backed Centre for Process Innovation (CPI) scaling up Imperial’s coronavirus vaccine. Genetic Engineering & Biotechnology News. 9 June 2020. https://www.genengnews.com/topics/bioprocessing/u-k-government-backed-centre-for-process-innovation-cpi-scaling-up-imperials-coronavirus-vaccine/.
6. Ecker DM, Crawford TJ, Seymour P. The therapeutic monoclonal antibody product market. BioProcess International. 30 Oct 2020. https://bioprocessintl.com/business/economics/the-market-for-therapeutic-mab-products/
7. Blakney AK, Ip S, Geall AJ. An update on self-amplifying mRNA vaccine development. Vaccines (Basel). 2021;9(2):97. doi:10.3390/vaccines9020097
8. World Health Organization. WHO Coronavirus (COVID-19) Dashboard. https://covid19.who.int/ Accessed 9 Sept 2021.