通过控速降温实现细胞冷冻
成功的细胞冷冻保存需要受控的降温速率。降温太快或太慢都可能导致结果不良。
考虑到细胞在冷冻保存过程中所经历的物理环境,需要确保降温速率受控。当细胞外环境结冰时,纯水会因形成冰,以固态形式纯在。这样,细胞所在的悬浮液中浓度会逐渐升高,这种溶液会使细胞脱水。但是,降温太慢会使溶液对细胞产生毒性。而降温太快会阻碍细胞充分脱水,导致细胞内结冰。
使用 VIA Freeze 控速降温仪(图 1)等设备可实现控速降温。
图 1. VIA Freeze 控速降温仪。
在这方面,需要了解在哪种温度下可以安全地结束受控降温并将细胞转移至长期储存(通常为液氮储存)条件下。这是一个重要的方案参数。令人惊讶的是,很少有研究确定可将细胞转移至储存条件的降温终点。实际采用的终点温度从 -35°C 到 -130°C 不等。
本研究探索了受控降温阶段终点的临界温度。确定了这个参数值,便能最大程度地减少使用控速降温仪冻存样本所需的时间。通过减少每次降温运行的时间,就有可能增加每天的运行次数。
降温终点研究的设计
为了确定受控降温终点温度的生物学意义,将冻存管(填充量为 1 mL)中的细胞样本以 1°C/min 的速率在 VIA Freeze 系统 (Cytiva) 中降温,温度范围为 4°C 至 -100°C(图 2)。
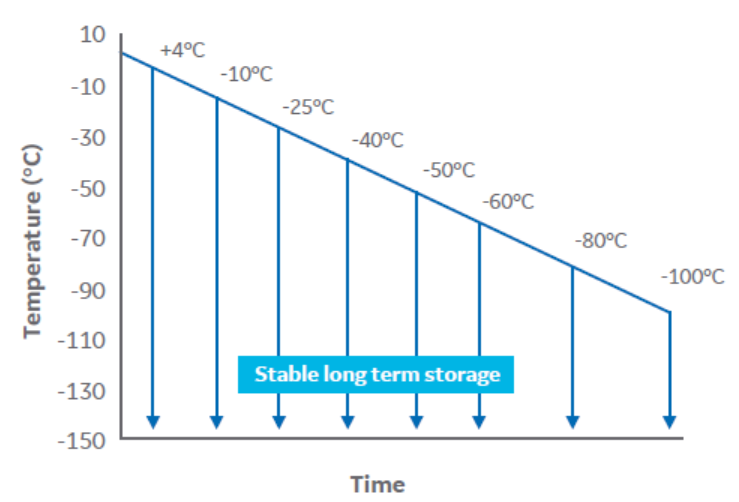
图 2. 实验设计示意图。
在每个选定的温度下,将 5 组样本放入液氮中。将冻存管在低于 -140°C 的温度下保存至少 24 小时,然后解冻。
评估使用的是 Jurkat 细胞(人悬浮培养免疫细胞)和中国仓鼠卵巢上皮 (CHO) 细胞。使用二甲基亚砜(DMSO,10%)作为冷冻保护剂。解冻后,在标准条件下,让每个终点的细胞在细胞培养基中生长。在生长 24、48 和 72 小时后分别测定活细胞计数。使用 Cytell 细胞成像系统 (Cytiva) 进行分析。
结果
根据图 3 可知,-40°C 左右或更低的温度足以满足 CHO 细胞的冷冻保存要求。Jurkat 细胞组的结果与此相似(图 3),临界温度为 -40°C 到 -50°C。HepG2 和 MG-63 细胞系组的结果与此相同(出于篇幅考虑,数据未显示)。
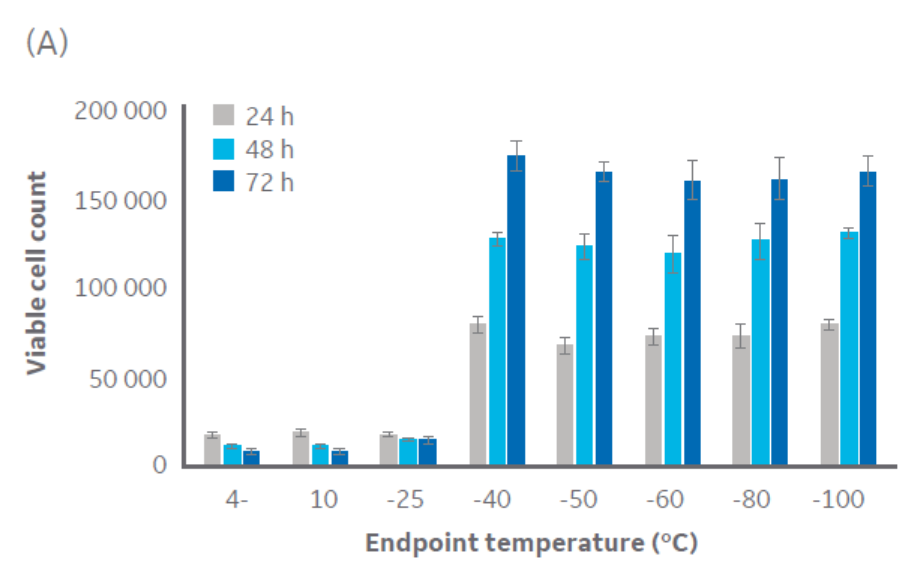
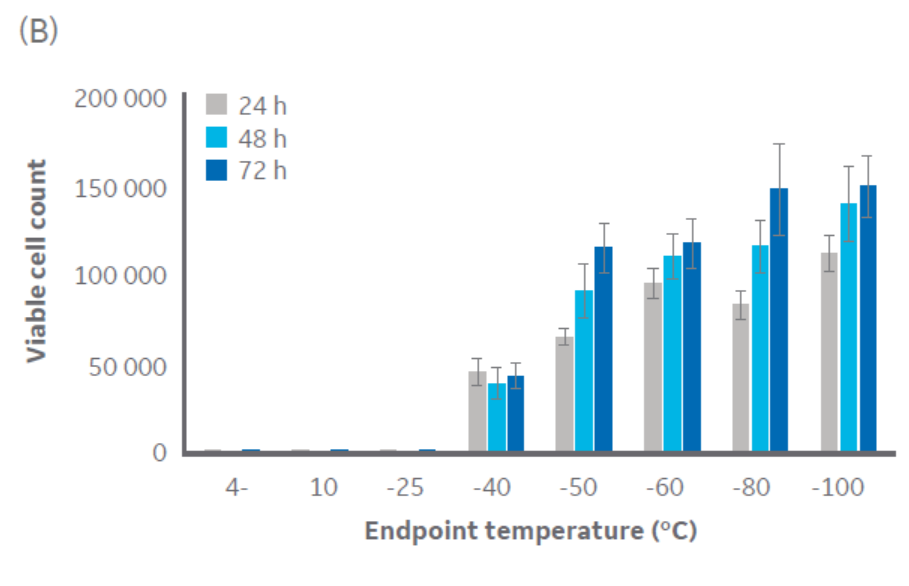
图 3. 控速降温终点不同的 (A) CHO 细胞和 (B) Jurkat 细胞在解冻后 24、48 和 72 小时的活细胞计数,n = 5 ± SD。
结论
本研究表明,线性降温的关键温度为 -40°C 到 -50°C,进一步降温并无更多优势。从物理学角度看,这一结果可归因于 -47°C 时的细胞内胶体玻璃化转变。在这一温度下,细胞内功能区隔固化,细胞无法发生渗透反应。此外,也没有游离水在细胞内结冰。这样便消除了冷冻保存诱导细胞死亡的关键因素。
选择更高终点温度的优势
举例来说,与降温至 -100°C 相比,可以选择更高的终点温度。这意味着细胞冻存时程序降温的时长可以缩短,从而实现每天运行多个冻存批次。建议使用类似 -60°C 或更低一些的温度,以保留足够的安全冗余,避免样本在向长期储存装置转移的过程中受热。
由于 VIA Freeze 系统能够达到的最大降温速率因温度而异,因此对比于 -80°C 或 -100°C,选择 -60°C 作为终点可以增加可处理样本量。