摘要
T 细胞免疫疗法的治疗潜力令人振奋。尽管嵌合抗原受体 (CAR) T 细胞在临床上已经取得成功,但若要将这些产品做为常规替代治疗方法,仍存在一些挑战。这些挑战包括成本高昂的生产工艺,它需要漫长而复杂的开放式工作流程,且手动操作需求高,同时造成产品产生差异性。
本文详细介绍稳健的 CAR T 细胞生产工作流程。该流程符合 CAR T 细胞商业化生产中现行药品生产质量管理规范 (cGMP) 的要求。这种半自动化封闭式 CAR T 工艺可获得 1 × 1010 个扩增的 T 细胞。在 8 天的生产过程中,增强型绿色荧光蛋白 (eGFP) 的转导效率大于 80%。
简介
仅 2019 年,就预计美国将诊断出 170 万新癌症病例,将有约 60 万美国人死于癌症 (1)。尽管药物联合化疗仍是标准疗法,但是越来越多的成年人和儿童接受常规治疗后无法取得良好的效果,这一情况激发了探索“下一代”癌症治疗方法的积极性。
与常规化疗不同,目前正在开发阶段的新方法,基于对免疫肿瘤学的更深入理解。在这些方法中,过继性 T 细胞治疗产品因其治疗潜力而备受关注。诺华公司 (Kymriah™) 和 Gilead/Kite (Yescarta™) (2) 的自体 CAR T 细胞疗法已通过审批,突出说明了使这些治疗方法适用于患者的前景和面临的挑战。
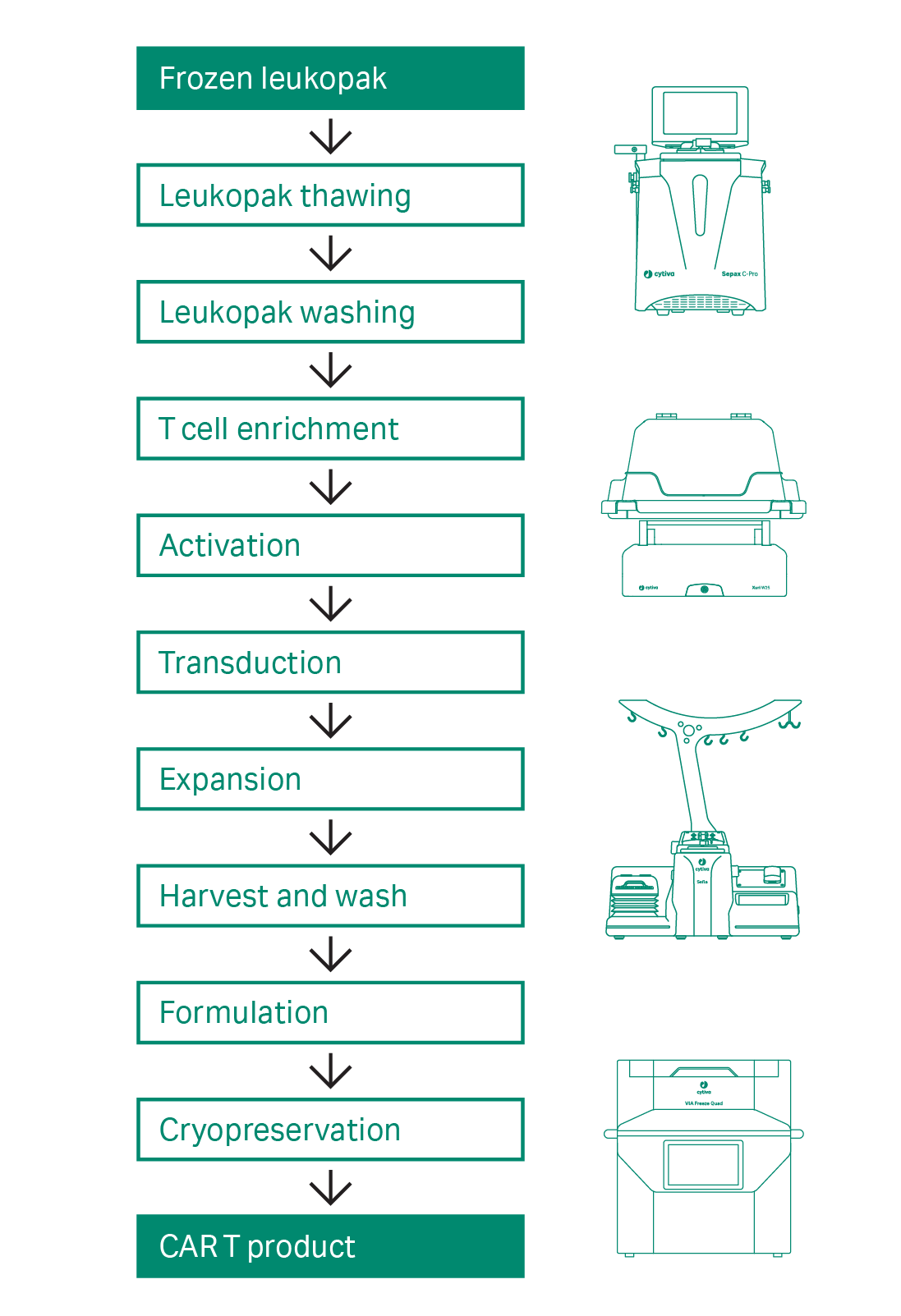
目前,业界越来越需要端到端的工作流解决方案来支持 CAR T 细胞疗法的工业生产的横向和纵向规模扩展。为了应对这些挑战,我们研究了各个 CAR T 单元的操作,以发展商业化的试剂和模块化的设备,来推动工艺的闭合和自动化,从而提高工作流程效率和产品一致性。CAR T 的工作流程如图 1 所示。
图 1. 半自动封闭式 CAR T 细胞生产工艺的工作流程。流程开始和结束时的细胞材料用灰色背景突出显示。单元操作以白色背景显示。
我们评估了市售 T 细胞富集和活化试剂、可选用的封闭式小型培养容器、增强转导的替代解决方案以及工艺步骤的特定时间。这样做的目的是开发一种模块化平台流程,确保该流程既稳健又灵活,可满足 CAR T 开发人员的各种需求。
结果和讨论
解冻和洗涤方法的比较
可以使用开放式手动方法解冻和洗涤白细胞采集物中的细胞。但是,这些方法不符合不断发展的 GMP 要求,并且可能会带来与操作员操作差异和污染相关的风险。作为替代方案,可以使用一种封闭式自动化方法来解冻和洗涤细胞。这种方法可以降低手动操作需求和产品差异性。
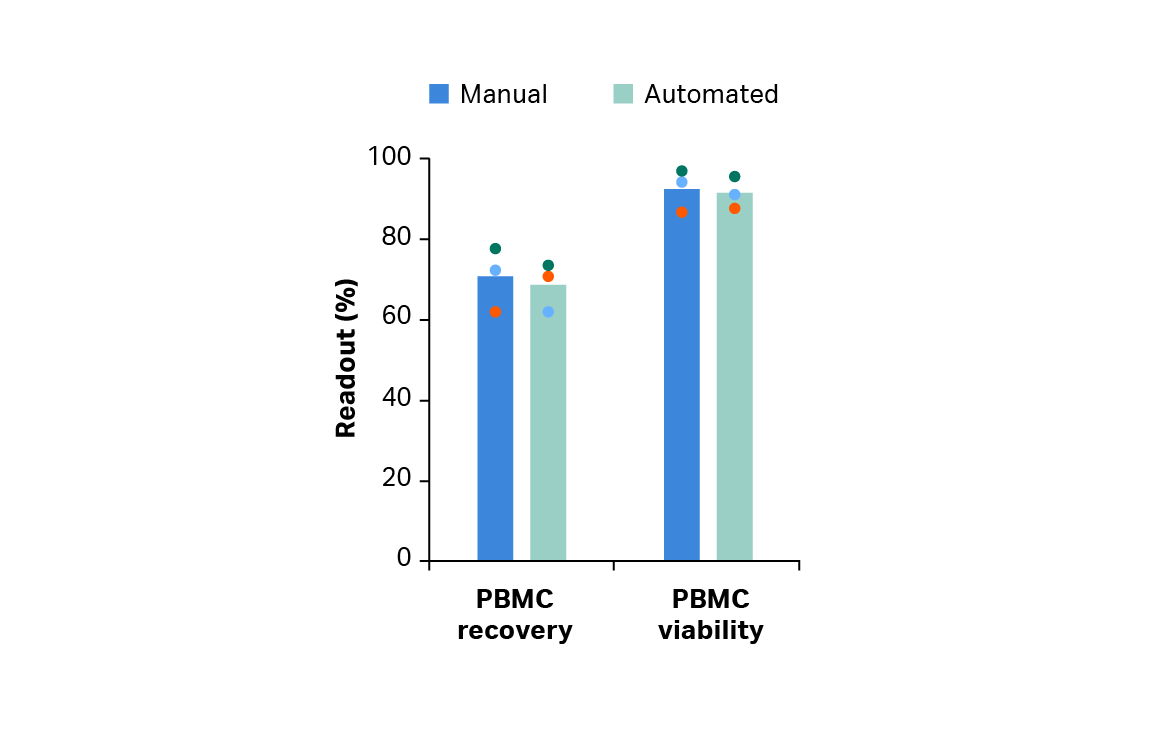
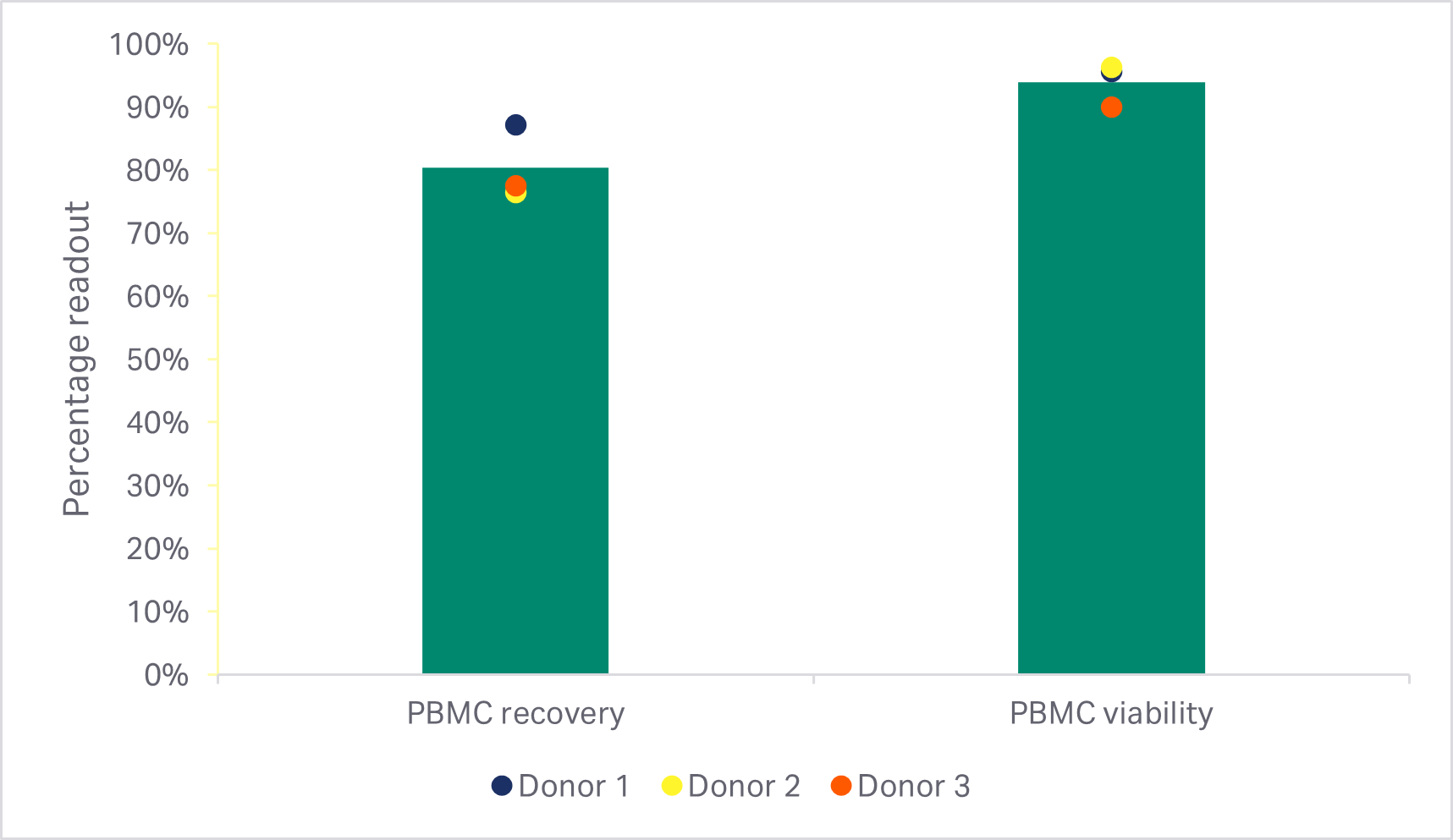
使用 Smart-Max AS-310 配套的 Thaw-Large Volume 程序软件*‡结合 Sepax 2 配套的 SmartWash 程序软件†进行冷冻白细胞采集物的解冻和洗涤,细胞回收率和活力结果可与手动方法媲美(双样本 t 检验 p ≥ 0.05,n = 3)(图 2A)。自动化方法也能取得与此相当的 T 细胞回收率、纯度和活力(双样本 t 检验 p ≥ 0.05,n = 3)(图 2B)。
*对于上游解冻,我们使用了与 Smart-Max 仪器配套的 Thaw-Large Volume 程序软件。也可以选择使用 VIA Thaw 解冻仪进行上游和下游加工。
†本研究使用 Sepax 2 细胞分离设备。但是,建议在生产时使用效果与此等效的 Sepax C-Pro 设备。
‡即将推出。关于产品的发布,不作任何保证(Cytiva 保留更改任何产品发布计划和时间的权利)。
(A)
(B)
图 2. 手动和自动解冻和洗涤后的回收率和活力。(A) 手动或自动解冻和洗涤后立即测得的存活外周血单核细胞 (PBMC) 的回收率和活力;(B) EasySep Release 人 CD3 正选后富集 T 细胞的回收率、纯度和活力。条形表示同组三份生物样本的平均值,彩色圆点表示各供体值。
T 细胞富集方法的比较
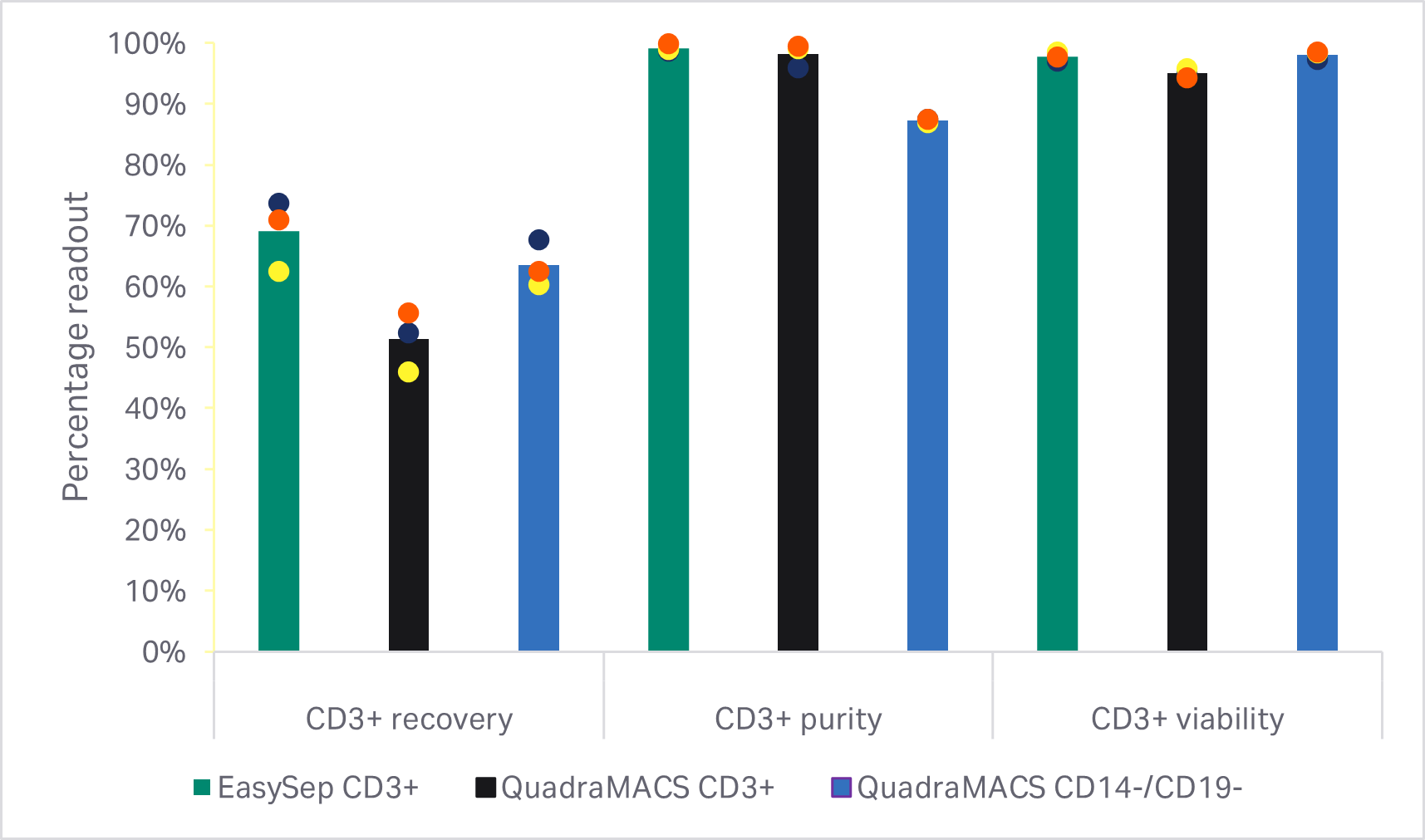
有几种市售方法可用于富集 T 细胞群体。两种常见的系统是 CD3+ 阳选和 CD14+/CD19+ 阴选。为了确定富集 T 细胞的最佳方案,我们评估了两种 CD3+ 阳选法和一种 CD14+/CD19+ 阴选法。
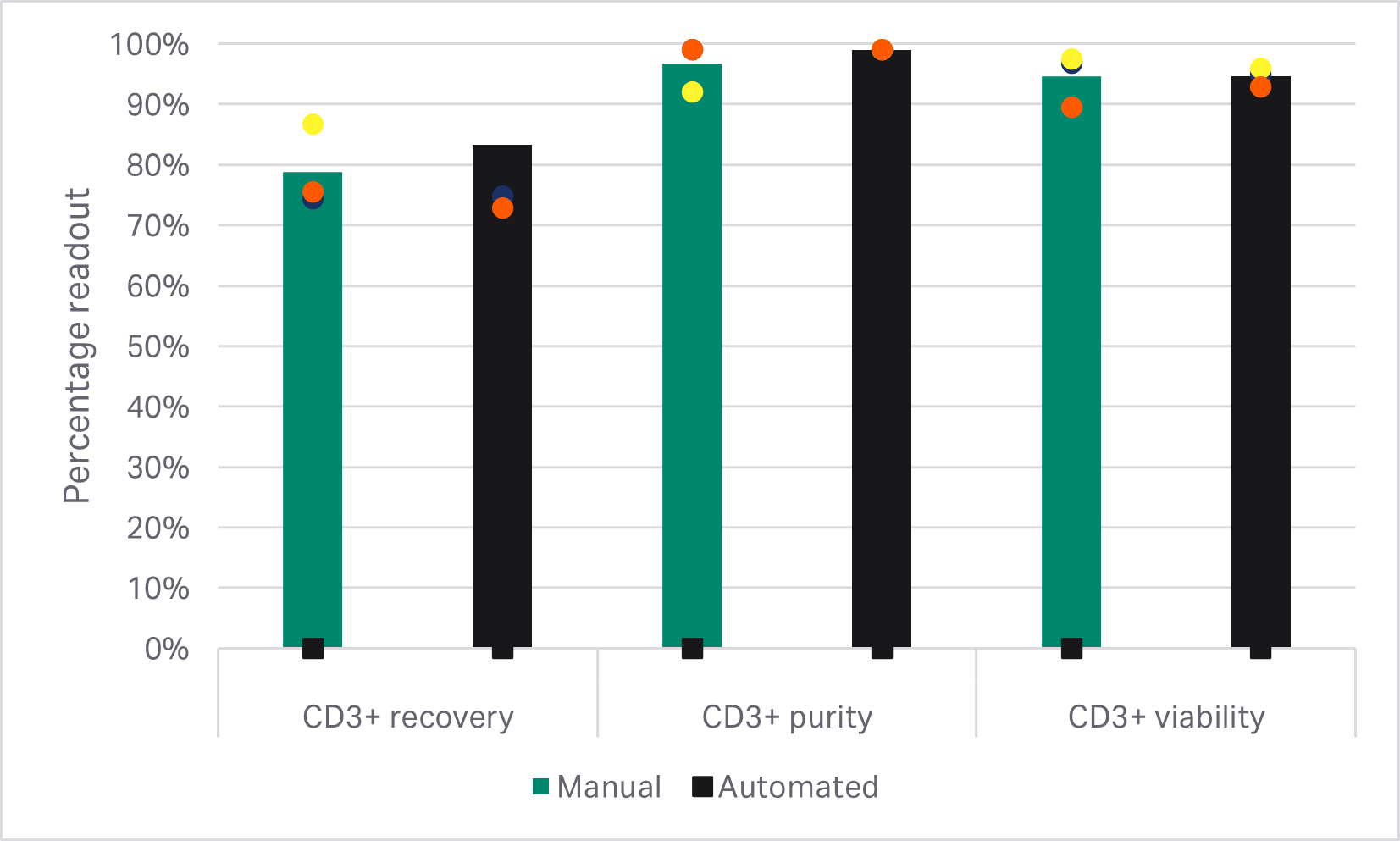
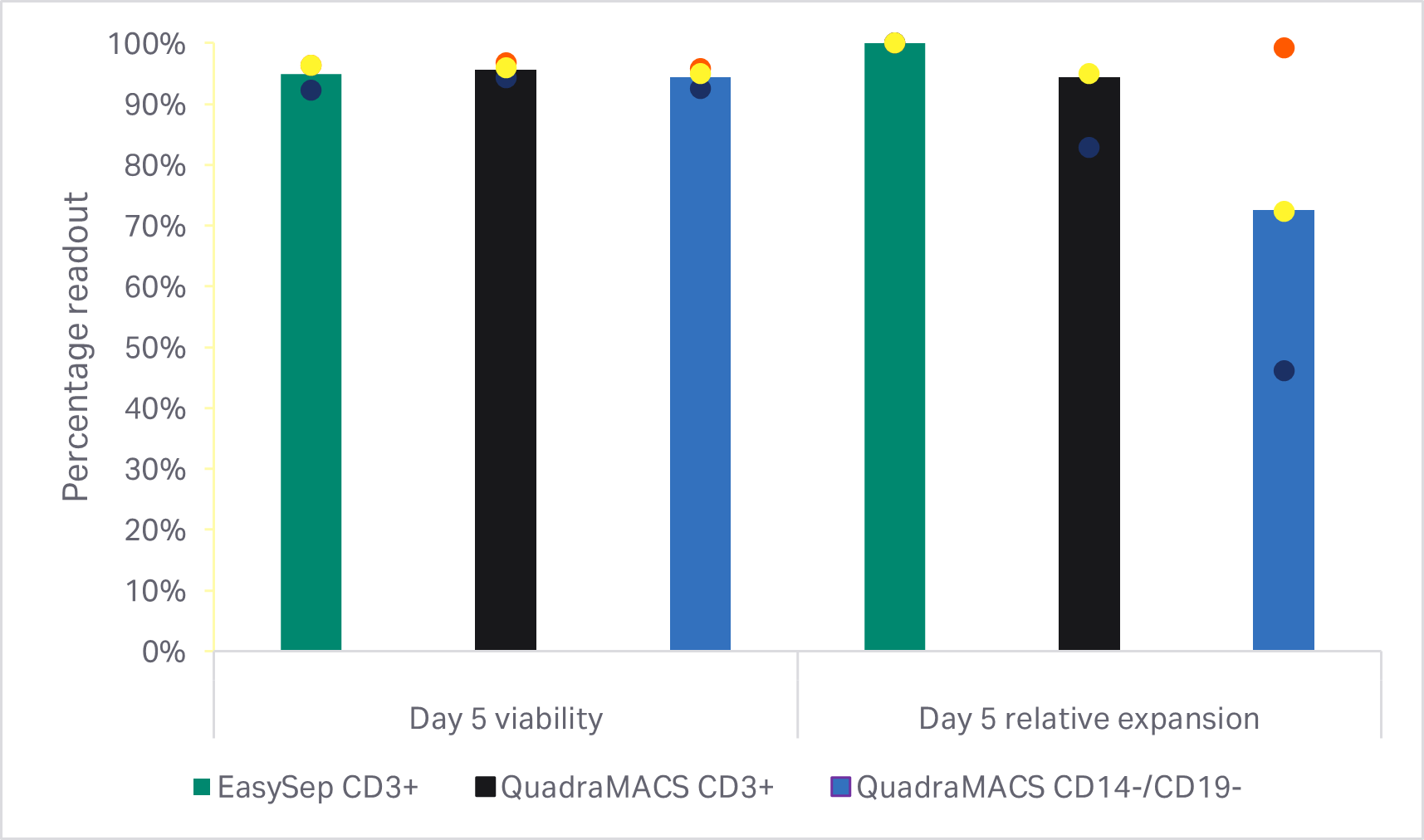
如预期,CD14+ 和 CD19+ 细胞群阴选法获得的 T 细胞纯度明显低于任何一种 CD3+ 阳选法(单因素方差分析,p < 0.001,n = 3)(图 3B)。使用 EasySep™ Release 人 CD3 正选试剂盒进行 T 细胞富集的回收率明显高于使用 QuadroMACS™ 系统进行选择的结果(单因素方差分析,p = 0.01,n = 3)(图 3B)。但是,在富集的 T 细胞群之间,活力和 5 天扩增动力学在统计学上均无显著差异(单因素方差分析,p ≥ 0.05,n = 3)(图 3C)。
(A)
(B)
(C)
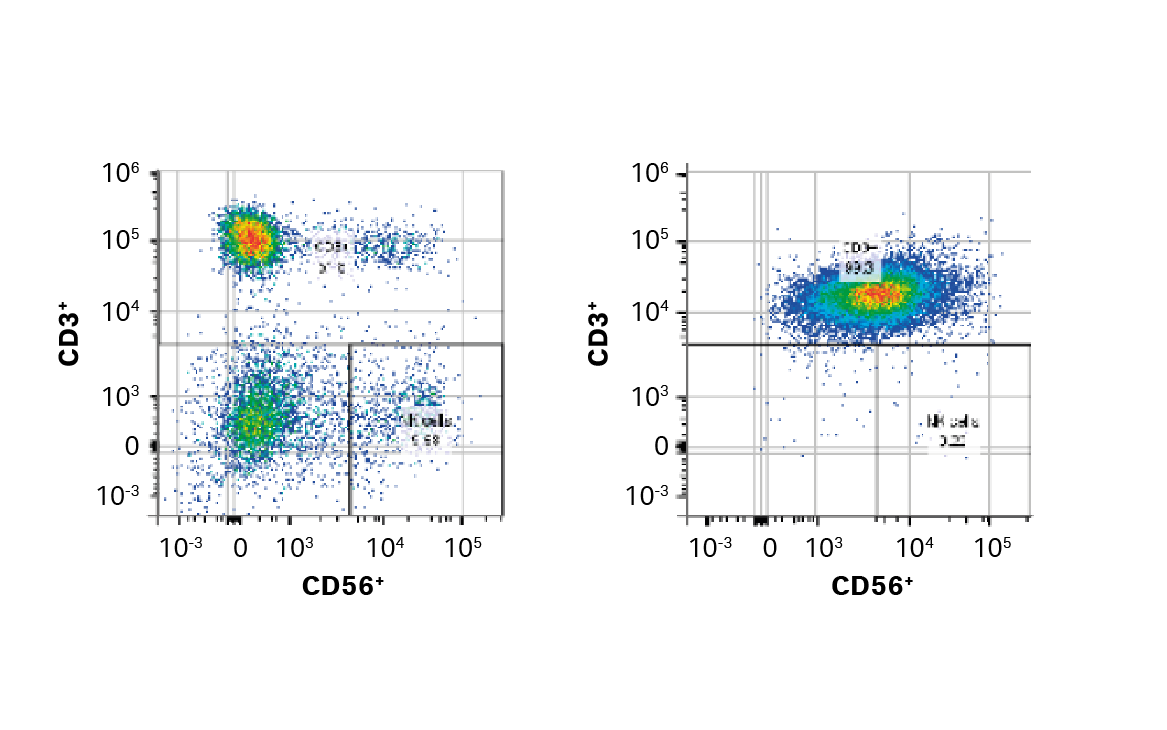
图 3. 富集方法的比较。(A) EasySep CD3+ 阳选之前和之后的门控细胞的 FlowJo™ 表示;(B) EasySep CD3+阳选、QuadroMACS CD3+ 阳选或 QuadroMACS CD14+/CD19+ 耗竭后的 T 细胞回收率、纯度和活力;(C) 相对于各供体 EasySep CD3+ 富集 T 细胞生长的第 5 天活力和累积扩增倍数。条形表示同组三份生物样本的平均值,彩色圆点表示各供体值。
T 细胞转导方法的比较
为了优化转导,需要对在 T 细胞初始活化后进行转导的时间点。尽量在较早的进行转导,以尽可能缩短流程持续时间。目前正在使用的 T 细胞转导方法有数种。然而,其中很多种方法依赖于培养皿或培养瓶中的开放式手动处理,这些工艺不太可能符合 GMP 要求。
作为替代方案,我们用慢病毒 (LV)-eGFP 转导 T 细胞,在 Sepax C-Pro 仪器上测试了自动的功能封闭式 SpinOculation C-Pro 程序软件。
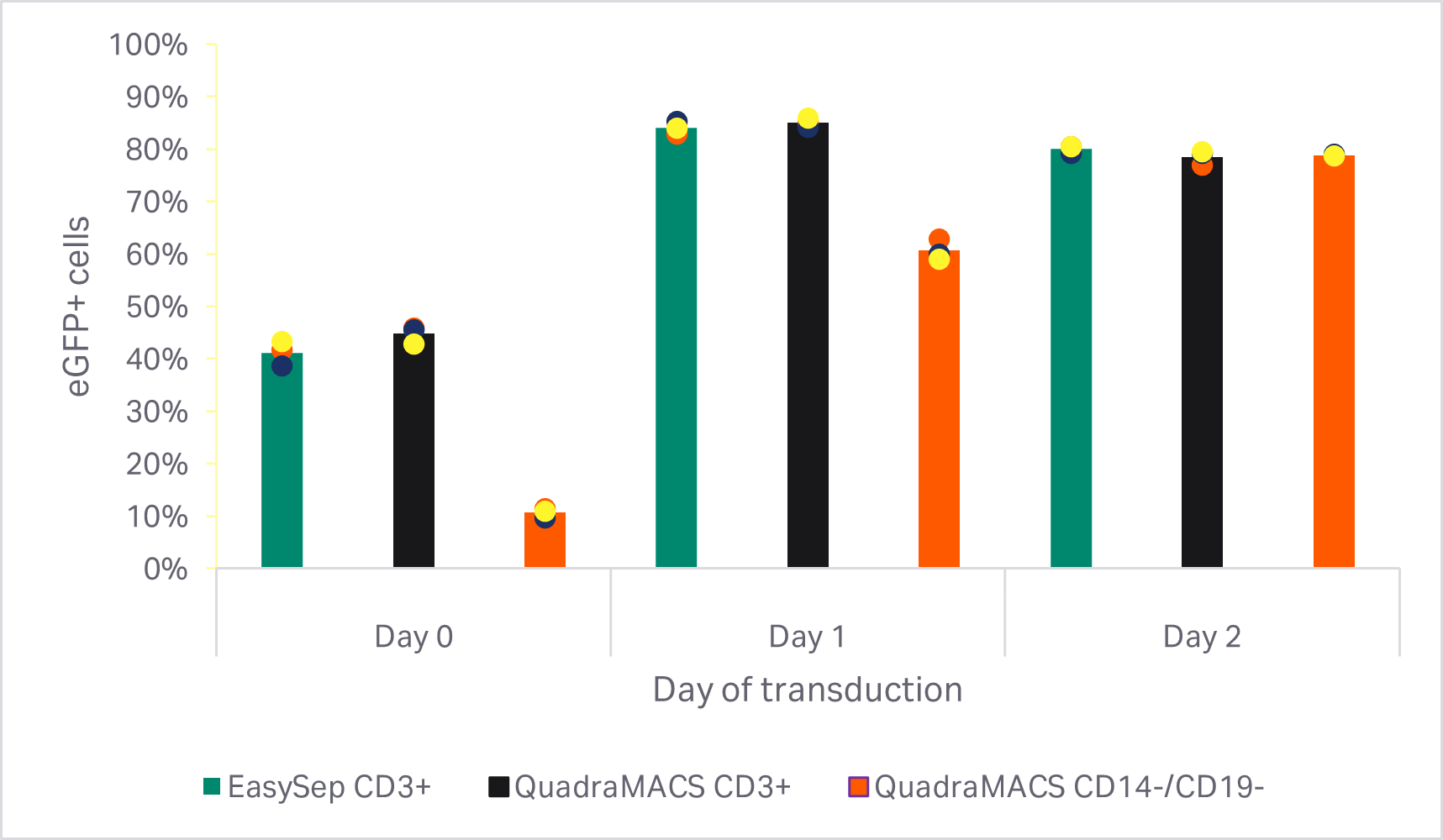
图 4 显示了最佳转导时间研究结果。通过 CD3+ 阳选法富集的 T 细胞在第 0 天转导(单因素方差分析,p = 0.000,n = 3)和第 1 天转导(单因素方差分析,p< 0.001,n = 3)的转导效率高于阴选法。但是,活化后 2 天转导的细胞未见差异(单因素方差分析,p ≥ 0.05,n = 3)。总体观察结果表明,在活化 1 天后,CD3+ 选择的细胞的转导效率最高(单因素方差分析,p < 0.02,n = 3)。
图 4. 最佳转导日期研究结果。活化后不同天数转导的 72 小时后 eGFP 阳性 T 细胞的百分比。条形表示同组三份生物样本的平均值,彩色圆点表示各供体值。
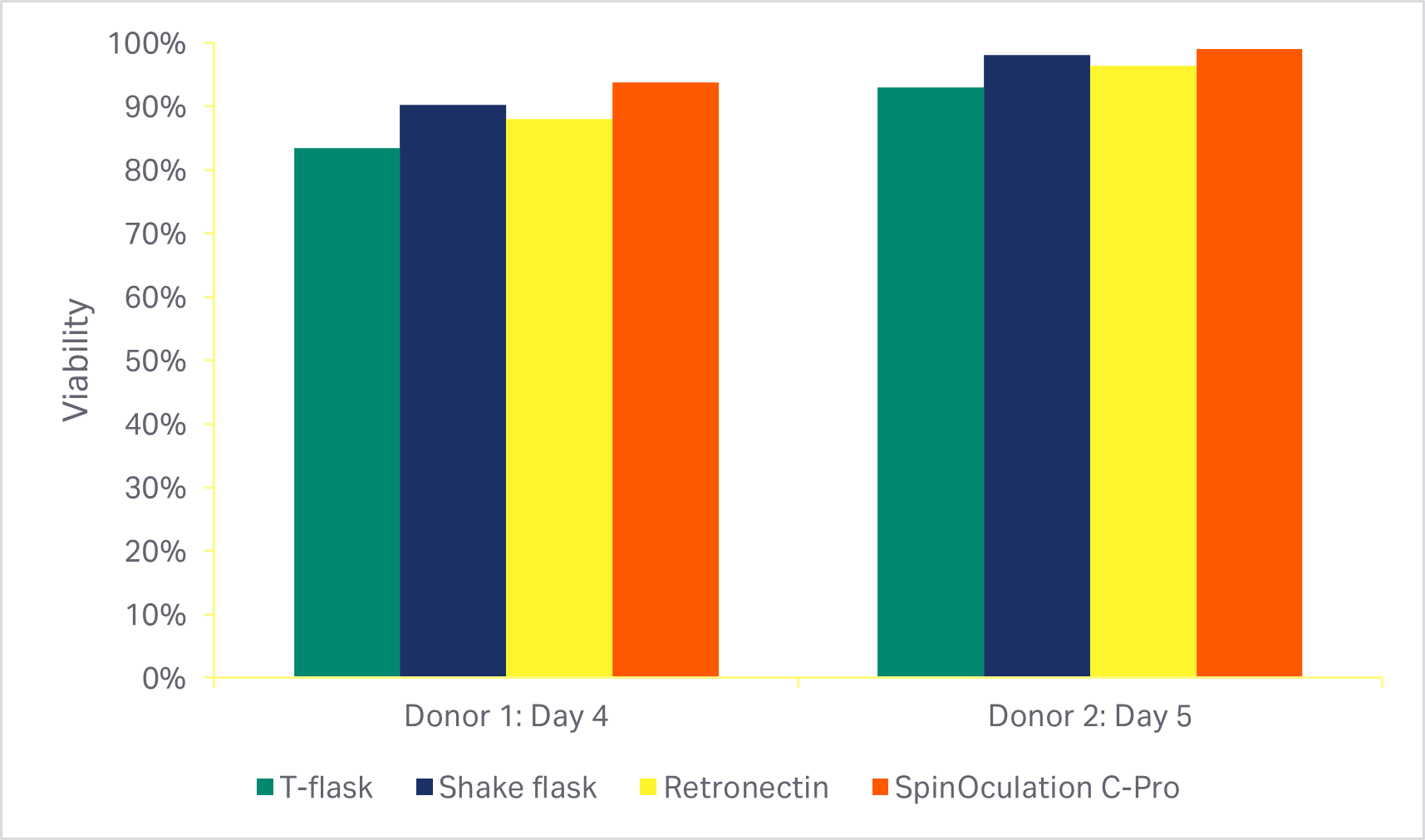
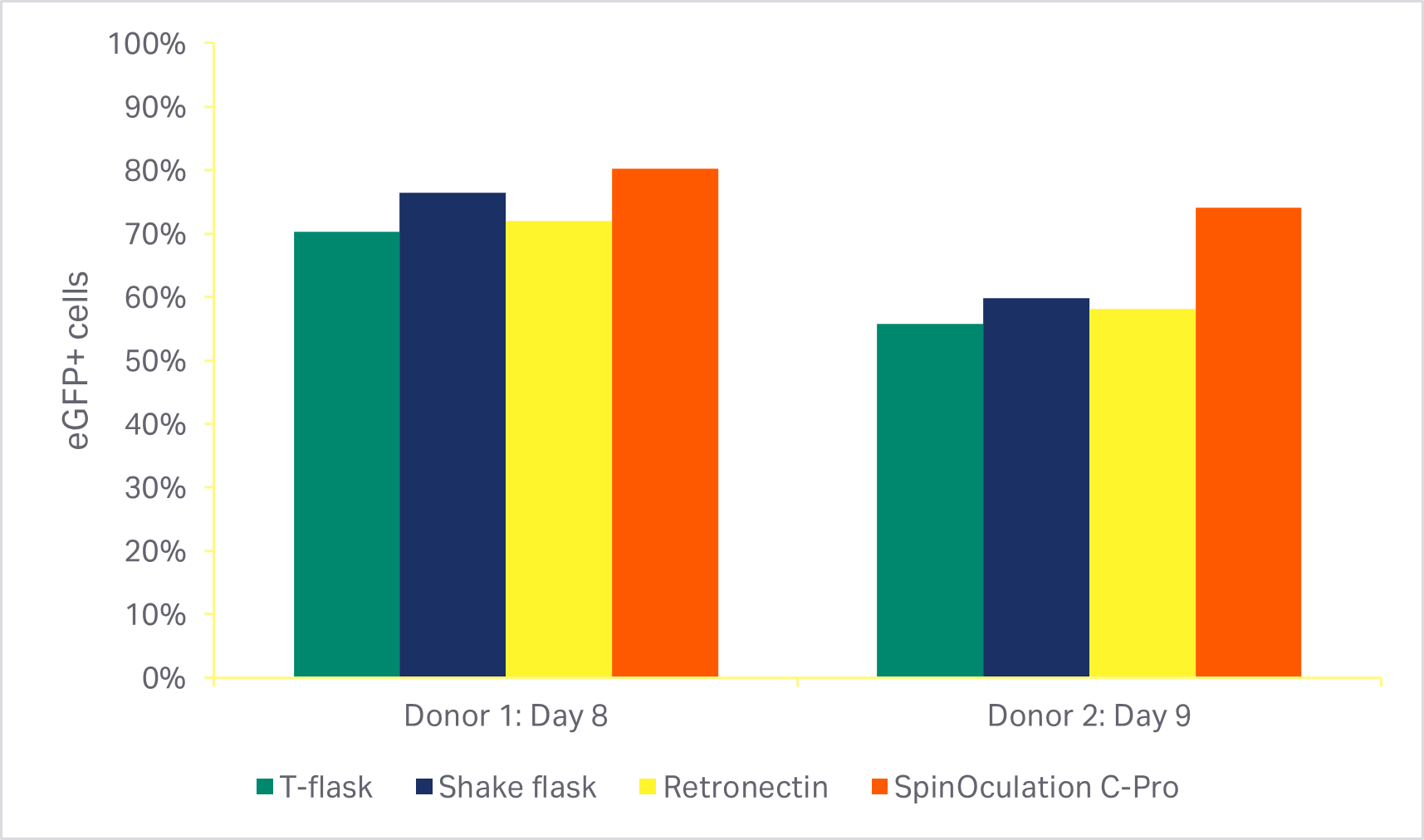
如这些方法所述,分多组将现用的各种手动转导方法(方瓶、摇瓶和 RetroNectin™)与 Sepax C-Pro 仪器上的 SpinOculation C-Pro 程序软件进行比较。通过 Sepax C-Pro 配套的 SpinOculation C-Pro 实现的自动封闭式转导方法在培养结束时得到的细胞活力(图 5A)和转导效率(图 5B)与手动方法相当。
(A)
(B)
图 5. 转导方法的比较。(A) 培养活化阶段后使用不同转导方法的细胞活力(转导后 3 天或 4 天);(B) 培养结束时 eGFP 阳性 T 细胞百分比(转导后 7 天或 8 天)。条形表示两个生物供体的同组三份技术样本的平均值。
T 细胞扩增方法的比较
有几种开放式方法可用于在细胞进入生物反应器之前进行小规模的 T 细胞培养,其中最常见的方法是在方瓶中进行培养。还可采用封闭式方法(例如透气袋和 G-Rex™),但在我们之前的评估中,这些方法无法达到在方瓶中观察到的生长动力学结果(数据未公布)。我们将 Erlenmeyer 摇瓶作为封闭式培养替代容器进行研究,它可以匹配接种在方瓶中的 T 细胞的扩增倍数。
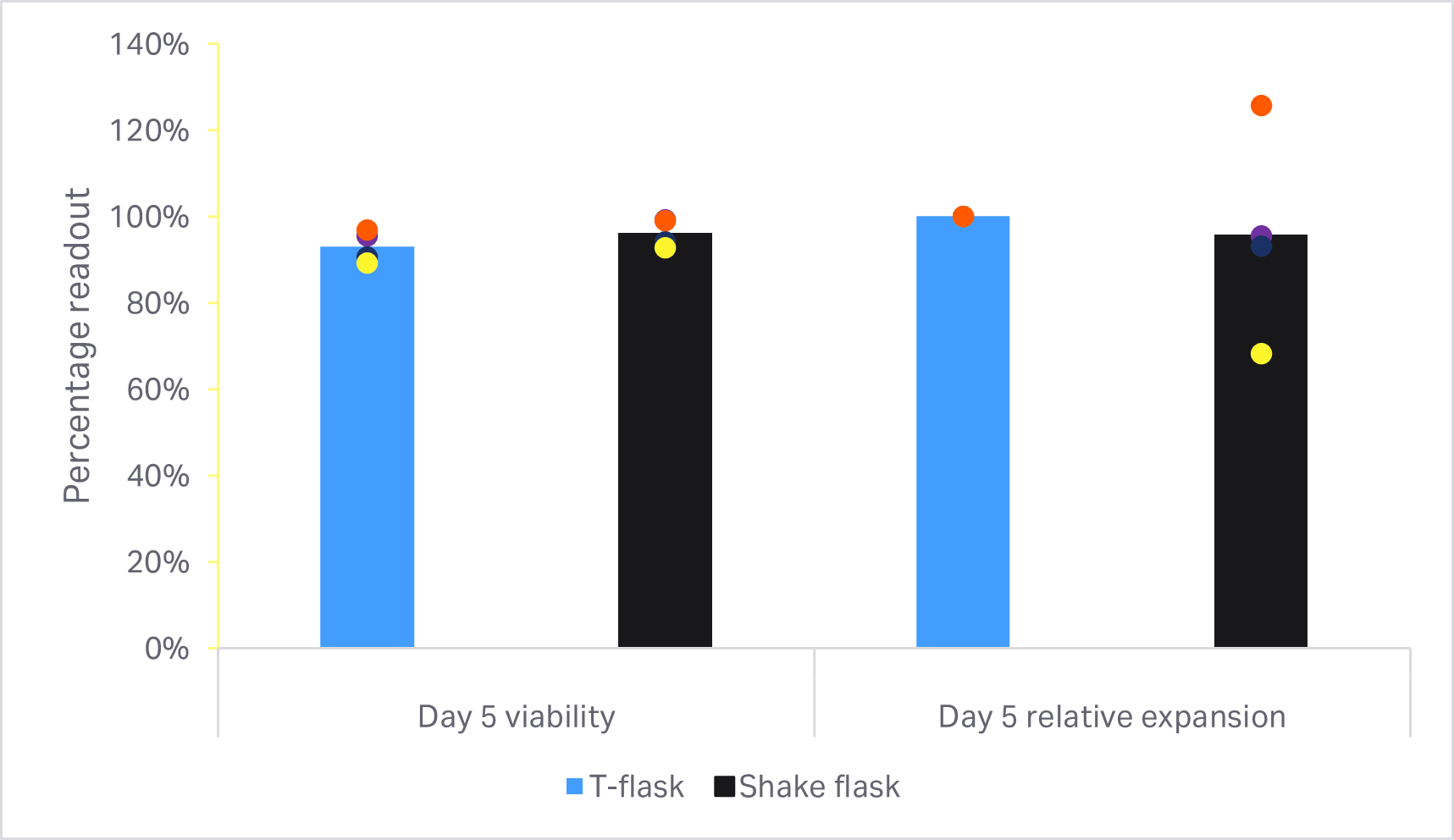
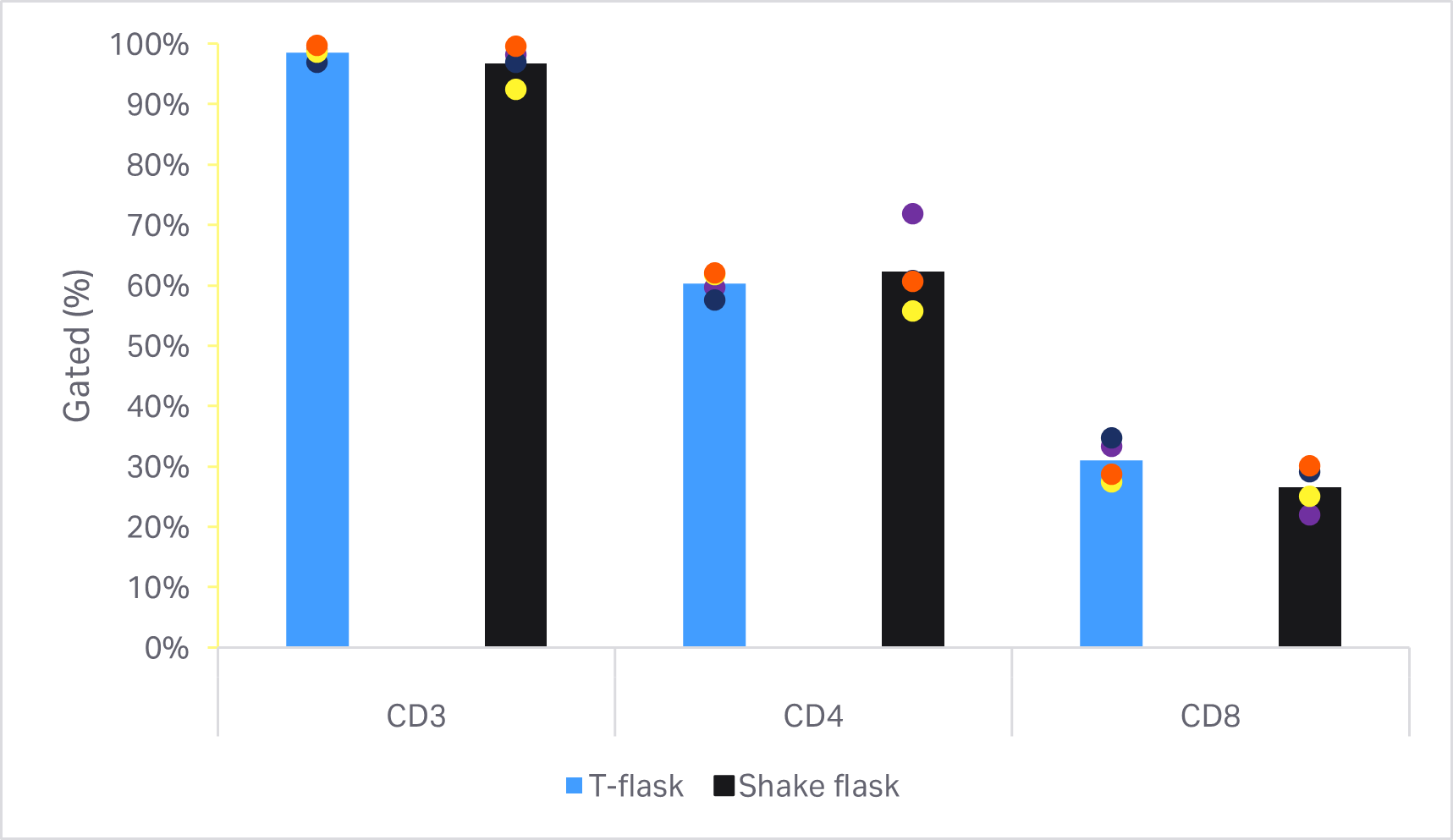
在 T 细胞活力或扩增方面未发现统计学上显著的差异(双样本 t 检验,p ≥ 0.05,n = 4)(图 6A)。图 6B 显示了培养结束时的细胞表型比较。在 T 细胞纯度或 CD4+ 和 CD8 + 亚群方面未发现统计学上的显著差异(双样本 t 检验,p ≥ 0.05,n = 4)。
(A)
(B)
图 6. 小规模培养方法的比较。(A) 相对于各供体的方瓶中 T 细胞生长的第 5 天活力和累积扩增倍数;(B) 在培养结束时使用流式细胞仪测定的 T 细胞及其亚群 CD4+ 和 CD8+ 的表型分析。条形表示四组两份生物样本的平均值,彩色圆点表示单独的值。
大规模转导的 T 细胞生产
使用 Smart-Max AS-310 配套的 Thaw-Large Volume 程序软件和 Sepax 2 配套的 SmartWash 程序软件对白细胞采集物进行自动解冻和洗涤,同时使用 EasySep Release 人 CD3 正选择试剂盒、Sepax C-Pro 仪器配套的 SpinOculation C-Pro 程序软件进行 T 细胞富集,并在摇瓶和 Xuri 细胞扩增系统 W25 中进行小规模活化和扩增(图 7)。
图 7. 工艺工作流程。用于从冷冻白细胞分离单元制备临床相关剂量的 CAR T 细胞的步骤和系统图。大多数步骤在功能上都是封闭和自动化的,并且过程符合 GMP 指导原则。在 Sepax 2 上测试白细胞采集物的洗涤,其等效产品 Sepax C-Pro 已经上市出售。SF = 摇瓶。
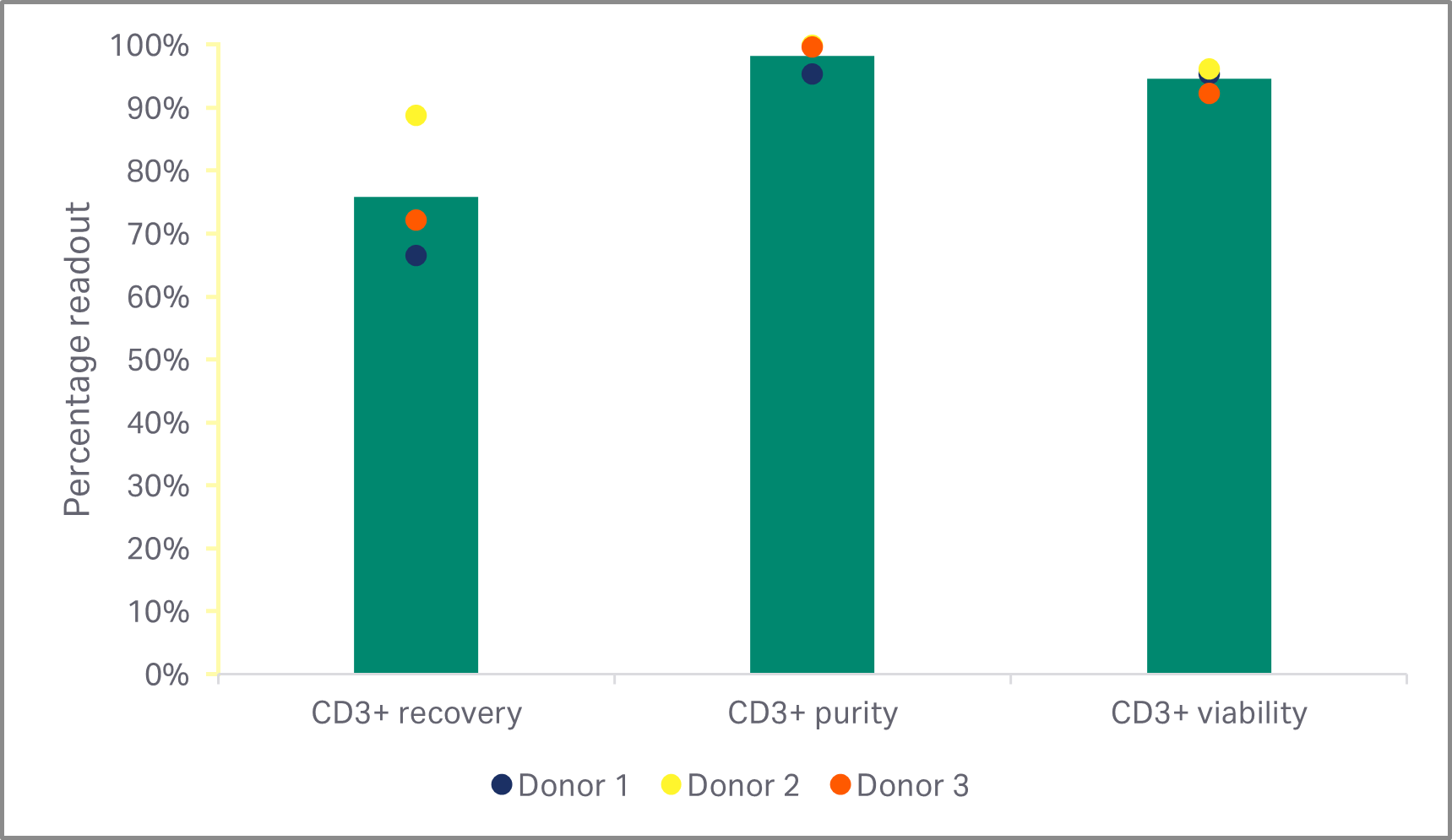
通过三次大规模生产运行,我们使用上述设置从解冻和洗涤步骤中获得了超过 75% 的细胞回收率,并且活力超过 90%(图 8A)。使用 EasySep 系统通过磁分离获得富集的 T 细胞群,将 T 细胞初始输入群的纯度从 53% 提高到 62%,并且无论细胞的起始群如何,输出的纯度均提高到 95% 以上(图 8B)。
(A)
(B)
图 8. 富集后 T 细胞的纯度和回收率。(A) 使用 Sepax 2 及其配套的 SmartWash 程序软件后的活 PBMC 回收率和活力;(B) EasySep Release 人 CD3 正选后富集 T 细胞的回收率、纯度和活力。条形表示同组三份生物样本的平均值,彩色圆点表示各供体值。
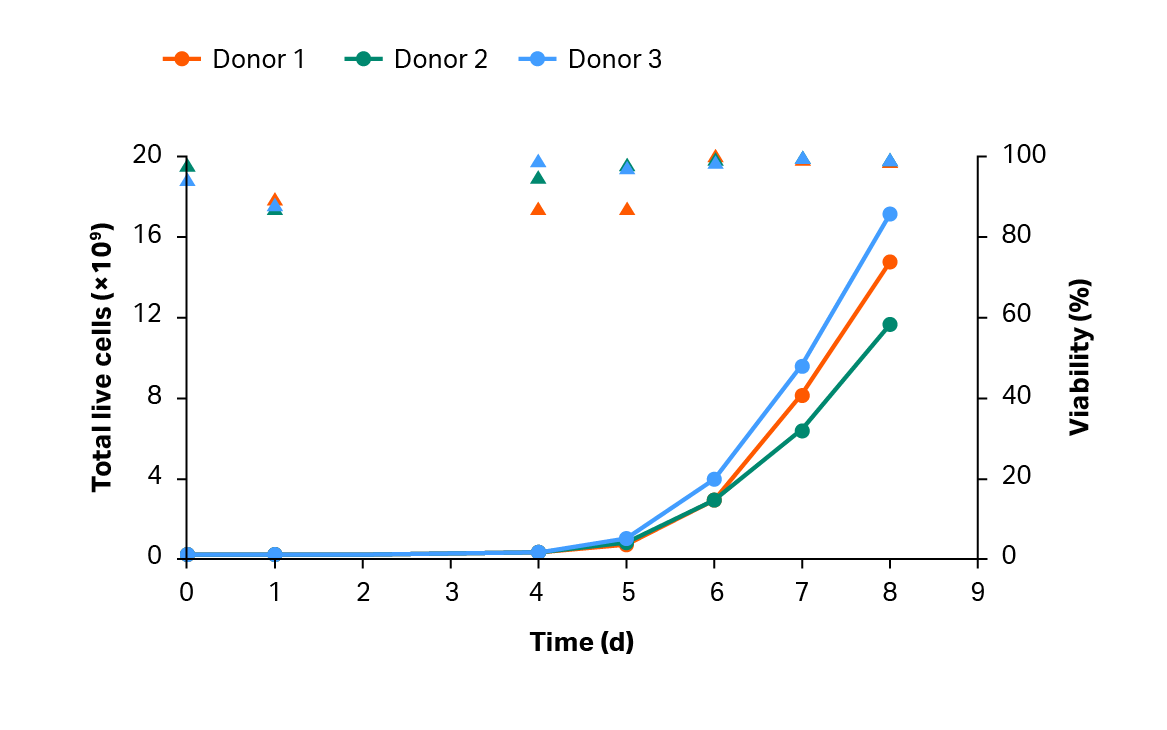
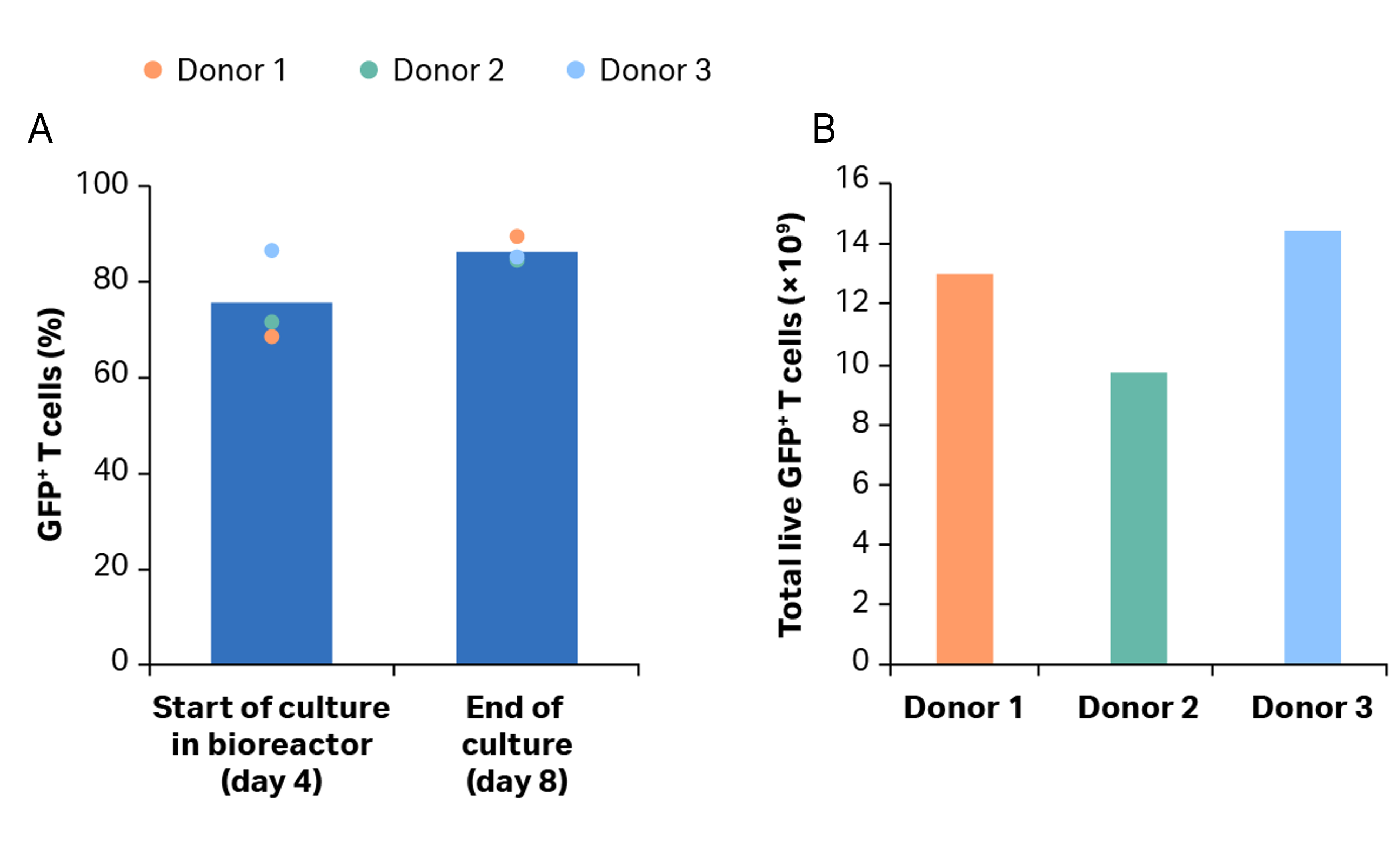
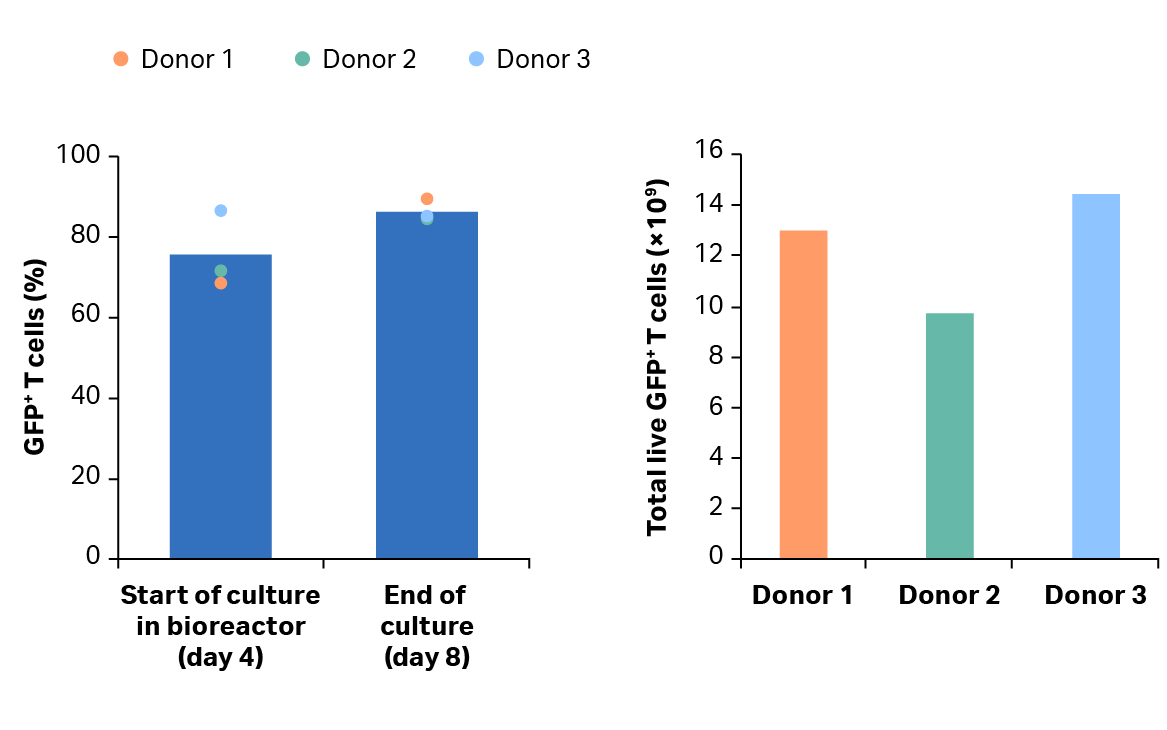
分离后,将细胞活化、转导并在摇瓶中扩增 4 天,然后转移到 Xuri 细胞扩增系统 W25 中。4 天后,超过 68% 的 T 细胞群完成转导(图 9A)。T 细胞在 Xuri 细胞扩增系统 W25 中从起始细胞群扩增了 78 倍以上(图 9B)。在整个培养过程中,转导率保持在 84% 以上(图 9B),第 8 天可获得超过1×1010个以转导的T细胞T 细胞超过 1 × 1010(图 9C)。
(A)
(B)
(C)
图 9. 培养生长和转导效率。(A) T 细胞的累积生长与活力。曲线表示扩增情况,三角形表示 CAR T 过程中的活力。(B) 在摇瓶中活化后以及在 Xuri 细胞扩增系统 W25 中培养后的转导 GFP+ T 细胞的百分比。条形表示同组三份生物样本的平均值,彩色圆点表示各个供体的值;(C) 供体 1、2、3 的第 8 天累积 GFP+ T 细胞。
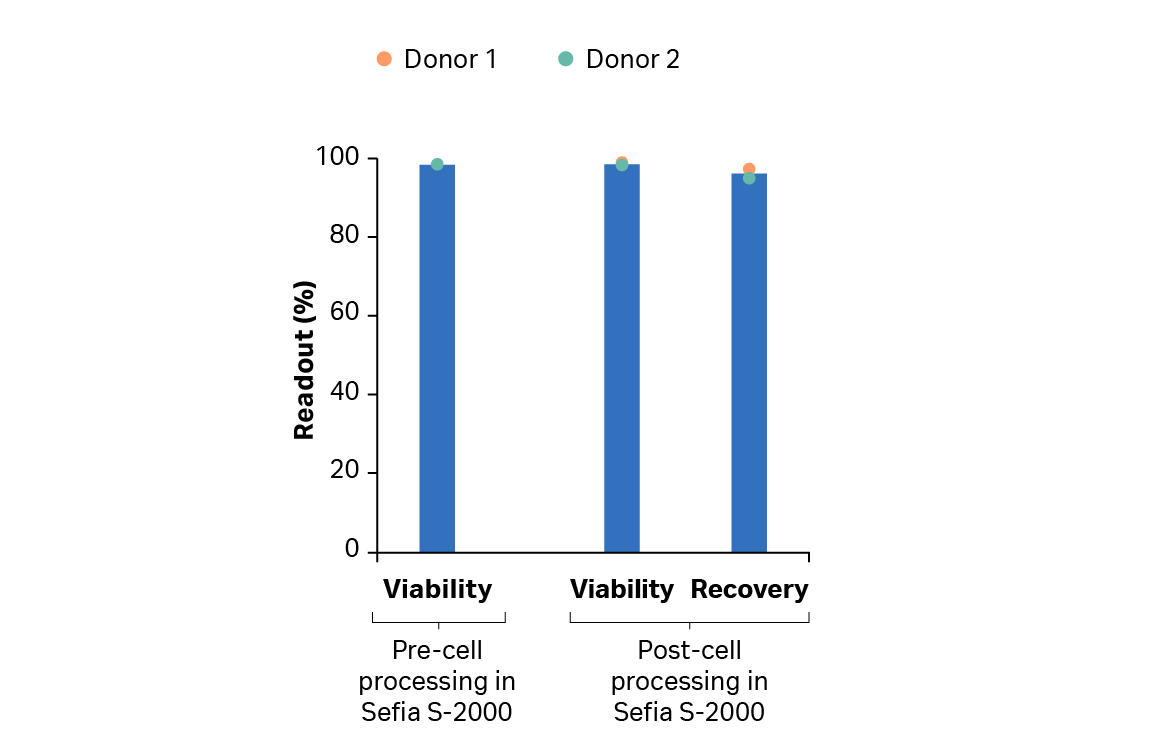
培养后,冷冻保存前,使用 Sefia S-2000 细胞处理仪及其配套的 FlexCell 程序软件收获扩增的转导 T 细胞。经过浓缩、洗涤和冷冻制剂后,总活细胞回收率超过 95%,而活力未降低(图 10A)。细胞冻存袋在 VIA Freeze Quad 中冷冻保存,然后转移到液氮储存器中。
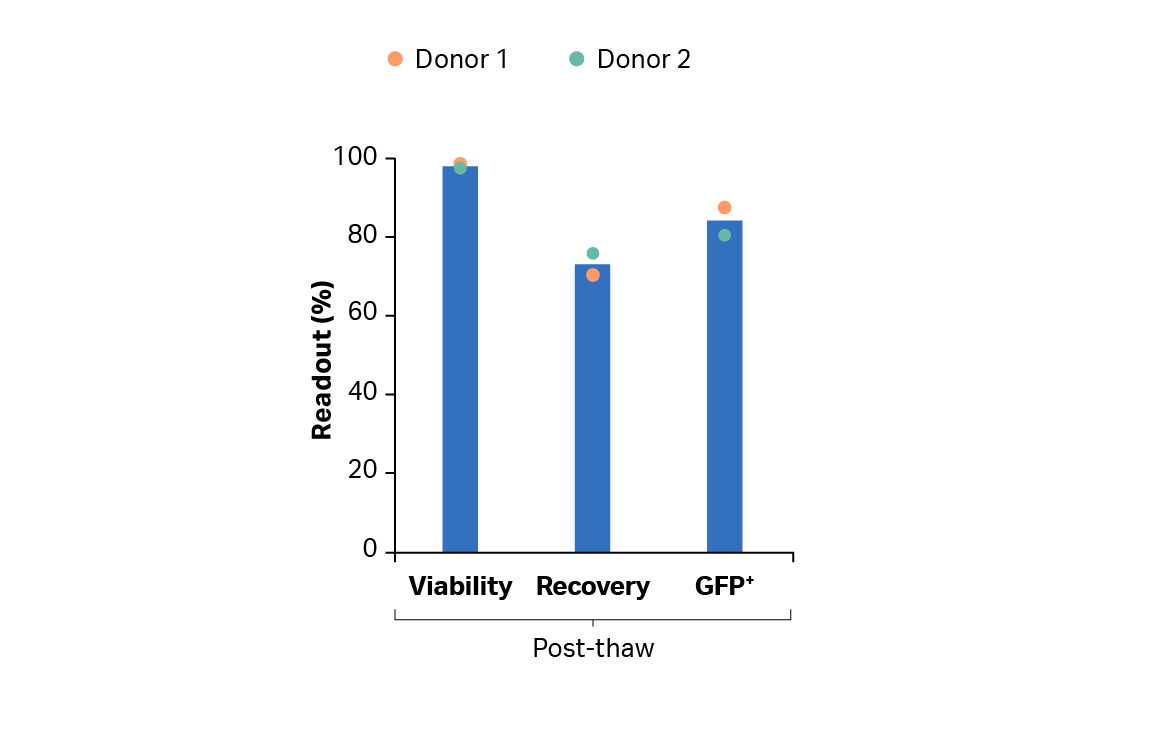
图 10B 显示了手动洗涤、离心和缓冲液交换后,使用 VIA Thaw CB1000 解冻后的细胞的活力和回收率,用于评估冷冻保存后的细胞(作为最终注入患者体内的产品的替代品)。如图所示,细胞回收率超过 70%,活力超过 97%。结果还表明,在冷冻保存过程中,转导率保持在 80% 以上。
(A)
(B)
图 10.T 细胞的回收率和活力。(A) 使用 Sefia S-2000 仪器及其配套的 FlexCell 程序软件收获后,来自供体 1 和 2 的培养的 T 细胞的回收率和活力;(B) 使用 Sefia S-2000 仪器及其配套的 FlexCell 程序软件冷冻制备后,冷冻保存的转导 T 细胞解冻后的回收率和活力。
结论
本研究中使用的工作流程适用于工业化自体 CAR T 细胞生产,因为它结合了几种功能上封闭的自动化单元操作。这种大规模转导的 T 细胞生产提供了临床相关剂量(每个供体 1 × 1010 个细胞)且转导效率高(> 80% eGFP+)。从表型上看,最终产物表现出活化 T 细胞群的特征。
未来的工作重点可以放在微调各个步骤以降低成本并同时保持稳健、可扩展的工艺流程。例如,可以通过减少培养基更换量以及优化摇摆速度和角度,来进一步改善生物工艺参数(例如搅拌和摇摆速度等)以及灌流策略。
总体而言,本文介绍的方法与 CAR T 生产的工业工作流程相容。本文介绍了半自动 T 细胞扩增和关键单元操作闭合的可行性。具体而言,摇瓶内的小规模扩增证明了其有可能替代在透气袋或密闭瓶中静态培养的传统方法。
致谢
所有工作均与 CCRM 合作进行,资金由 FedDev Ontario 和 Cytiva 在加拿大安大略省多伦多市的前沿细胞治疗技术中心 (CATCT) 提供。研究结果的报告和解释由作者负责。
参考文献
1.Report: Cancer Facts and Figures, American Cancer Society (2019). Accessed 22 May 2019.
2.Approved Cellular and Gene Therapy Products, United States Food and Drug Administration. Accessed 22 May 2019.
了解我们如何帮助您管理整个 CAR T 工作流程的风险和成本。
订购信息
| 产品 | 产品代码 |
|---|---|
| Smart-Max AS-310 仪器 | 3500 |
| Thaw-Large Volume 程序软件*‡ | – |
| Sepax 2 细胞分离设备† | 14000 |
| SmartWash Sepax 2 程序软件 | 14305 |
| CS-600.1 Sepax 细胞分离套件 | 10006 |
| Sepax C-Pro 细胞处理仪 | 29264741 |
| CultureWash C-Pro 配套程序软件 | 29264736 |
| SpinOculation C-Pro 配套程序软件 | 29367187 |
| CT-60.1 Sepax C-Pro 细胞处理套件 | 29264739 |
| Sefia S-2000 细胞处理仪 | 29285527 |
| FlexCell Sefia 配套程序软件 | 16301 |
| CT-800.1 Sefia 细胞处理套件 | 20001 |
| Dulbecco 磷酸盐缓冲盐水 (DPBS) | SH30028.03 |
| Xuri T 细胞扩增培养基 1000 mL | 29185231 |
| Xuri IL-2 (1 mg) | 29062790 |
| Xuri 细胞扩增系统 W25 | 29064568 |
| Xuri 细胞扩增系统细胞培养袋,支持灌流培养,pH 和 DO 监控,2 L | 29105498 |
| VIA Freeze Quad | VFQ_30010 |
| 50 mL 冻存袋 SBS 板,适用于 VIA Freeze 降温仪 | ASY_30038 |
| VIA Thaw CB1000 | TBA_30001 |
*对于上游解冻,我们使用了与 Smart-Max 仪器配套的 Thaw-Large Volume 程序软件。也可以选择使用 VIA Thaw 解冻仪进行上游和下游加工。
†本研究使用 Sepax 2 细胞分离设备。但是,建议在生产时使用效果与此等效的 Sepax C-Pro 设备。
‡即将推出。关于产品的发布,不作任何保证(Cytiva 保留更改任何产品发布计划和时间的权利)。
解冻和洗涤方法的比较
将来自三个供体白细胞采集物 (HemaCare) 的细胞直接在 37°C 水浴中解冻后手动洗涤,或使用 Smart-Max AS-310 仪器及其配套的 Thaw-Large Volume 程序软件和 Sepax 2 细胞分离器及其配套的 SmartWash 程序软件自动解冻和处理。这两种情况下,随后都根据生产商的方案,使用 EasySep Release 人 CD3 正选试剂盒 (STEMCELL Technologies) 富集 T 细胞。
T 细胞富集和活化方法的比较
使用 Smart-Max AS-310 及其配套的 Thaw-Large Volume 程序软件和 Sepax 2 及其配套的 SmartWash 程序软件处理来自三个供体的白细胞采集物。然后进行 T 细胞富集。T 细胞富集可以使用 EasySep Release 人 CD3 正选试剂盒,或使用在 QuadroMACS 分离器 (Miltenyi Biotec) 配套的 LS 分选柱上运行的 CD3 Microbeads,也可使用在 QuadroMACS 分离器配套的 LS 分选柱上运行的 CD14 和 CD19 Microbeads 的组合。使用 ImmunoCult™ 人 CD3/CD28/CD2 T 细胞活化剂 (STEMCELL Technologies) 活化含富集 T 细胞的部分。其他所有列出的材料均来自 Miltenyi Biotec。
向 Xuri T 细胞扩增培养基中补充 5% 热灭活的人 AB 血清 (Gemini) 和 350 IU/mL Xuri IL-2 生长因子,以制备细胞培养基,然后使用该细胞培养基完成所有随后的 T 细胞扩增。将细胞接种到经过组织培养物处理的 Nunc™ 多孔板 (Thermo Fisher Scientific) 中,接种密度为 1 × 106 个细胞/mL,第 3 天后每天计数,并稀释至 5 × 105 个细胞/mL。
T 细胞转导方法的比较
选择方法和慢病毒 (LV) 添加时间的影响
在活化当天,或活化后 1 或 2 天,转导通过前述各种富集方法采集到的活化 T 细胞的子集,以评估富集方法和病毒添加时间对转导效率的影响。
在经过组织培养物处理的 Nunc 多孔板中,用 LV-eGFP 载体 (Tailored Genes) 以 2.5 的感染复数 (MOI) 转导 T 细胞。转导后 16 到 20 小时,用新鲜培养基将体积增加一倍,以改善细胞健康。添加培养基后 48 小时,使用 CytoFLEX™ 流式细胞仪 (Beckman Coulter) 测量转导效率。
转导方法的影响
为了比较几种转导 T 细胞的方法,使用 Smart-Max AS-310 及其配套的 Thaw-Large Volume 程序软件和 Sepax 2 及其配套的 SmartWash 程序软件处理来自两个供体的白细胞采集物。然后使用 EasySep Release 人 CD3 正选试剂盒富集 T 细胞,并使用 ImmunoCult 人 CD3/CD28/CD2 T 细胞活化剂进行活化。将细胞以 1 × 106 个细胞/mL 的密度接种到经过组织培养物处理的 Nunc 方瓶 (Thermo Fisher Scientific),并在培养箱(37° C,5% CO2)中培养 1 天,以进行转导前的活化。
将病毒和细胞接种到 Nunc 方瓶、摇瓶 (Corning) 或 RetroNectin 涂层板 (Takara),使用 LV-eGFP 以 2.5 的 MOI 转导活化的 T 细胞。按照相同的 MOI,使用 Sepax C-Pro 仪器及其配套的 SpinOculation C-Pro 程序软件以封闭自动化方式转导另一组活化的 T 细胞。在培养箱中培养方瓶和 RetroNectin 涂层板中的细胞(37° C,5% CO2)。把使用 SpinOculation C-Pro 程序软件、通过 LV-eGFP 转导的细胞接种到 Erlenmeyer 摇瓶中。将两组摇瓶都放在 MaxQ™ CO2 Plus 摇床 (Thermo Fisher Scientific) 中,置于培养箱内(37° C,5% CO2,90 rpm)进行培养。
转导后 16 到 20 小时,用新鲜培养基将体积增加一倍,以改善细胞健康。进一步操作之前,将细胞再培养 2 或 3 天以使其活化。总共培养 4 或 5 天后,每天对细胞进行计数并稀释至 5 × 105 个细胞/mL,持续 4 天。培养结束时,用 CytoFLEX 流式细胞仪测量转导效率。
T 细胞扩增方法的比较
使用 Smart-Max AS-310 及其配套的 Thaw-Large Volume 程序软件和 Sepax 2 及其配套的 SmartWash 程序软件处理来自四个供体的白细胞采集物。然后,使用 EasySep Release 人 CD3 正选试剂盒富集 T 细胞,并通过 ImmunoCult 人 CD3/CD28/CD2 T 细胞活化剂进行活化。将细胞接种到经组织培养物处理过的 Nunc 方瓶或 Erlenmeyer 摇瓶中,并以 1 × 106 个细胞/mL 的密度进行接种。将摇瓶放在 MaxQ CO2 Plus 摇床上,转速为 90 rpm,而方瓶保持静止。进行其他操作之前,先将细胞在培养箱中培养(37°C,5% CO2)3 天以便活化。3 天后,对细胞进行计数,并稀释至 5 × 105 个细胞/mL。细胞保持 5 天,然后使用 CytoFLEX 流式细胞仪进行表型分析。
大规模转导的 T 细胞生产
解冻和洗涤
在搭载 Thaw-Large Volume 程序软件的 Smart-Max AS-310 上解冻一份冷冻的白细胞采集物。通过加药塞将解冻的白细胞采集物连接到 CS-600.1 Sepax 细胞分离套件,并使其在搭载 SmartWash 程序软件的 Sepax 2 上运行。虽然使用这种配置来生成此数据集,但也可使用搭载 CultureWash C-Pro 程序软件的 Sepax C-Pro 细胞处理仪及其相应的 CT-60.1 Sepax C-Pro 细胞处理套件作为等效替代方案,而且这种方案更灵活(表 1)。
使用不含钙或镁并补充有 2% 热灭活人血清 AB 和 1 mM 乙二胺四乙酸 (EDTA) (Sigma) 的 HyClone Dulbecco 磷酸盐缓冲盐水 (DPBS‑/‑) 稀释细胞。进行洗涤,并在起始体积的洗涤缓冲液中提取细胞。
表 1. 模拟 SmartWash 参数的等效的 CultureWash C-Pro 参数1
| 参数 | Sepax 2 配套的 SmartWash | Sepax C-Pro 配套的 CultureWash C-Pro |
|---|---|---|
| 输入体积 | 50–880 mL (70 mL) | 20–1200 mL (70 mL) |
| 检测初始体积 | 不适用(否) | 标记(否) |
| 输入袋冲洗 | 不适用(是) | 标记(是) |
| 输入袋冲洗体积 | 不适用(50 mL) | 25–100 mL (50 mL) |
| 暂停输入袋冲洗 | 不适用(否) | 标记(否) |
| 最终体积 | 50–200 mL (70 mL) | 8–500 mL (70 mL) |
| 稀释比例 | 0.0–2.0 (2.0) | 0.0–3.0 (2.0) |
| 中间步骤体积 | 不适用 (10 mL) | 5–50 mL (10 mL) |
| 光学细胞检测 | 不适用(是) | 标记(是) |
| 稀释速度 | 不适用 (17 mL/min) | 10–120 mL/min (17 mL/min) |
| 离心力 | 不适用 (400 × g) | 100–800 × g (400 × g) |
| 沉降时间 | 不适用 (240 s) | 120–600 s (240 s) |
| 洗涤周期 | 标准 (1) 或高速洗涤 (2)(标准) | 0–3 (1) 和 0–3 (0) |
| 悬挂袋验证 | 不适用(是) | 标记(是) |
| 手动提取 | 不适用(否) | 标记(否) |
| 产品灌装速度 | 不适用 (60 mL/min) | 17–120 mL/min (60 mL/min) |
| 废液提取速度 | 不适用 (75 mL/min) | 17–120 mL/min (75 mL/min) |
1 括号内为选用的参数。如果参数不可用(不适用),则括号内为默认参数。
T 细胞富集和活化
使用 EasySep Release 人 CD3 正选试剂盒富集 CD3+ 细胞,相关操作遵循生产商的说明。细胞培养基的制备见“T 细胞富集方法的比较”。使用 ImmunoCult 人 CD3/CD28/CD2 T 细胞活化剂活化 T 细胞,相关操作遵循生产商的方案。将细胞以 1.5 × 106 个细胞/mL 的密度接种到 1 L 的 Erlenmeyer 细胞培养瓶 (Corning) 中。将培养瓶置于 MaxQ CO2 Plus 摇床上,在培养箱(37° C,5% CO2,90 rpm)内培养 1 天以活化细胞,然后再进行进一步操作。
转导和培养
对于大规模转导,活化后 1 天对细胞进行计数,并将 220 mL 细胞悬液转移至 600 mL 转移包 (Fresenius Kabi)。在 20 mL 培养基中稀释 LV-eGFP(体积对应 MOI 为 2.5)。此培养基与活化用的配方相同。将病毒转移到无菌注射器 (BD Biosciences) 中,并冷冻。使细胞和病毒融入 CT-60.1 Sepax C-Pro 细胞处理套件,并在搭载 SpinOculation C-Pro 程序软件的 Sepax C-Pro 仪器上运行(表 2)。
表 2. SpinOculation C-Pro 参数
| 参数 | 值 |
|---|---|
| 初始体积 | 220 mL |
| 输入袋冲洗 | 是 |
| 输入袋冲洗体积 | 50 mL |
| 暂停输入袋冲洗 | 否 |
| 光学细胞检测 | 否 |
| 中间步骤体积 | 40 mL |
| 洗涤周期 | 0 |
| 浓缩离心力 | 400 × g |
| 浓缩时间 | 300 s |
| 病毒体积 | 25 mL1 |
| 接种时间 | 90 min |
| 接种离心力 | 600 × g |
| 最终体积 | 100 mL |
| 接种体积 | 60 mL |
1 尽管培养基中慢病毒载体的体积为 20 mL,但为避免管路中滞留体积的影响,此处输入的值为 25 mL。
在新鲜培养基中进行转导之前,先进行细胞计数,并以原始密度将细胞接种到 1 L Erlenmeyer 细胞培养瓶中。在与活化相同的条件下,在培养箱中培养细胞 16 至 20 小时。16 至 20 小时后,加入培养基至体积加倍。细胞再培养 2 天。
细胞扩增
将 2 L Xuri Cellbag 生物反应器置于装有 5% CO2 的 Xuri 细胞扩增系统 W25 上,并无菌连接装有培养基的储液器。培养基的配方与小规模培养时使用的配方相同。将初始体积 200 mL 的培养基添加到生物反应器中,放置一夜以使其平衡。设置系统参数:温度为 37° C,气体流速为 0.05 L/min,摇摆速度为 10 rpm,角度为 6°。
在 Erlenmeyer 摇瓶中放置共 4 天后,将细胞接种到生物反应器中,并加入培养基,此时生物反应器中总共有 500 mL 培养物。启动后,将生物反应器放置过夜,同时以 1 L/d 的速度将新鲜培养基添加到反应器中,达到 1 L 的总容积。从第 5 天起,按每天 1 L 培养基的速度连续灌注培养基,以控制乳酸、铵和葡萄糖水平。每日取样,进行细胞数、活力和生化分析(乳酸、铵、葡萄糖和 pH)。保持细胞培养直至第 8 天。
表型分析和转导效率
在培养的第 0、4 和 8 天使用流式细胞仪分析 T 细胞群。简言之,洗涤并使用人 FcR 阻滞剂 (Miltenyi Biotec) 阻滞 1 × 106 个细胞,然后用 CD3-BV510、CD4-APC-H7、CD8-BV650、CD45RO-BV421、CD62L-PE、CD25-BV786、CD279-APC 和 7AAD(均来自 BD Biosciences)进行染色。
在表型分析的同时,在异硫氰酸荧光素 (FITC) 通道上使用 eGFP 检测法来测量转导效率。使用 CytoFLEX 流式细胞仪分析染色的细胞。
收获和冷冻保存
使用 Sefia S-2000 细胞处理仪、FlexCell 程序软件和 CT-800.1 细胞处理套件收获 T 细胞(表 3)。简言之,以 75 mL/min 的流速将 1 × 1010 个 T 细胞的体积减少到 50 mL。使用补充有 10% 人血清白蛋白 (Gemini) 的 PLASMA-LYTE A (Baxter) 进行两轮洗涤。以 400 ×g 的离心力洗涤 5 分钟。然后,以 1 × 108 个细胞/mL 的密度在含 50% CryoStor™ CS10 (BioLife Solutions) 和 5% 人血清白蛋白的 PLASMALYTE A 中提取细胞,将提取的细胞放入三个 CryoMACS™ 50 冻存袋 (Miltenyi Biotec)。将这三个冻存袋装入 VIA Freeze Quad 降温仪内(降温速率为 -1°C/min),降温至 -100°C。冷冻后,将所有细胞转移至液氮储存器中。
表 3. FlexCell 程序软件中使用的参数
| 参数 | 值 |
|---|---|
| 初始体积 | 输入体积为 1 × 1010 个细胞 (mL) |
| 检测初始体积 | 否 |
| 启用初始袋重传感器 | 否 |
| 启用废液袋重传感器 | 是 |
| 浓缩离心力 | 400 × g |
| 浓缩沉降时间 | 300 s |
| 洗涤周期 | 0 |
| 浓缩离心力 | 400 × g |
| 浓缩时间 | 300 s |
| 中间步骤体积(浓缩) | 50 mL |
| 泵速 | 75 mL/min |
| 洗涤周期 | 2 |
| 洗涤离心力 | 400 × g |
| 洗涤沉降时间 | 300 s |
| 中间步骤体积(洗涤) | 20 mL |
| 袋 1 最终体积 | 20 mL |
| 袋 2 最终体积 | 20 mL |
| 袋 3 最终体积 | 20 mL |
| 换袋重悬 | 否 |
| 死体积提取 | 否 |
| 启用过程温度 | 否 |
| 过程温度 | 20°C |
| 启用最终产品温度 | 是 |
| 最终产品温度 | 4°C |
| 最终产品调节时间 | 0 s |
| 启用最终稀释 | 是 |
| 最终稀释注射速率 | 17 mL/min |