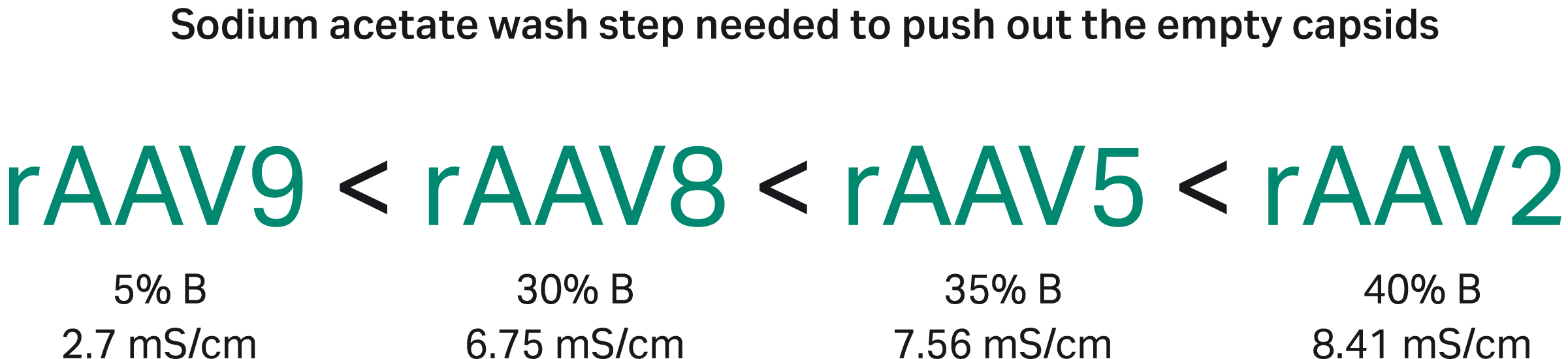目前腺相关载体 (AAV) 为主要的基因治疗用病毒载体,优化 AAV 工艺的精纯步骤,以分离每种血清型的完整衣壳与空衣壳,这一点至关重要。这样做可提高病毒基因组 (VG) 回收率和完整衣壳纯度。
我们开发了一种使用 Capto™ Q 层析填料进行阴离子交换的方案,通过该方案可几乎完全分离多种重组血清型(rAAV2、rAAV5、rAAV8 和 rAAV9)的完整衣壳与空衣壳。之前,我们已经展示了 Capto™ Q ImpRes 层析填料如何实现约 60% 至 70% 的 VG 回收率和约 40% 至 60% 的完整衣壳富集。为了进一步提高完整衣壳回收率和纯度,我们将展示含右旋糖酐表面填充剂、氯化镁 (MgCl2) 和洗脱盐类型(特别是对于 rAAV9)的 Capto™ Q 填料如何显著提高分离水平。最后,我们发现,使用 Capto™ Q(在洗脱缓冲液中加入乙酸钠)和一步法洗脱可显著提高所有检测血清型的 VG 收率,并使完整衣壳纯度提高约 80%,甚至更高。
简介
AAV 是用于基因治疗的主要载体,且目前对可放大、经济高效且可靠的过滤和层析纯化工艺的需求日益增加。AAV 工作流程成功进行的关键之一是提高完整衣壳的总回收率和高效去除空衣壳杂质。
我们开发的重组 AAV5 (rAAV5) 全流程 AAV 工艺见图 1,各步骤的描述见以下文件:
- 在悬浮细胞中生产 AAV 载体的细胞培养工艺开发
- 使用一次性生物反应器在悬浮 HEK293 细胞中生产腺相关病毒
- 优化 rAAV 纯化工艺中的捕获和精纯步骤
- 使用 Biacore™ 表面等离子共振对腺相关病毒进行滴度分析
- 重组腺相关病毒血清型 5 的生产工艺
我们使用相同的 AAV 工作流程,在悬浮液中对 HEK 293T 细胞进行三质粒转染,生成不同的 rAAV 血清型。通过细胞裂解收获 rAAV,用 DNA 核酸酶处理裂解物,澄清、浓缩、更换缓冲液,然后进行亲和捕获。亲和捕获步骤本身不能区分完整衣壳与空衣壳,因此需要进行精纯步骤,以便在不对 VG 收率产生负面影响的情况下尽可能多地去除空衣壳。
图 1. rAAV 生产工艺概览。本文重点阐述如何开发和改进适用于一系列 rAAV 血清型的阴离子交换精纯步骤。
利用完整衣壳 (pI 5.9) 与空衣壳 (pI 6.3) 之间的平均 pI 的微小差异,可通过离子交换层析实现完整衣壳与空衣壳的分离。然而,通常无法实现两者的完全分离,且存在峰重叠。因此,优化方案以实现最大程度的分离至关重要。
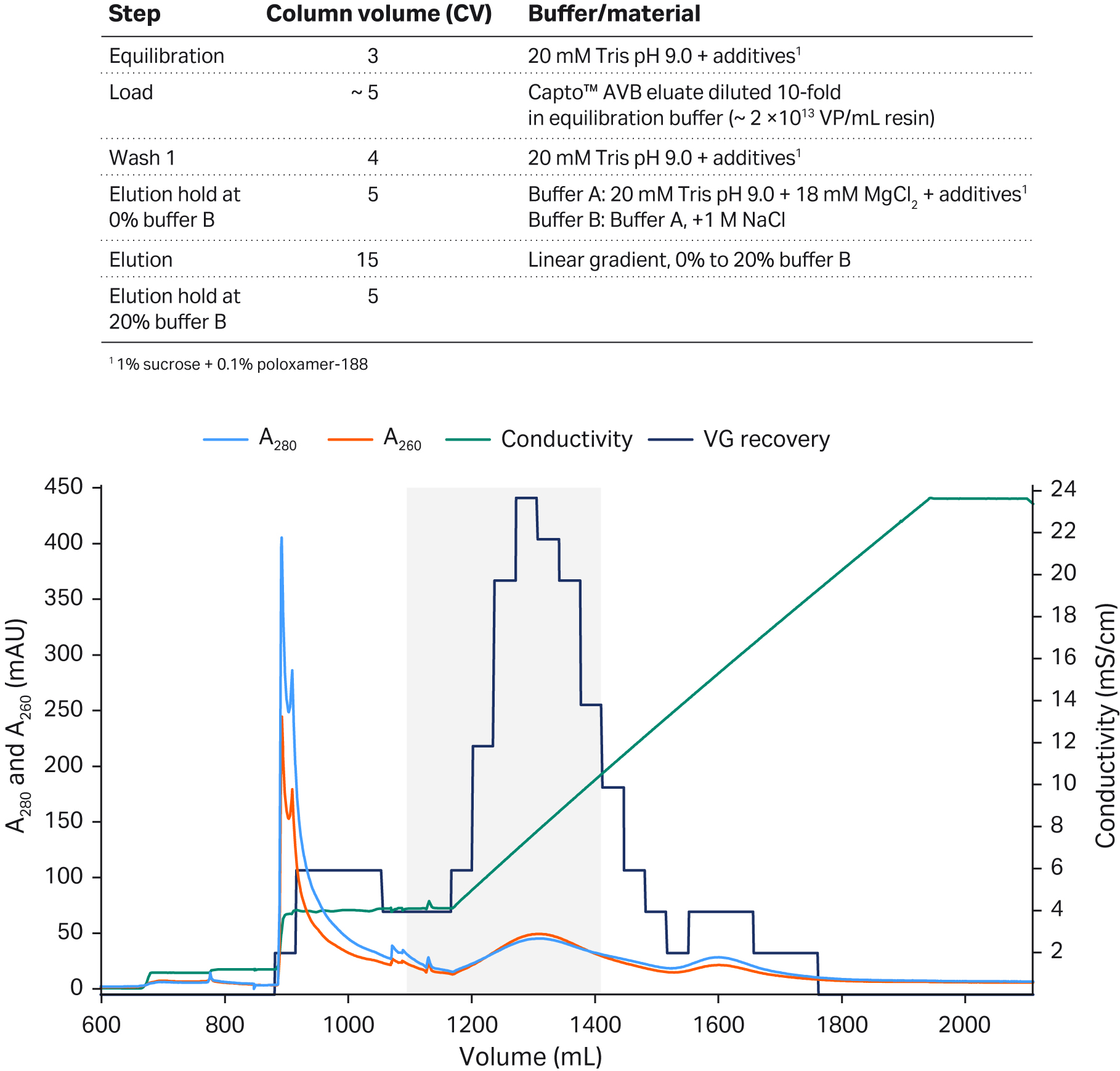
我们之前已经展示了如何使用 Capto™ Q ImpRes 阴离子交换填料(不含与配基对应的右旋糖酐表面填充剂)来分离 rAAV5 完整衣壳与空衣壳(图 2)。在精纯步骤中,我们开发了适用于 rAAV5 的阴离子交换方案,即首先在高 MgCl2 浓度 (18 mM) 下洗脱空衣壳,然后应用 NaCl 梯度洗脱完整衣壳(MgCl2 浓度保持恒定,为 18 mM)。
在使用梯度洗脱的情况下,我们观察到完整衣壳回收率为 60% 至 70% 和 40% 至 65%(根据 qPCR:ELISA 比值确定),具体取决于浓缩策略(图 2)。我们发现 VG 回收率与完整衣壳百分比之间存在此消彼长的关系。第一个峰主要包含空衣壳,而第二个峰包含完整衣壳(通过 qPCR:ELISA 比值确认)。UV260:280 比值刚刚超过 1.0,表明第二个峰的样本中仍含有空衣壳 (1)。
图 2. 使用 Capto™ Q ImpRes 阴离子交换 (AIEX) 层析填料分离 rAAV5 完整衣壳与空衣壳。优化方案包括了以下洗脱步骤:使用 18 mM MgCl2 洗涤液洗脱空衣壳,然后使用 NaCl 线性梯度洗脱完整衣壳。灰色阴影区域表示含有最高百分比完整衣壳和足够高的病毒基因组回收率的合并区域。
基于这些结果,我们开发了适用于多种 rAAV 血清型 — rAAV2、rAAV5、rAAV8 和 rAAV9 的优化精纯纯化方案。在本文中,我们会向您展示如何通过以下方法改进精纯步骤,从而获得超过 80% 的 VG 回收率和完整衣壳纯度:
- 使用含右旋糖酐表面填充剂的阴离子交换层析 (AIEX) 填料(Capto™ Q 填料)
- 优化洗脱缓冲液中 MgCl2 和乙酸钠的浓度,以及
- 使用梯度而非线性梯度进行洗脱
MgCl2和右旋糖酐填充剂可提高完整衣壳与空衣壳的分离水平
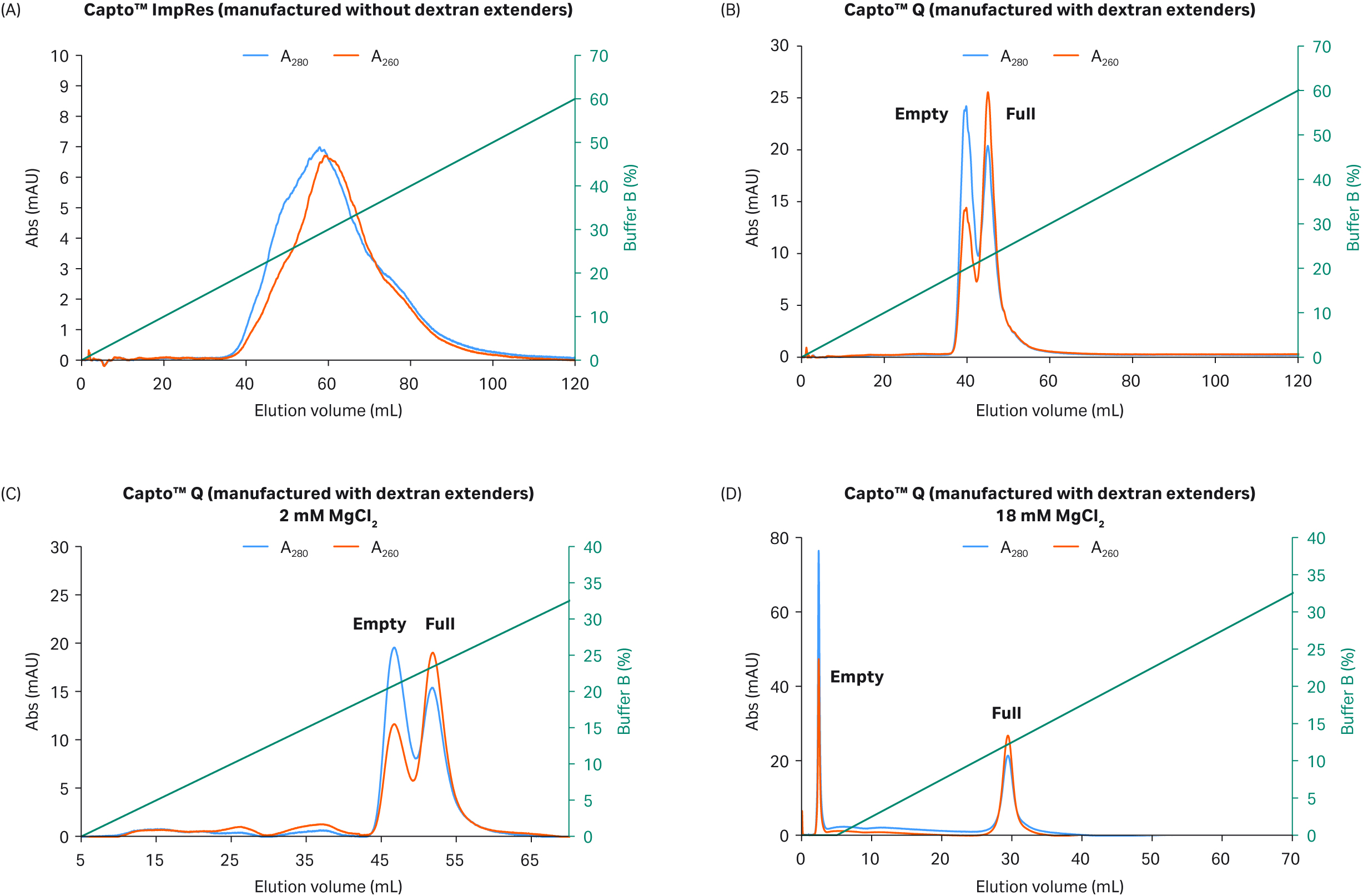
Capto™ Q ImpRes 填料上不含右旋糖酐填充剂,导致峰重叠较大,而 Capto™ Q 填料中的右旋糖酐填充剂提高了 rAAV8 的分离水平,并减少了重叠峰,从而产生了两个可见峰,其 UV 260:280 比值有所变化,即第一个峰的比值较低,第二个峰的比值较高(图 3A 和 B)。Capto™ Q 填料中的右旋糖酐填充剂与缓冲液 A 中恒定的高 (18 mM) 浓度 MgCl2 相结合时,该效应进一步增强(图 3C 和 D)。
如图 3C 中层析图谱所示,使用 2 mM MgCl2时峰可分离,但存在明显的峰重叠。而使用含 18 mM MgCl2 的缓冲液时,可首先洗脱空衣壳,然后应用 NaCl 梯度洗脱完整衣壳,从而获得分离良好的峰,且在线性 NaCl 梯度中洗脱提前(图 3D)。尚不清楚 MgCl2 提高分离水平的机制,但可能是因为 Mg2+ 离子与完整衣壳和空衣壳的结合存在差异,反过来影响了与阴离子交换配基的结合。
层析柱:填充 Capto™ Q ImpRes 或 Capto™ Q 填料的 Tricorn™ 5/100、2 mL 层析柱
样本:约 1 × 1012 rAAV8 病毒颗粒 (VP)(通过 qPCR:ELISA 测定含 35% 至 40% 完整衣壳)
缓冲液 A:20 mM BTP(pH 值 9.5)、2 mM MgCl2 + 1% 蔗糖和 0.1% 泊洛沙姆 188 添加剂
缓冲液 B:缓冲液 A + 400 mM NaCl
梯度:用缓冲液 B 进行线性梯度洗脱,0 至 200 分钟
流速:1 mL/min
图 3.在含有 2 mM MgCl2 的情况下,使用 (A) Capto™Q ImpRes(不含右旋糖酐表面填充剂)与 (B) Capto™ Q(含表面填充剂)分离 rAAV8 衣壳。还显示了使用 2 mM MgCl2 (C) 和使用 (D) 18 mM MgCl2 时 Capto™ Q 的分离性能。以最高达 400 mM 的递增 NaCl 线性梯度进行洗脱。
通过梯度洗脱进一步改善分离纯化结果
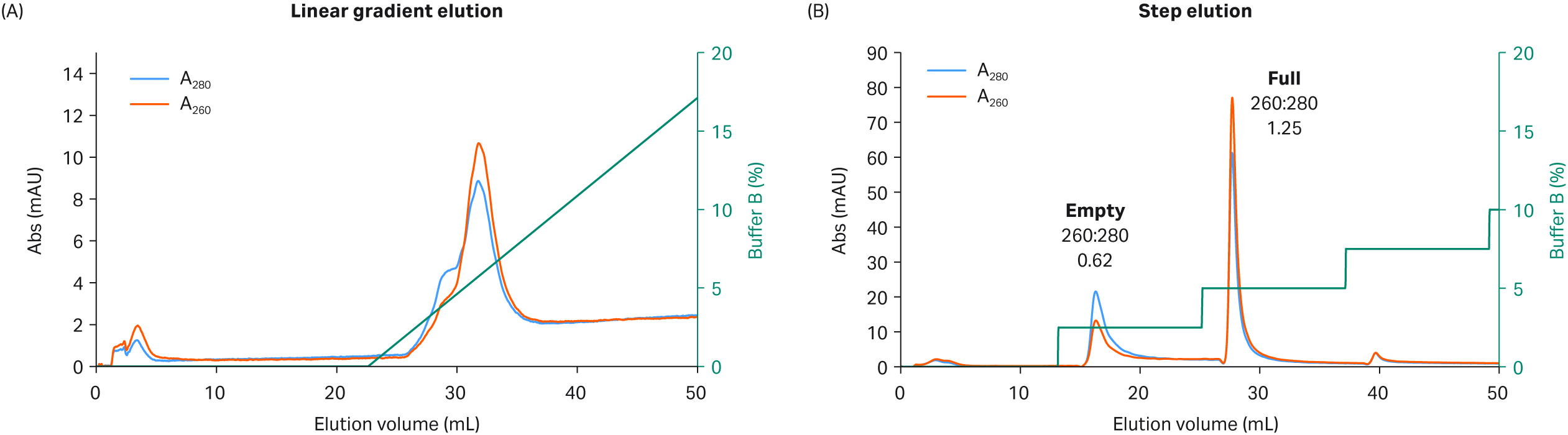
梯度洗脱方法允许实验条件存在微小变化 — 其优势在于,当完整衣壳/空衣壳的基线分离不完全且峰存在重叠时,可灵活合并完整衣壳百分比最高的部分。然而,一步法洗脱方案改善了分离性能(可能会实现基线分离),并可简化大规模 GMP 生产的工艺。不同于平缓线性梯度期间电导率的缓慢变化,一步法洗脱期间电导率变化较快(脉冲),明显提高了完整衣壳与空衣壳的分离水平。以较高盐浓度进行第二步洗脱前,空衣壳似乎可更有效地以更高选择性从阴离子交换配基中释放,而完整衣壳仍与层析柱结合。与较易分离的 rAAV8 血清型相比,通过更具挑战性的 rAAV5 完整衣壳与空衣壳的分离证明了这一点,见图 4。
采用 Capto™ Q 填料使用 18 mM MgCl2 洗涤液获得了良好的分离水平,如果同时采用一步法洗脱方案会进一步提高分离水平,优于使用线性 NaCl 梯度时获得的分离水平(图 4)。使用线性梯度洗脱时,rAAV5 分离效果不佳,空衣壳会作为第二个完整衣壳峰的肩峰首先洗脱(图 4A)。
而使用一步法洗脱时,获得了两个分离良好的峰,完整衣壳百分比较高,通过图 4B 第二个峰中 UV 260:280 nm 比值 (> 1.2) 增加可看出这一点。层析图谱显示了通过从梯度洗脱转换至一步法洗脱可获得的改善,并强调了 Capto™ Q 填料上右旋糖酐填充剂的重要性。
层析柱:填充 Capto™ Q 填料的 Tricorn™ 5/100、2 mL 层析柱
样本:rAAV5
样本上样量:1.6 × 1012 VP(通过 qPCR:ELISA 测定约含 60% 完整衣壳)
缓冲液 A:20 mM BTP(pH 值 9.5)+ 18 mM MgCl2 + 添加剂(1% 蔗糖 + 0.1% 泊洛沙姆 188)
缓冲液 B:缓冲液 A + 400 mM NaCl
流速:2 mL/min
梯度:使用 40 柱体积 (CV) 的缓冲液 B 进行梯度洗脱。使用缓冲液 B (6 CV):2.5%、5%、7.5%(10 mM NaCl 增量)进行一步法洗脱。
系统:ÄKTA pure™ 25
检测:260 nm 和 280 nm
图 4.使用 Capto™Q 以 (A) 线性梯度洗脱或 (B) 一步法洗脱方案在恒定的高浓度 MgCl2 (18 mM) 和 NaCl(作为洗脱盐)下分离 rAAV5 完整衣壳与空衣壳。
开发适用于多种 rAAV 血清型的单一精纯方案
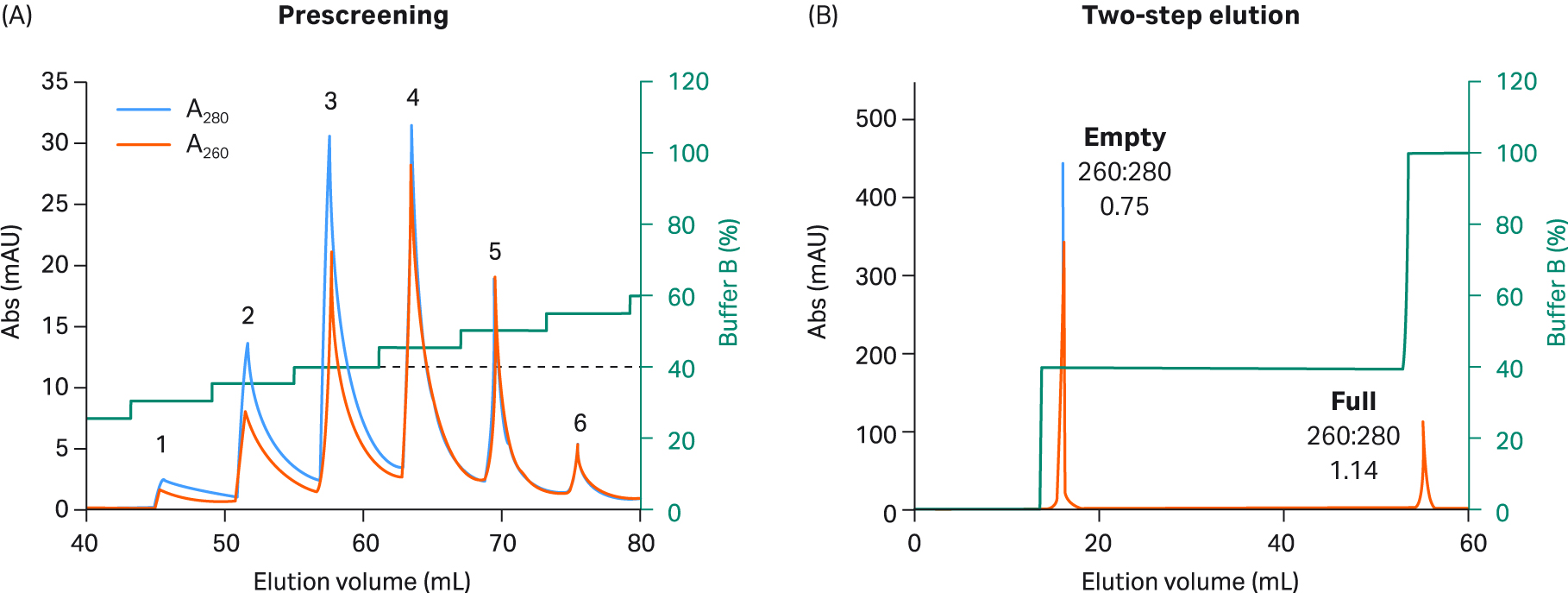
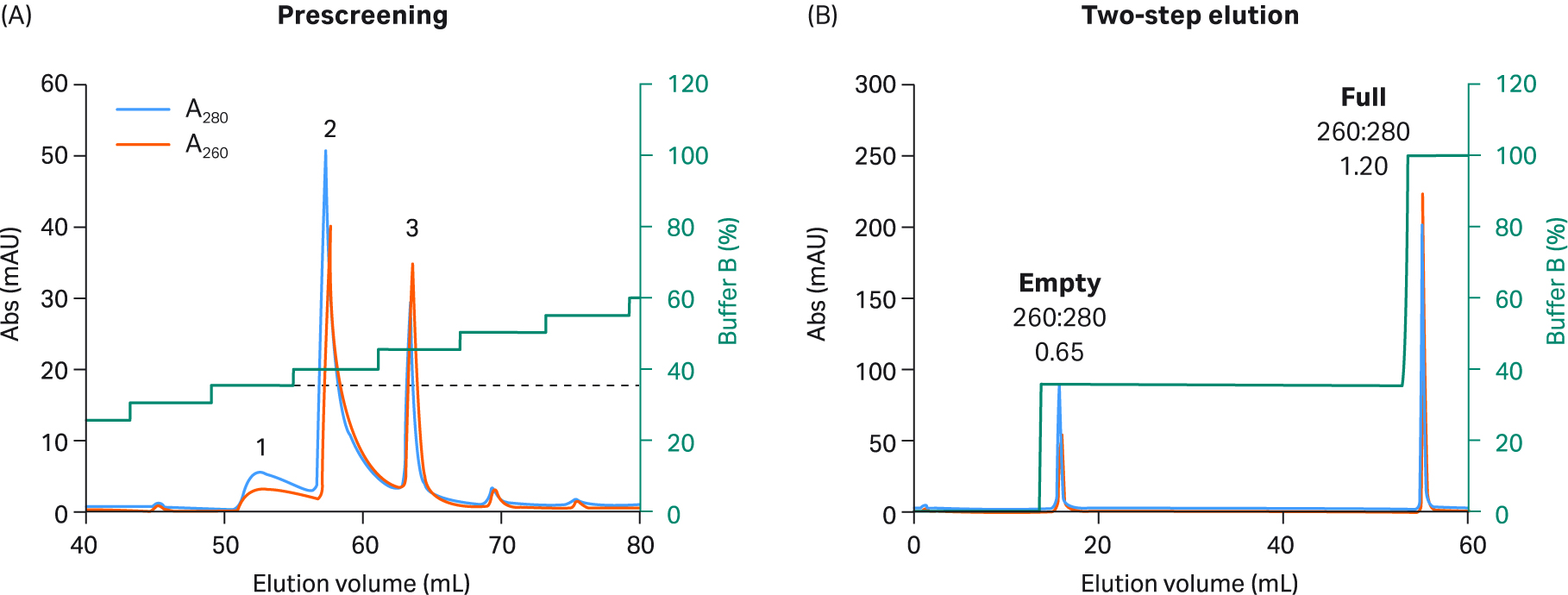
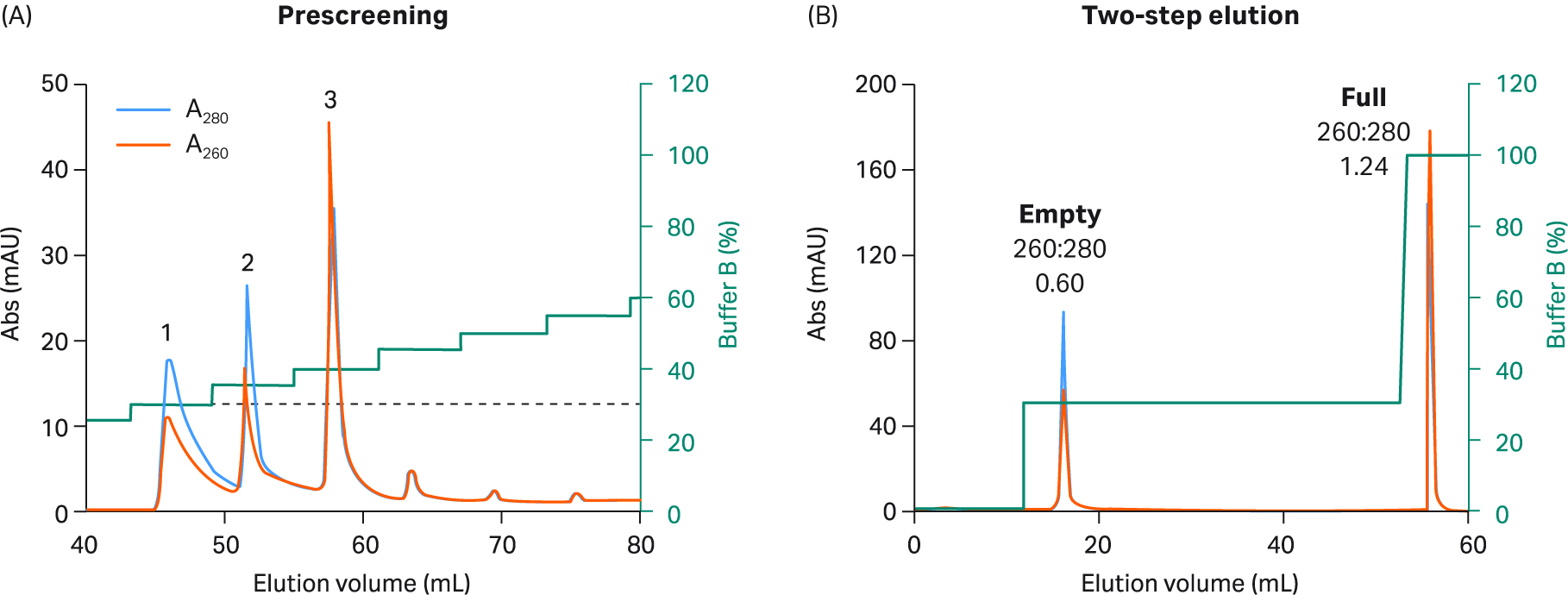
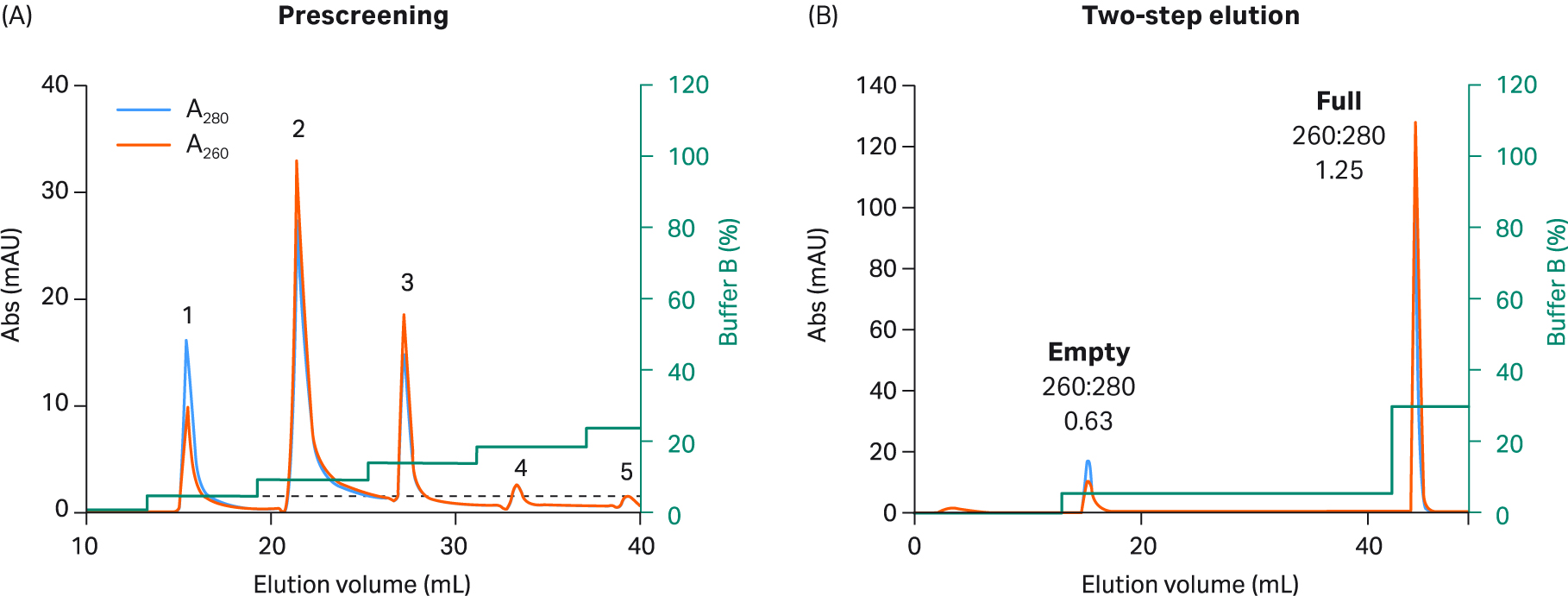
我们探索了使用 AIEX 以及 Capto™ Q 和两步洗脱方案在重组 AAV2、AAV5、AAV8 和 AAV9 血清型中分离完整衣壳与空衣壳的情况。最终我们开发出一种对所有四种血清型均有效的优化一步法洗脱方案。我们还对该方案进行了设计,从而兼容 AAV9(AAV9 与阴离子交换填料的结合较弱)。我们使用了 20 mM 双-Tris 丙烷 (BTP)(pH 值 9.0),其中含恒定浓度的 2 mM MgCl2,不含添加剂。此外,我们用乙酸钠替换了 NaCl 作为洗脱盐,乙酸钠是一种更温和、结构增强性(秩序促进)更高的盐。使用增量为 5% 的洗脱缓冲液(缓冲液 B)步骤,每个步骤 3 CV,在预筛选程序中确定洗脱空衣壳所需的洗脱条件(图 5 至 8,子图 A)。
进行这些小增量洗脱步骤时,可洗脱出几个峰,前一个或两个峰含有空衣壳,之后中间的峰含有完整衣壳和空衣壳的混合物,最后一个峰含有完整衣壳。通过不同峰的 UV 260:280 比值从低到高的变化可看出这一点。该缓冲液系统不易产生背景紫外信号,这一点可在不含 rAAV 样本的情况下通过单独使用缓冲液获得的空白运行测得(未显示数据)。
优化两步洗脱方案
根据我们的预筛选结果,我们使用在空衣壳洗脱开始后以及完整衣壳洗脱前(完整衣壳漏入空衣壳峰)的缓冲液 B 百分比进行第一步。参见图 5 至 8 的子图 A 中的虚线。我们还将步骤 1 扩展至 20 CV,以最大限度地去除空衣壳。然后,采用 100% 缓冲液 B 或较低浓度(取决于预筛选运行中完整衣壳的洗脱浓度)进行第二个较短步骤 (5 CV),以洗脱完整衣壳。
最终两步洗脱的结果见图 5 至 8 子图 B。rAAV2 的起始物料中完整衣壳百分比非常低,第二个完整衣壳峰较小,UV260:280 比值略低于其他血清型的比值(表 1)。rAAV2 的富集因子非常高,如紫外比值变化所示,完整衣壳从 7% 变化为 > 70%(基于 1.14 的 UV260:280 比值估计得出)。各个峰的 UV260:280 比值可很好地指示层析图谱中的纯化程度。我们还通过 qPCR (VG) 与 ELISA(病毒颗粒,VP)比值分析确认了一般观察结果,并计算了 VG 回收率(表 1)。
qPCR:ELISA 比值可能会变化,因而结果不明确;然而,峰 1 和峰 2 的 UV260:280 比值与 qPCR:ELISA 结果结合在一起,明确表明峰 2 中完整衣壳回收率极佳,且完整衣壳百分比较高。我们建议在可能的情况下加用分析超速离心 (AUC)、分析离子交换 (IEX) 或透射电子显微术 (cryoTEM) 等正交法,将分析方法结合起来,以最大限度地提高准确度。
Capto™ Q ImpRes 和 Capto™ Q 填料的载量估计至少为 1 至 3 × 1013 VP/mL 填料。UV260:280 比值为 0.6 至 0.7 表示主要为空衣壳,而比值 > 1.2 表示主要为纯完整衣壳。可以考虑特定血清型的消光系数,并将其用于计算 rAAV 浓度,以获得更高的准确度 (1)。插入片段尺寸以及存在少量 HCP 或 DNA 可影响紫外值。我们建议使用 10 mm 径长的紫外检测器,以达到足够的检测灵敏度,从而获得更准确的 UV260:280 比值。
预筛选方案
层析柱:填充 填充 Capto™ Q 填料的 Tricorn™ 5/100、2 mL 层析柱
样本上样量:~ 1 × 1012 VP/mL 填料
缓冲液 A:20 mM BTP(pH 值 9.0)、2 mM MgCl2
缓冲液 B:20 mM BTP(pH 值 9.0)、2 mM MgCl2、250 mM 醋酸钠
平衡液:缓冲液 A,5 CV
洗涤液:缓冲液 A,5 CV
梯度:一步法洗脱,5% 增量,各 3 CV
流速:2 mL/min
系统:ÄKTA pure™ 25
两步方案
层析柱:Capto™ Q Tricorn™ 5/100、2 mL 层析柱
样本上样量:(1 × 1012 VP/mL 填料)
缓冲液 A:20 mM BTP(pH 值 9.0)、2 mM MgCl2
缓冲液 B:20 mM BTP(pH 值 9.0)、2 mM MgCl2、250 mM 醋酸钠
平衡液:缓冲液 A,5 CV
洗涤液:缓冲液 A,5 CV
梯度:如下所述对各血清型进行两步洗脱:
rAAV2:步骤 1 40% 缓冲液 B,20 CV
步骤 2 100% 缓冲液 B,5 CV
rAAV5:步骤 1 35% 缓冲液 B,20 CV
步骤 2 100% 缓冲液 B,5 CV
rAAV8:步骤 1 30% 缓冲液 B,20 CV
步骤 2 100% 缓冲液 B,5 CV
rAAV9:步骤 1 5% 缓冲液 B,20 CV
步骤 2 30% 缓冲液 B,5 CV
流速:2 mL/min
系统:ÄKTA pure™ 25
图 5.(A) 使用 5% 增量、缓冲液 B 和 Capto™ Q 填料进行预筛选,以选择适用于 rAAV2 的两步洗脱条件。rAAV2 空衣壳在前三个峰中洗脱。完整衣壳和空衣壳的混合物在第 4 个峰中洗脱。最后,完整衣壳在第 5 个峰和第 6 个峰中洗脱。 根据预筛选期间实现第一个空衣壳峰洗脱而不发生完整衣壳洗脱渗漏所需的浓度,选择适用于步骤 1 的缓冲液 B 百分比(虚线)。(B) 对于最终 rAAV2 2 步方案,在步骤 1 中使用 20 CV 40% 缓冲液 B(对应于预筛选峰 3),随后在步骤 2 中使用 5 CV 100% 缓冲液 B。
图 6. (A) 使用 5% 增量、缓冲液 B 和 Capto™ Q 填料进行预筛选,以选择适用于 rAAV5 的两步洗脱条件。预筛选期间,rAAV5 被分为较少的峰,且洗脱第一个空衣壳峰所需的缓冲液 B 百分比较低。(B) 对于最终 rAAV5 2 步方案,在步骤 1 中使用 20 CV 35% 缓冲液 B(对应于预筛选期间的峰 1),随后在步骤 2 中使用 5 CV 100% 缓冲液 B。
图 7. (A) 使用 5% 增量、缓冲液 B 和 Capto™ Q 填料进行预筛选,以选择适用于 rAAV8 的两步洗脱条件。与 rAAV5 相似,rAAV8 也被分为较少的峰,且洗脱第一个空衣壳峰所需的缓冲液 B 百分比更低。(B) 对于最终 rAAV8 2 步方案,在步骤 1 中使用 20 CV 30% 缓冲液 B(对应于预筛选期间的峰 1),随后在步骤 2 中使用 5 CV 100% 缓冲液 B。
图 8. (A) 使用 5% 增量、缓冲液 B 和 Capto™ Q 填料进行预筛选,以选择适用于 rAAV9 的两步洗脱条件。rAAV9 的相互作用与其他血清型不同。因此,步骤 1 中所需的缓冲液量要少得多。(B) 对于最终 rAAV9 2 步方案,在步骤 1 中使用 20 CV 5% 缓冲液 B,随后在步骤 2 中使用 5 CV 30% 缓冲液 B。您也可以在步骤 2 中使用 100% 缓冲液 B,但 rAAV9 结合力较弱,因此不需要这样做。
通过洗脱空衣壳所需的缓冲液 B 的量,明确证明了血清型之间的结合强度关系(图 9)。
图 9 中所示的电导率数值适用于本方案中使用的缓冲液系统和 pH 值。
使用另一种缓冲液时,相同电导率可能会得出不同的结果。洗脱空衣壳所需的确切电导率也可能受特定衣壳结构和所用插入片段尺寸的影响。具有 GFP 插入片段的衣壳与阴离子交换填料的相对结合强度为:rAAV9 < rAAV8 < rAAV5 < rAAV2,洗脱所需缓冲液 B 百分比递增可反映出这一点(图 9)。
我们建议确保负载材料的电导率在 1 至 3 mS/cm 之间,以避免分离不良或所有材料在未结合的情况下流过的风险。这可通过在精纯步骤之前中和及稀释亲和捕获洗脱液来实现。对于与阴离子交换填料结合力较弱的 rAAV9,我们建议负载电导率应低于 2 mS/cm。
图 9.不同 rAAV 血清型与阴离子交换填料的相对结合强度不同,洗脱所需缓冲液 B 百分比递增可反映出这一点。
表 1.Capto™ Q 层析填料上四种 rAAV 血清型的完整衣壳与空衣壳的分离结果以及 VG 回收率的总结
| 血清型 | 起始样本 | 第 1 个峰(空衣壳)1 | 第 2 个峰(完整衣壳)1 | ||||
| qPCR:ELISA(完整衣壳,%) | UV 260:280(峰面积) | VG 回收率2 (%) | qPCR:ELISA(完整衣壳,%) | UV 260:280(峰面积) | VG 回收率2 (%) | qPCR:ELISA(完整衣壳,%) | |
| rAAV2 | 7.0 至 10.0 | 0.75 | 不适用 | 不适用 | 1.14 | 不适用 | 不适用 |
| rAAV5 | 47.0 | 0.65 | 7.0 | 5.0 | 1.20 | 80 | 100 |
| rAAV8 | 11.0 至 35.0 | 0.60 | 3.0 | 1.0 | 1.24 | 80 | 95 |
| rAAV9 | 40.0 | 0.63 | 0.3 | 1.0 | 1.25 | 91 | 100 |
1基于总紫外信号的紫外吸光度质量平衡为 70% 至 100%。
2VG = 病毒基因组。
结论
- Capto™ Q ImpRes 可使完整衣壳的富集达到大约 50%,但含右旋糖酐表面填充剂的 Capto™ Q 可提高分离水平,使 VG 收率和纯度提高约 80%,甚至更高。
- MgCl2 在洗涤和洗脱步骤中至关重要 — Mg2+ 离子显示与完整衣壳和空衣壳的结合存在差异,并可提高分离水平,但尚不清楚相互作用的确切机制。
- 一步法洗脱的分离效果显著优于梯度洗脱。
- 建议进行预筛选,以确定最佳一步法洗脱条件。
- 使用 20 mM BTP(pH 值 9.0)、2 mM MgCl2 以及 250 mM 乙酸钠(作为洗脱盐),我们的单一缓冲液解决方案可实现多种 rAAV 血清型(rAAV2、rAAV5、rAAV8 和 rAAV9 [以及可能的其他血清型])的最佳分离。
- 上样前样本的电导率 < 3 mS/cm 或 < 2 mS/cm (rAAV9) 至关重要。
我们的在线学习课程在不断增加,您可以访问相关课程,学习用于基因治疗的病毒载体生成的基础知识
参考文献
- Dickerson R., Argento C., Pieracci J., Bakhshayeshi M. Separating empty and full recombinant adeno-associated virus particles using isocratic anion exchange chromatography. BioTechnology J. 2020;16(1).
- Venkatakrishnan B, Yarbrough J, Domsic J, Bennett A, Bothner B, Kozyreva OG, Samulski RJ, Muzyczka N, McKenna R, Agbandje-McKenna M. Structure and dynamics of adeno-associated virus serotype 1 VP1-unique N-terminal domain and its role in capsid trafficking. J Virol. 2013 May;87(9):4974–4984. Epub 2013 Feb 20. PMID: 23427155; PMCID: PMC3624325.