本研究中,来自 Cytiva 和 CCRM 的科学家们开发了一种可放大性的工艺,使用稳定的、基于悬液的生产方法生产多批高产量慢病毒载体。
关键点:
- 现有的慢病毒载体生产方法成本高昂、劳动密集且难以规模化。
- 该团队通过全新的制造工作流程解决了上述问题,该流程包括:基于悬浮细胞的培养、从瞬转到稳定转染的转变。
- 该研究实现了一种简单且无需使用动物源性成分的批量处理工艺。该工艺适用于从实验室进行规模放大到生产规模。
落后的生产现状
经过数十年的基础研究和小型学术试验,细胞和基因治疗已经正式到来。多项计划已获得美国食品药品监督管理局 (FDA) 和欧洲药品管理局 (EMA) 的批准,其中包括多项宏大的 CAR T 细胞疗法计划。另外,更多的产品即将步入商业化阶段。但就目前而言,大规模制造技术和基础设施的发展仍较为落后。
用于细胞和基因治疗产品生产的一种关键且昂贵的原材料就是一种可将遗传物质引入细胞的病毒载体(LV)。当前生产大多采用手动的方法,其规模有限,限制了病毒载体的生产并导致慢病毒载体 (LV) 突然间供不应求。
现阶段慢病毒生产水平可以支持小型探索性研究,但不足以支持后期临床试验和商业化的需要。我们迫切需要新型的、可放大的、高效且稳健的病毒生产工艺来支持免疫疗法和基因治疗的商业化。
考虑到这一点,我们开发了一种新的生产工作流程,以解决限制慢病毒生产效率和可放大性的两个技术挑战。这项稳健的工艺使用的是悬浮培养的生产细胞系,以更加简单的批量处理工艺实现慢病毒生产。利用一次性搅拌罐式生物反应器,成功实现产量从 5 L 到 28 L 的线性放大生产。
贴壁培养的可放大性是有限的
小规模生产通常使用贴壁 HEK293 细胞系,在含血清培养基中生产慢病毒载体。使用手动贴壁培养时,细胞在专为细胞贴壁和扩散而设计的基质上实现单层生长。这一过程缓慢且需要大量人力投入,并且其中使用的血清培养基可能会触发体内免疫反应。最重要的是,贴壁细胞培养方法难以根据不断发展的行业需求而扩大规模。病毒生产与可用表面积有关,而可用表面积反过来又限制了产品产量。
为了克服这些限制,一些学术和工业实验室一直致力于开发基于悬浮培养的生产工艺。与贴壁方法相比,悬液培养有几个优点。例如,生产规模可以从几毫升扩展到数千升。此外,悬液培养物更适合可实现自动化的全封闭式工艺。在高产量临床级慢病毒的生产中,这些策略能够降低成本、缩短用时,是实现商业化运营的关键一步。
在这项研究中,我们使用了一种能够在无血清条件下生长的悬浮细胞系,我们优化了搅拌罐式生物反应器中的饲养策略和条件,使得细胞生长和病毒生产状态得到明显改善。而成功生成这种稳定生产克隆 92 细胞系的关键因素就是使用双开关系统,使用该系统需要两种诱导剂来启动慢病毒的合成,从而严格控制慢病毒细胞毒性的产生 (1)。
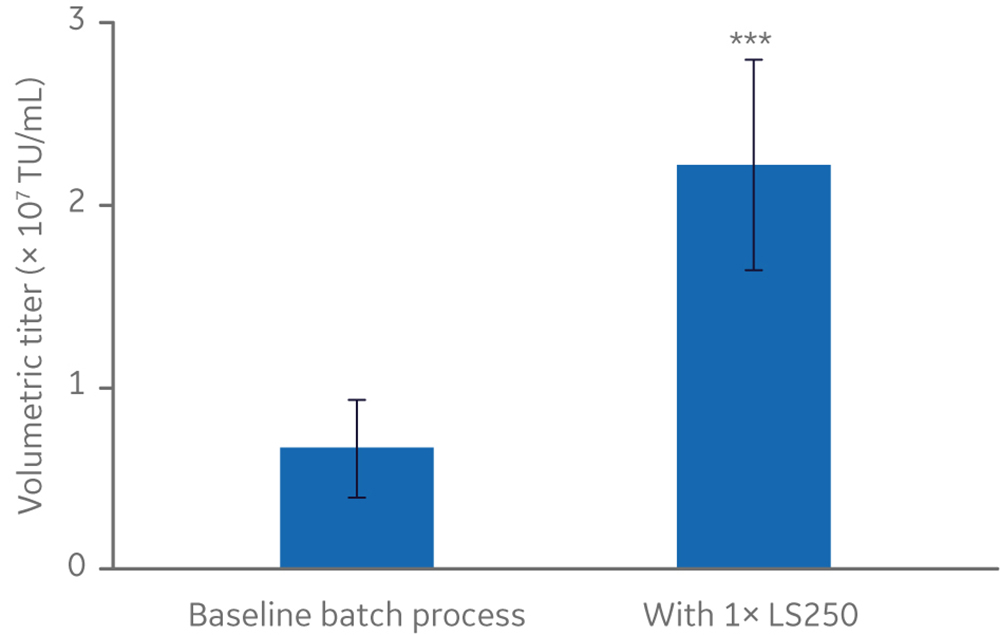
提高产量的一个方法就是,在批量生产过程中,可通过添加一种脂质补充剂使慢病毒效价增加三倍以上(图 1)。这一操作结合其他优化措施,成功在一台 Xcellerex 50 L 一次性生物反应器中提高了慢病毒的产量。
图 1. HyClone LS250 脂质补充剂提高摇瓶中的产量。
现有技术的转染效率低
大规模慢病毒生产的第二个主要障碍在于,它依赖多质粒瞬时转染的方法来引入新的遗传物质。虽然这一方法被广泛应用,但由于原材料昂贵,该方法用于大规模生产时成本很高。此外,该方法也容易引入污染,相较于稳定的细胞系,稳定性较差。
尽管可诱导型稳定表达细胞系需要在前期投入大量时间和金钱,但从长远来看,它们更简单且规模化成本更低。因而,它们在商业规模制造中是一个很有吸引力的解决方案——前提是可以实现相同的慢病毒产量。其中一个关键挑战是确保 DNA 被有效转染,并且可以识别和分离转染成功的细胞。
通过使用来自于悬浮细胞包装细胞系的稳定转染得到的稳定的生产细胞系,加上整个过程的诱导条件和饲养策略的优化。例如,我们进行了一系列研究来确定在培养中的哪个节点诱导病毒生产。最终,提高了活细胞浓度,增加感染性病毒颗粒的总数。
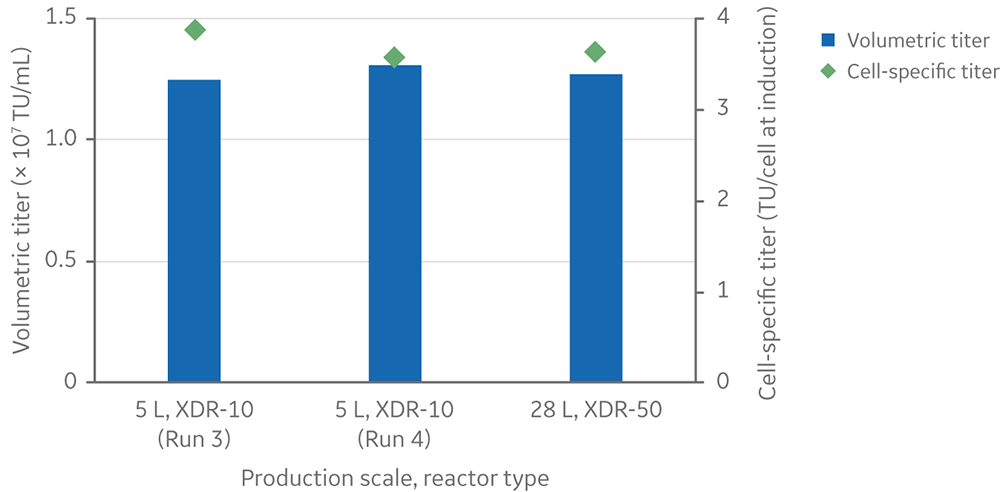
经证明,我们开发的这项工艺经过小幅调整后可将规模放大到 28 L,使用的是 50 L 的搅拌罐式生物反应器系统(图 2)。
图 2. 与两次 5 L 运行相比,28 L 运行的慢病毒载体效价。
总结
我们能够利用现有的生物制造专业知识和生物加工技术实现一致性批量生产,使规模线性扩大到 28 L。
结果:
- 提高产量:所使用的方法易于扩展,可实现慢病毒的商业规模生产。
- 一致性:所描述的封闭式工艺具备可重现性和稳健性。
- 降低成本:通过改进病毒生产、自动化、避免基于转染方法所需的昂贵原材料,使用无血清替代品减少了对昂贵的输注后免疫抑制剂的需求。
本研究为可扩展的高质量慢病毒生产提供了新的基准。生产商必须继续提高标准,以满足全球对已获批和即将获批的细胞和基因治疗的需求。
有关详细信息,请参阅可适应 GMP 合规要求的上游慢病毒载体工艺。
致谢
我们非常感谢加拿大国家研究委员会 (National Research Council of Canada) 的技术指导,感谢其为这些研究提供稳定的可诱导型慢病毒生产系。
所有工作均与 CCRM 合作进行,资金由 FedDev Ontario 和 Cytiva 在加拿大安大略省多伦多市的高级治疗细胞技术中心 (CATCT) 提供。由作者负责报告和解释研究结果。
参考文献
- Manceur, A. P.et al. Scalable lentiviral vector production using stable HEK293SF producer cell lines. Hum.Gene Ther.Methods28, 330–339 (2017).