挑战
许多 CAR T 细胞生产工艺依赖手动和开放式操作,这给商业生产带来了风险。细胞和基因治疗行业需要减少手工操作、缩短生产时间和降低成本,同时确保 GMP 合规性。
成熟的工艺
工艺开发工作为使用慢病毒转导的商业生产提供了半自动化、封闭的 CAR T 细胞工艺。成熟的平台工艺稳健、灵活,能够满足 CAR T 开发人员的各种需求。同时确保过程符合GMP规范。
结果
成熟的工艺实现了:
- 8 天内平均细胞扩增 > 78 倍,转导 T 细胞达到 > 1.0 x 1010 个。
- 使用慢病毒载体时,增强型绿色荧光蛋白 (eGFP) 的转导效率超过 80%。
- 工艺高度自动化和封闭,具有灵活的模块化平台,可满足不同需求。
对改善 CAR T 生产的需求
随着嵌合抗原受体 T (CAR T) 细胞疗法在临床上的成功,需要对 CAR T 生产工艺进行改进,使之能够被细胞和基因治疗行业广泛采用。目前,CAR T 工作流程依赖于多个手动、开放且冗长的操作。在本研究中,我们开发了一种稳健的 CAR T 细胞生产工艺,使用了支持封闭处理的设备和试剂。该工艺使用自动化来降低生产成本和提高工艺一致性,同时具备灵活性,能够满足 CAR T 开发人员的各种需求。
工艺开发方法
图 1 显示了成熟工艺的工作流程。该工艺从冷冻 leukopak 开始,到第 8 天将产品冻存在冻存袋中结束。
图 1. 成熟的半自动、封闭式 CAR T 细胞生产工艺的工作流程。工艺开始和结束时的细胞材料以灰色突出显示。中间的单元操作以白色突出显示。
结果和讨论
在研究开始时,我们选择了各种仪器和试剂来支持整个工作流程中的封闭式处理和自动化。我们对各方案进行了系统性测试,期望找到符合生产质量管理规范 (GMP) 的 CAR T 细胞生产解决方案。
Leukopak 解冻与 PBMC 分离
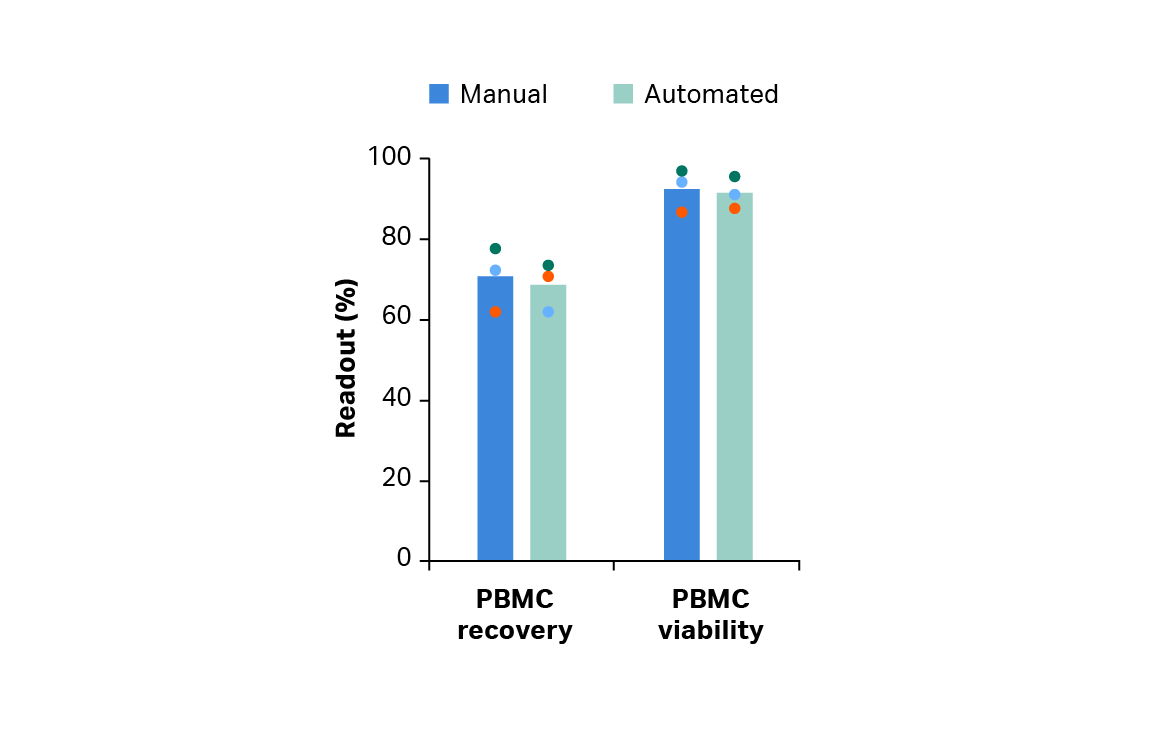
对于 leukopak 解冻和外周血单核细胞 (PBMC) 的控制分离分别选择 Smart-Max 器械*和 Sepax 2 系统。在对比时,Smart-Max 和 Sepax 2 显示出与手动方法相当的 PBMC 复苏率和活力(图 2)。
* 对于上游解冻,我们在 Smart-Max 仪器上使用了 Thaw-Large Volume 程序软件。另一种方法是在上游和下游处理中使用 VIA Thaw仪器。Thaw-Large Volume 程序软件即将推出。对任何产品的发布不做保证(我们保留更改任何产品发布计划和时间的权利)。
† 本研究中使用了 Sepax 2 细胞分离器械,也可使用 Sepax C-Pro。
图 2. 手动或自动解冻和洗涤后存活外周血单核细胞 (PBMC) 的复苏率和活力。柱状图表示三份生物样本的平均值,彩色点表示单个供体的值。
T 细胞富集、激活和慢病毒转导
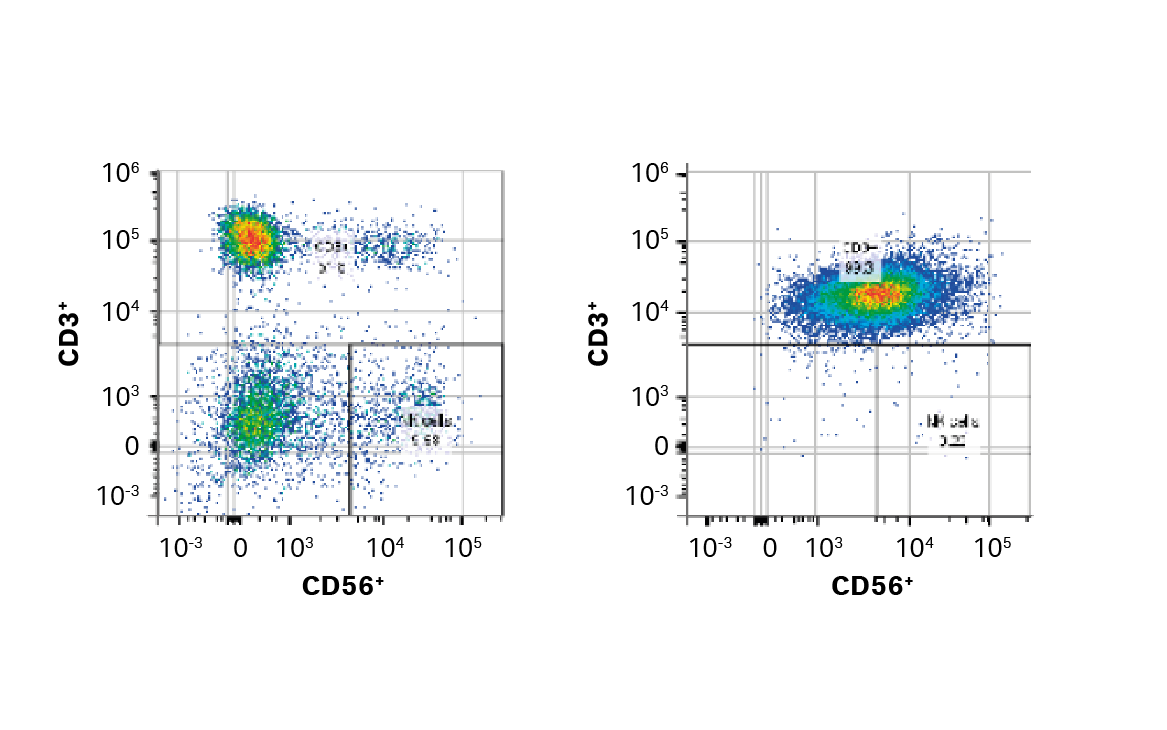
评估了三种 T 细胞富集方法。其中,我们选择了 EasySep™ Release Human CD3 正选试剂盒 (STEMCELL Technologies),其在第 5 天达到的纯度 > 99%(图 3),活力和扩增指标相当,并且与其他方法相比,复苏率和纯度相当或更优(复苏率显著高于其他正选方法;纯度显著高于阴选方法,p < 0.05)。
图 3. EasySep CD3+ 选择前后门控细胞的 FlowJo™ 表示。
为了在 T 细胞培养的前四至五天保持工艺封闭,我们确定了一个封闭的摇瓶平台。该平台显示的 T 细胞生长、活力和表型与手动 T 瓶培养相当。
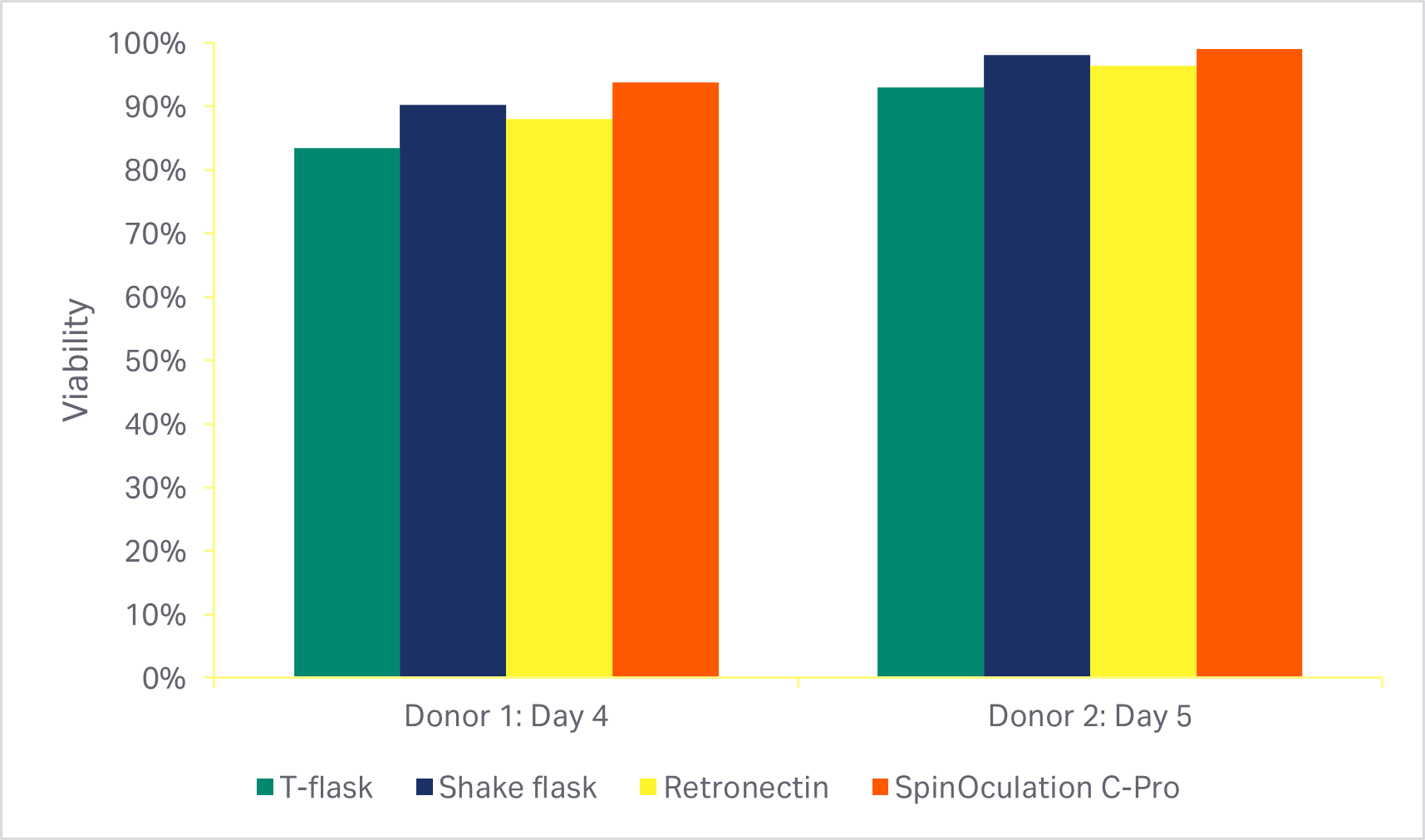
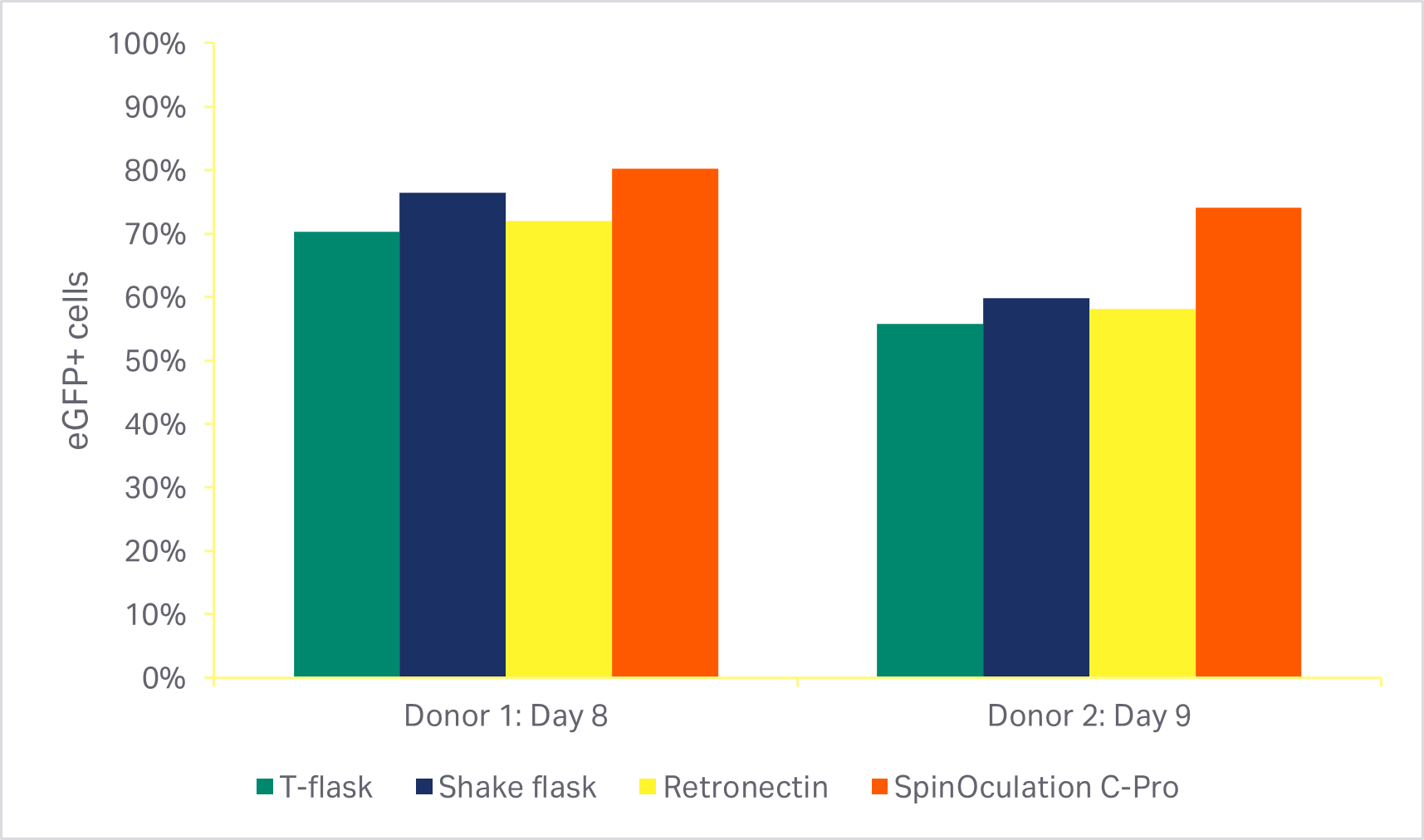
根据采用 Sepax C-Pro 系统和 SpinOculation C-Pro 程序软件的自动化、封闭式转导方法显示,在使用研究级 eGFP 慢病毒时,T 细胞转导效率 > 80%(图 4)。其他三种常用方法,包括 RetroNectin™ 涂板的活力和转导效率相当。
(A)
(B)
图 4. 各转导方法的比较(MOI 为 2.5)。(A) 培养激活阶段后(转导后 3 天或 4 天)使用各种转导方法的细胞的活力;(B) 培养结束时(转导后 7 天或 8 天)eGFP 阳性 T 细胞的百分比。柱状图代表两个生物供体的同组三份技术样本的平均值。
T 细胞扩增
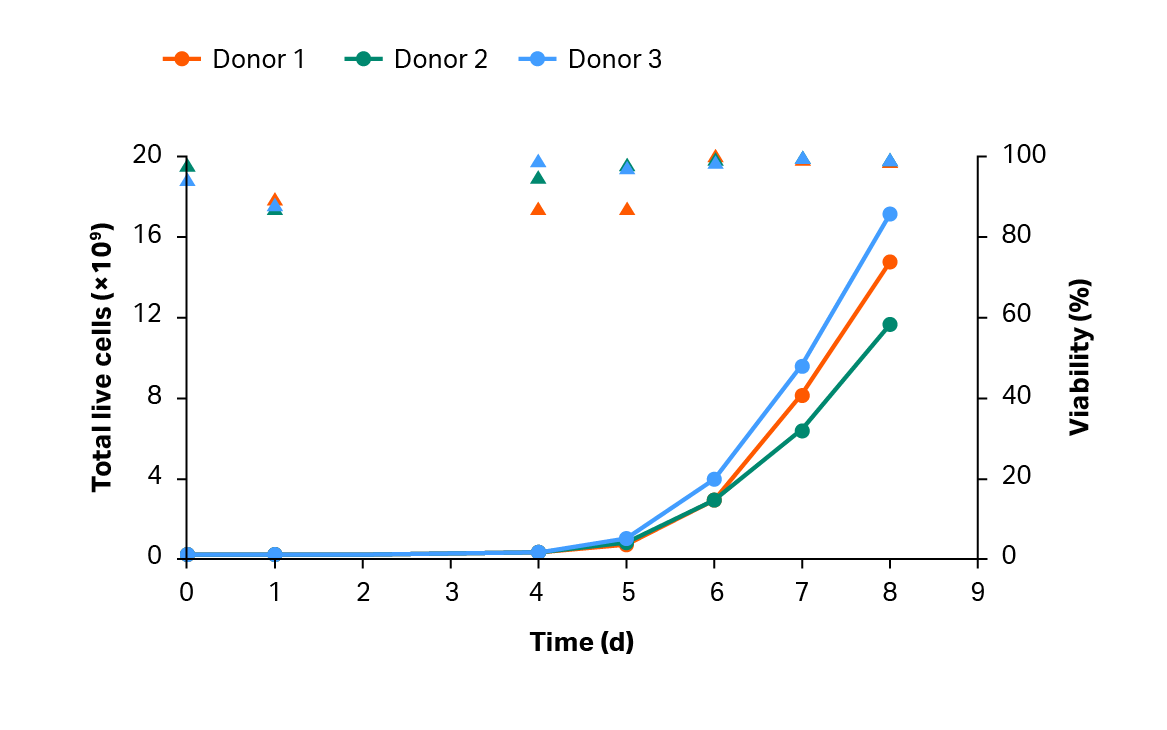
为了进一步减少手工操作和工艺的不稳定性,我们设计了一个封闭和受控的扩展策略。在三次大规模生产运行中,使用 Xuri W25 细胞扩增系统中对转导 T 细胞进行了扩增(图 5)。工艺第 8 天的产量为 > 1 × 1010 个转导 T 细胞(图 6)。
图 5. T 细胞的累积生长与活力。直线表示扩增谱,三角形表示 CAR T 工艺中的可行性。
(A)
(B)
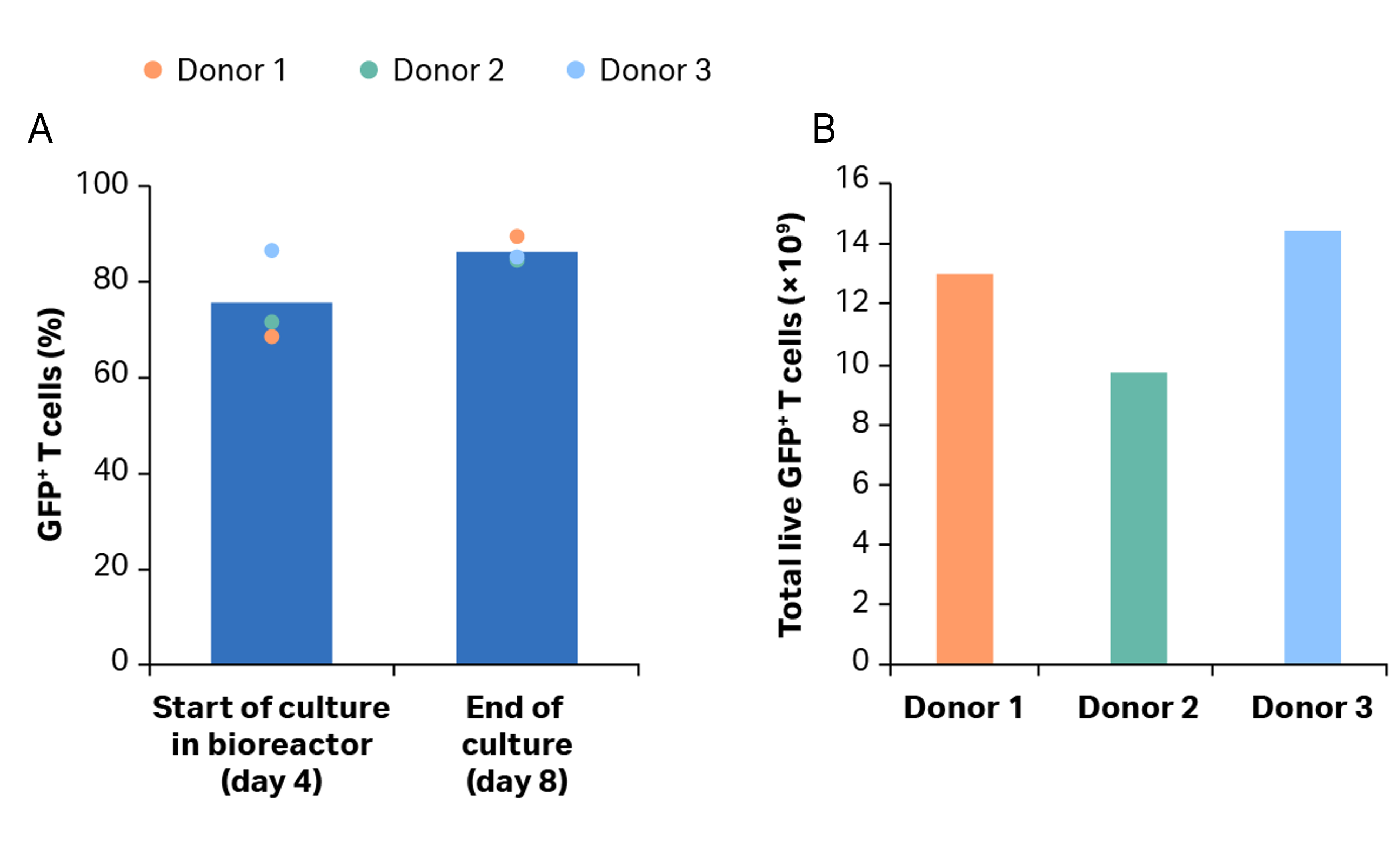
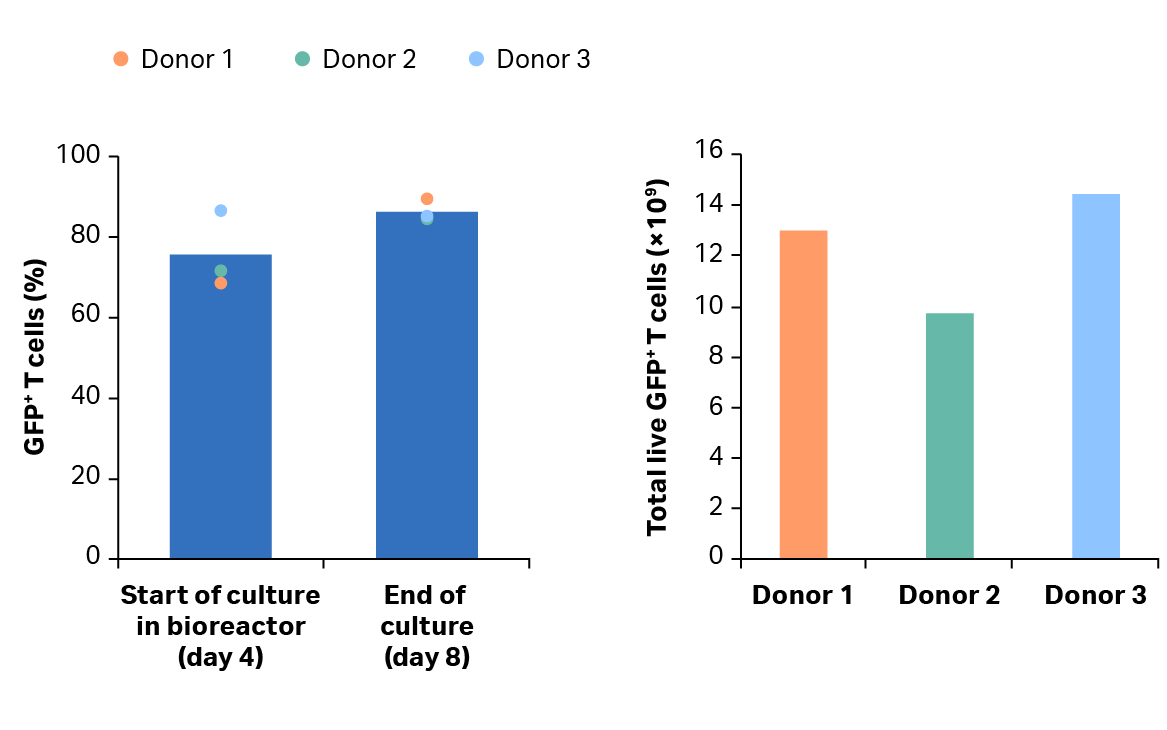
图 6. 转导效率。(A) 摇瓶激活和 Xuri 细胞扩增系统 W25 培养后转导的 GFP+ T 细胞的百分比。柱状图表示三份生物样本的平均值,彩色点表示单个供体的值;(B) 第 8 天供体 1、2 和 3 的 GFP+ T 细胞总量。
CAR T 细胞生产工作流程中的最终步骤
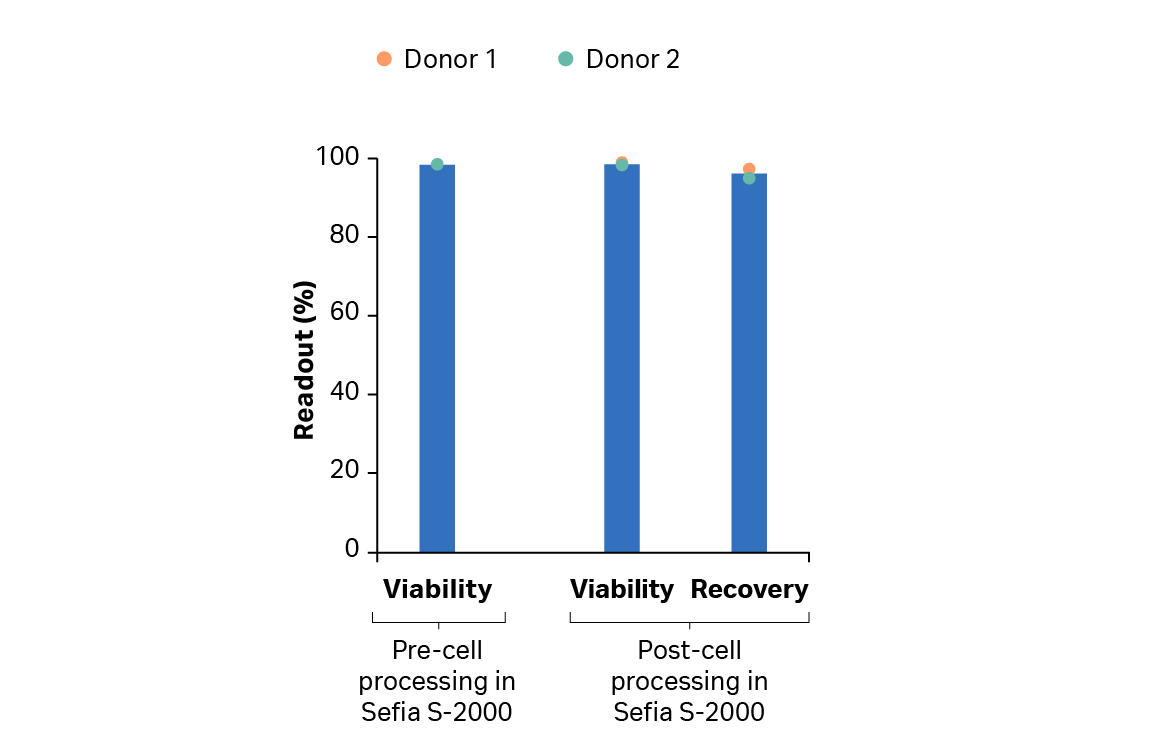
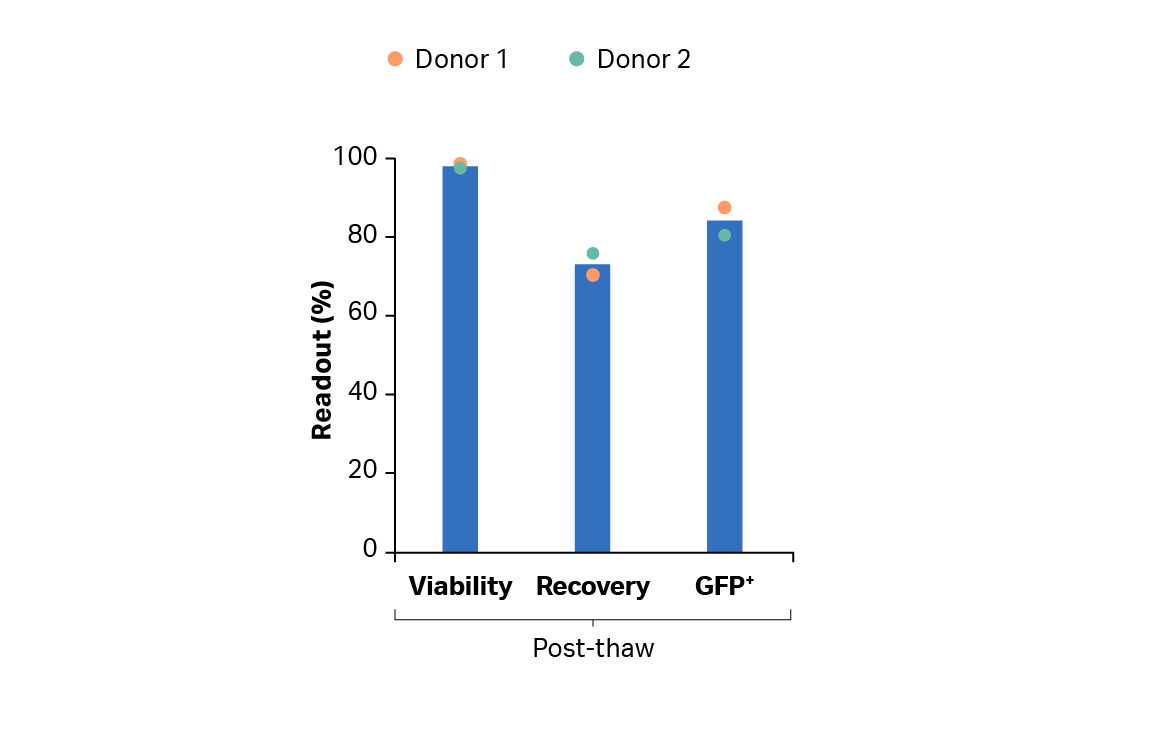
在扩增步骤后,我们使用 Sefia 系统来进行 T 细胞收获、洗涤和制剂。复苏率 > 90%(图 7)。VIA Freeze 系统进行了控速冷冻保存,复苏率 > 70%,解冻后活力 > 97%。结果还表明,在整个冷冻保存过程中,转导率保持在 80% 以上(图 8)。
图 7. 在 Sefia S-2000 仪器上使用 FlexCell 程序软件收获后,供体 1 和 2 的 T 细胞的复苏率和活力。
图 8. 在 Sefia S-2000 仪器上使用 FlexCell 程序软件进行冷冻制备后,冷冻转导 T 细胞解冻后的复苏率与活力。
总的来说,本文所述研究及其他的分析为半自动和封闭式 CAR T 细胞生产工艺的开发提供了信息(图 1)。
总结:商业 CAR T 细胞生产的工作流程
本文概述了高级 CAR T 细胞生产工艺的开发。手动、开放式和分离的单元操作已被支持自动化、封闭式和集成处理的方案所取代。
本研究展示了:
- 稳健的封闭式工艺和自动化策略,用于生产临床相关剂量的 CAR T 细胞。
- 灵活的端对端工作流程,不仅适合工业化自体 CAR T 细胞生产,还符合 GMP 要求。
阅读有关稳健 CAR T 细胞工艺开发的完整文章。