背景
许多基因疗法正在开发中,用于治疗遗传性疾病、癌症和其他疾病。截至 2020 年 3 月,全球已进行了 4310 多项基因疗法临床试验,其中只有 518 项处于 III 期和 IV 期(1)。随着基因疗法项目进入临床 Ⅲ 期或获准上市,病毒的大规模生产已成为基因疗法产业化的制约因素。
目前使用 HEK293 细胞转染生产腺相关病毒(AAV)和其他病毒是最广泛使用的系统。Cell Factory™ 系统可以通过增加培养或生产单元进行放大;但各板层与培养基层之间的气体交换并不一致。显微镜下观察细胞生长也极其困难,这大大增加了劳动强度、生产成本和污染风险 (2)。
悬浮培养是工业化生产中常用且便捷的方式。但是,贴壁细胞和悬浮细胞在培养过程中存在本质的差异,如细胞形态、代谢、生长行为等,会极大地影响目标产物的质量和产量。因此,建立一个大规模的 HEK293T 细胞培养工艺以用于病毒生产已变得越来越重要(3, 4)。
微载体是 60 到 250 微米的支持基质,允许贴壁细胞在悬浮系统中生长。微载体可由多种材料制成,包括葡聚糖、玻璃和其他合成聚合物。这些微载体材料可提供很大的细胞培养表面,从而实现更高的表面积与体积比。例如,5 mg Cytodex 提供的表面积为 30 cm2。这意味着一个 50 L 生物反应器使用 3 g/L 的 Cytodex 可提供与 94 个 10 层细胞工厂(细胞单层生长)相当的表面积。微载体培养结合了贴壁培养和悬浮培养的优点,实现了在贴壁状态下的细胞悬浮培养。此外,这种培养方式可以生产大量的细胞,而不需要大容量的设备。微载体培养可以在可放大性一次性生物反应器中进行,从而减少了劳动力需求和污染风险 (5)。
Obio Technology 公司的科学家们已经成功驯化了一种贴壁 HEK293 细胞系,可在无动物成分和无血清的悬浮条件下在摇瓶中生长。在针对 AAV 生产比较了贴壁培养、悬浮培养和微载体培养后,他们认为微载体培养适合大规模生产病毒载体,以支持未来的基因疗法的生产过程。
材料和方法
微载体制备
根据说明书,对Cytodex 1 微载体进行水合和消毒。将适量干燥的 Cytodex 1 微载体在 D-PBS 中以 50 mL/g Cytodex 1 水合。使用相同体积的 D-PBS 将水合的微载体洗涤一次,然后将其在 121°C 温度下高压灭菌 60 分钟。去除上清液,并用相同体积的 D-PBS 洗涤微载体。微载体沉淀后,去除上清液。每克微载体中加入 50 mL 含有 10% 胎牛血清 (FBS) 的 DMEM,然后在 37℃ 下孵育 4 小时后使用。
细胞制备
通过在 37°C 的水浴中快速解冻一小瓶冷冻的 HEK293T 来制备贴壁细胞。离心后,弃去上清液,用培养基重悬细胞团并转移到一个 T-75 培养瓶中。当培养物在生长 2 天后发生聚集时,用 D-PBS 洗涤后,重组酶分离细胞以进行细胞解离。然后将 T-75 培养瓶在室温下放置约 2 分钟。在 T 培养瓶中的细胞系扩增过程中,最常用于这些细胞系的继代培养比例为 1:4 到 1:6。
使用 HEK293T 细胞(这些细胞同时适应悬浮生长和化学成分明确的无动物成分培养基), 采用多步法,逐渐增加培养基的百分比并降低血清浓度,从而制备出悬浮细胞。所得 HEK293T 细胞在摇瓶中的无血清培养基中生长。
细胞培养物
对于微载体培养,将适量制备好的 Cytodex 1 与 HEK293T 细胞以 4 × 105 个细胞/mL 的接种密度接种到装有 125 mL 培养基的旋转瓶中。Cytodex 1 的终浓度为 3g/L。
对于贴壁培养,将 HEK293T 细胞以 4 × 105 个细胞/mL 的接种密度接种到装有 5 mL 培养基的 T-25 培养瓶中。接种后 24 h,当细胞富集超过 70% 时进行 AAV 转染。
对于悬浮培养,将 HEK293T 细胞以 2 × 106个细胞/mL 的接种密度接种到装有 20 mL 培养基的摇瓶中。接种后 1 至 4 小时进行 AAV 转染。
表 1 列出了微载体培养、贴壁培养和悬浮培养工艺的参数。
表 1. 三种培养工艺的参数
| 培养阶段 | 参数 | 培养工艺 | ||
| 微载体 | 贴壁 | 悬浮 | ||
| 细胞培养 | 培养罐体 | 旋转瓶 125 | T-25 | 培养瓶 125 |
| 培养体积 (mL) | 125 | 5 | 20 | |
| 细胞接种密度(× 106 个细胞/mL) | 0.4 | 0.4 | 2 | |
| 微载体浓度 (g/L) | 3 | 不适用 | 不适用 | |
| 培养时间 (h) | 24 | 24 | 1–4 | |
| 转染 | 转染培养基 | DMEM | DMEM | Opti-MEM™ |
| 骨架质粒、包装质粒、目标质粒、PEI 的比率 (µg/mL) | 1:0.5:1:2 | 1:0.5:1:2 | 1:0.5:1:2 | |
| 转染后至培养基置换的时间 (h) | 6–10 | 6–10 | 不适用 | |
| 收获 | 至收获的时间 (h) | 96 | 96 | 96 |
| 收获上清液还是细胞 | 两者均收获 | 两者均收获 | 两者均收获 | |
NA 表示不适用。PEI 表示聚乙烯亚胺。
AAV 转染
用表达绿色荧光蛋白 (AAV2-GFP) 的腺相关病毒载体转染所有三种工艺中的细胞。
当微载体上的细胞密度达到 1 – 1.5 × 106 个细胞/mL 时,通过停止旋转瓶上的搅拌器使微载体沉降。随后小心地通过倾析除去 80% 体积的上清液。然后将占起始培养体积 60% 的新鲜的完全培养基添加到微载体中。为了制备质粒和 PEI 混合物,在两个离心管中各加入 10 mL 的无血清培养基。将目标质粒、包装质粒和骨架质粒以1:0.5:1 (µg/mL) 的比率加入到一个管中。在另一个管中加入适量的转染试剂 PEI。让质粒混合物静置 5 分钟后,加入 PEI 管中的内容物,使质粒总量与 PEI 的比率达到 1:1 (µg/mL)。混合并静置 8 至 12 分钟后,将合并管中的内容物加入到旋转瓶中。转染后 6 至 8 小时进行培养基置换。
对于贴壁工艺,用上清液置换 80% 体积的完全培养基,20% 体积的 DMEM 用于制备转染溶液。其步骤与微载体培养的转染步骤相同。转染后 6 至 8 小时进行培养基置换。
对于悬浮工艺,使用 10% 培养体积的 Opti-MEM 培养基作为转染培养基。其步骤与微载体培养的转染步骤相同,不同之处在于转染后不进行培养基置换。
三种培养工艺的转染参数见表 1。
AAV 收获
对于微载体工艺,在转染后 96 小时将细胞收获到离心管中。将微载体静置 8 到 12 分钟以分离上清液和细胞(贴附在微载体上)。将细胞重悬于相同体积的 D-PBS 中。将细胞悬液(含微载体)进行三个冻融循环,并进行短暂离心以去除细胞碎片。在 37℃ 用 Benzonase™ 核酸酶 (Mg2+) 将样本消化 2 h。离心后,通过定量 PCR (qPCR) 方法测定细胞和上清液的滴度。
对于贴壁工艺,转染后 96 小时收获上清液,将细胞悬浮在相同体积的 D-PBS 中。从此处开始,步骤与微载体工艺相同。
对于悬浮工艺,转染后 96 小时收获细胞和培养基,并将细胞悬浮在相同体积的 D-PBS 中。从此处开始,步骤与微载体工艺相同。
三种培养工艺的参数见表 1。
生物反应器放大工艺确认
在 1 L 生物反应器中确认了生产 AAV 的参数(表 2)。
表 2. 生物反应器培养参数
| 搅拌速度 (rpm) | 曝气率 | 温度 (℃) | DO (%) | pH 值 |
| 62.5 ± 2.5 | 压缩空气:2% (12 mL/分), 氧气:自动 |
37 | 50 | 7.2 ± 0.15 |
结果
HEK293T 细胞在微载体培养和贴壁培养中的生长速度相似,倍增时间约为 24 小时。与 T 培养瓶相比,微载体培养中的细胞密度更高。三种培养工艺中转染后的 HEK293T 细胞形态见表 3。
表 3. 三种培养工艺的细胞形态和 AAV2-GFP 水平
| 培养工艺 | 光学显微镜 | AAV2-GFP |
| 贴壁 |  |
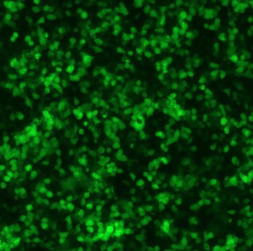 |
| 悬浮 | 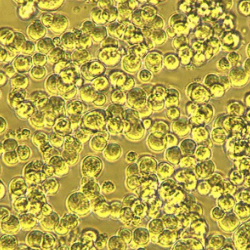 |
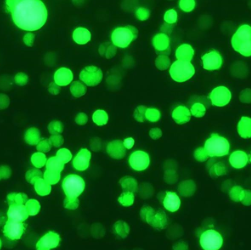 |
| 微载体 (旋转瓶) |
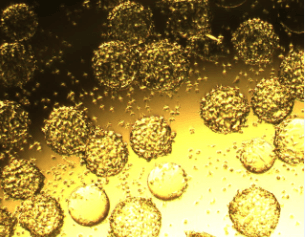 |
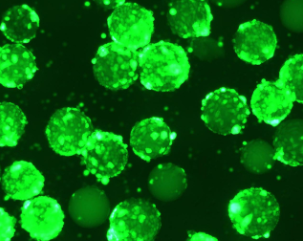 |
所有三种培养中的细胞和上清液的 AAV 滴度见图 1 和表 4。
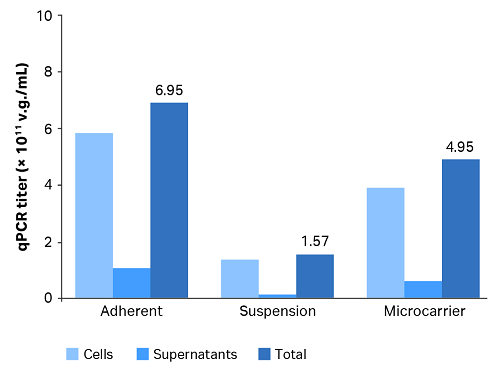
图 1. AAV 生产滴度。
表 4. AAV 生产滴度
| 培养工艺 | qPCR 滴度 (v.g./mL) | ||
| 细胞 | 上清液 | 合计 | |
| 贴壁 | 5.87 × 1011 | 1.08 × 1011 | 6.95 × 1011 |
| 悬浮 | 1.40 × 1011 | 1.67 × 1010 | 1.57 × 1011 |
| 微载体 | 3.95 × 1011 | 6.44 × 1010 | 4.59 × 1011 |
微载体培养和贴壁培养的总滴度分别比悬浮培养的总滴度高约 2.9 倍和 4.4 倍。
微载体培养工艺通过 1 L 生物反应器培养试验得到确认。关键参数和 AAV 滴度曲线分别见表 5 和图 2。随着培养时间的增加,上清液和细胞的滴度也随之增加。细胞曲线中该趋势更明显,96 小时时最高可达 3.3 × 1011 v.g./mL,120 小时时最高可达 4.5 × 1011 v.g./mL(通过 qPCR 测定)。
表 5. 1 L 生物反应器中的微载体工艺
| 培养阶段 | 条件 | 参数 |
| 细胞培养 | 接种密度(× 106 个细胞/mL) | 0.4 |
| 搅拌速度 (rpm) | 45 | |
| 培养体积 (mL) | 400 | |
| 微载体浓度 (g/L) | 3 | |
| 细胞培养时间 (h) | 24 | |
| 转染 | 骨架质粒、包装质粒、目标质粒、PEI 的比率 (µg/mL) | 1:0.5:1:2 |
| 转染后至培养基置换的时间 (h) | 6–8 | |
| 收获 | 至收获的时间 (h) | 48、72、96、120 |
| 收获上清液还是细胞 | 两者均收获 |
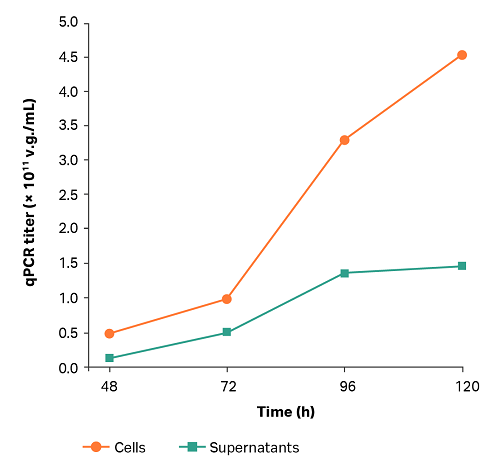
图 2. 1 L 生物反应器中微载体工艺的 AAV 滴度。
结论
这些结果表明,无论是在旋转瓶和在 1 L 搅拌罐式生物反应器中,微载体均可实现高 AAV 滴度。此外,数据表明所开发的微载体工艺适用于大规模 AAV 生产。
鸣谢
我们非常感谢 Obio Technology 公司的 Yongfa Lan、HaiRui Yang 和 QingRui You 授权我们分享他们的成果。
参考文献
- ClinicalTrials.gov database. NIH U.S. National Library of Medicine. https://www.clinicaltrials.gov/ct2/home. Accessed June 16, 2020.
- Yang J, Guertin P, Jia G, Lv Z, Yang H, Ju D. Large-scale microcarrier culture of HEK293T cells and Vero cells in single-use bioreactors. AMB Express. 2019;9(1). doi: 10.1186/s13568-019-0794-5. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6534633/
- Wang D, Tai PW, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 2019;18:358-378. doi: 10.1038/s41573-019-0012-9. https://www.nature.com/articles/s41573-019-0012-9
- Naso MF, Tomkowicz B, Perry WL, Strohl WR. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 2017;31(4):317-334. doi: 10.1007/s40259-017-0234-5. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5548848/
- Chen XY, Chen JY, Tong XM, Mei JG, Chen YF, Mou XZ. Recent advances in the use of microcarriers for cell cultures and their ex vivo and in vivo application. Biotechnol Lett. 2020;42:1-10. doi: 10.1007/s10529-019-02738-7. https://pubmed.ncbi.nlm.nih.gov/31602549/