我们将贴壁 HEK293T/HEK293 细胞在我们的 HyClone™ 转染培养基,HyCell™ Transfx-H 中进行悬浮培养。我们描述的实验在群体倍增时间、形态和活力方面揭示了有关细胞生长的信息,为未来使用一次性生物反应器进行可放大性生产提供了必要信息。
我们描述的瞬时转染方案的开发是通用的,可用于不同的腺相关病毒血清型。该策略是使用实验设计 (DoE) 方法来评估可能影响生产力的几个不同参数,并以病毒颗粒/L (VP/L)、病毒基因组/L (VG/L) 和完整衣壳百分比来衡量。
简介
病毒载体被越来越多地用于将基因移至特定组织或诱导细胞类型修饰。已经研究了数种病毒在细胞和基因疗法中的用途,其中重组腺相关病毒 (rAAV) 是最有希望用于基因疗法的载体。
细胞和基因疗法行业致力于采用现行药品生产质量管理规范 (cGMP) 进行高效的病毒载体大规模生产。为了满足 rAAV 临床使用的大批量需求,公司正从使用贴壁 HEK293 细胞生产转变为采用悬浮细胞培养的更具可放大性的技术。此外,瞬时转染方案也正在进行优化,以提高悬浮培养的规模和效率。
在此我们利用实验设计 (DoE) 方法来优化 HEK293T 悬浮细胞系统中的 rAAV 生产。经验证,一种高效、可放大的 AAV 生产的细胞培养工艺 — 最初使用 rAAV2 血清型作为 rAAV 的模型 — 也可以用于 rAVV5。
我们描述的实验分为两个步骤:
- 首先,我们描述如何使用新细胞培养基进行细胞驯化。我们通过这些实验从群体倍增时间 (PDT)、形态和活力方面对细胞生长情况进行评价。此外,我们的实验设计 (DoE) 可以评估多种因素的影响,例如质粒浓度、细胞密度和收获时间。这些因素可能是未来进行可放大性 AAV 生产的关键因素(从小规模的摇瓶到 25 L 一次性生物反应器系统)。
- 然后我们描述如何优化构成一次性生物反应器的放大 AAV 生产工艺基础的 AAV 瞬时转染。
为了生产 rAAV-2,我们使用了三重质粒转染系统为 HEK293 细胞和变体生产 rAAV-2 提供所需基因。第一种是携带 E2A、E4 和 VA 基因的 pHelper 质粒。第二种是用于特定血清型的复制和衣壳 (rep/cap) 质粒。第三种是带有目标基因(GOI – 本研究中采用的 GFP 基因)和反向末端重复序列 (ITR) 的质粒,用于维持病毒的感染能力(图 1)。
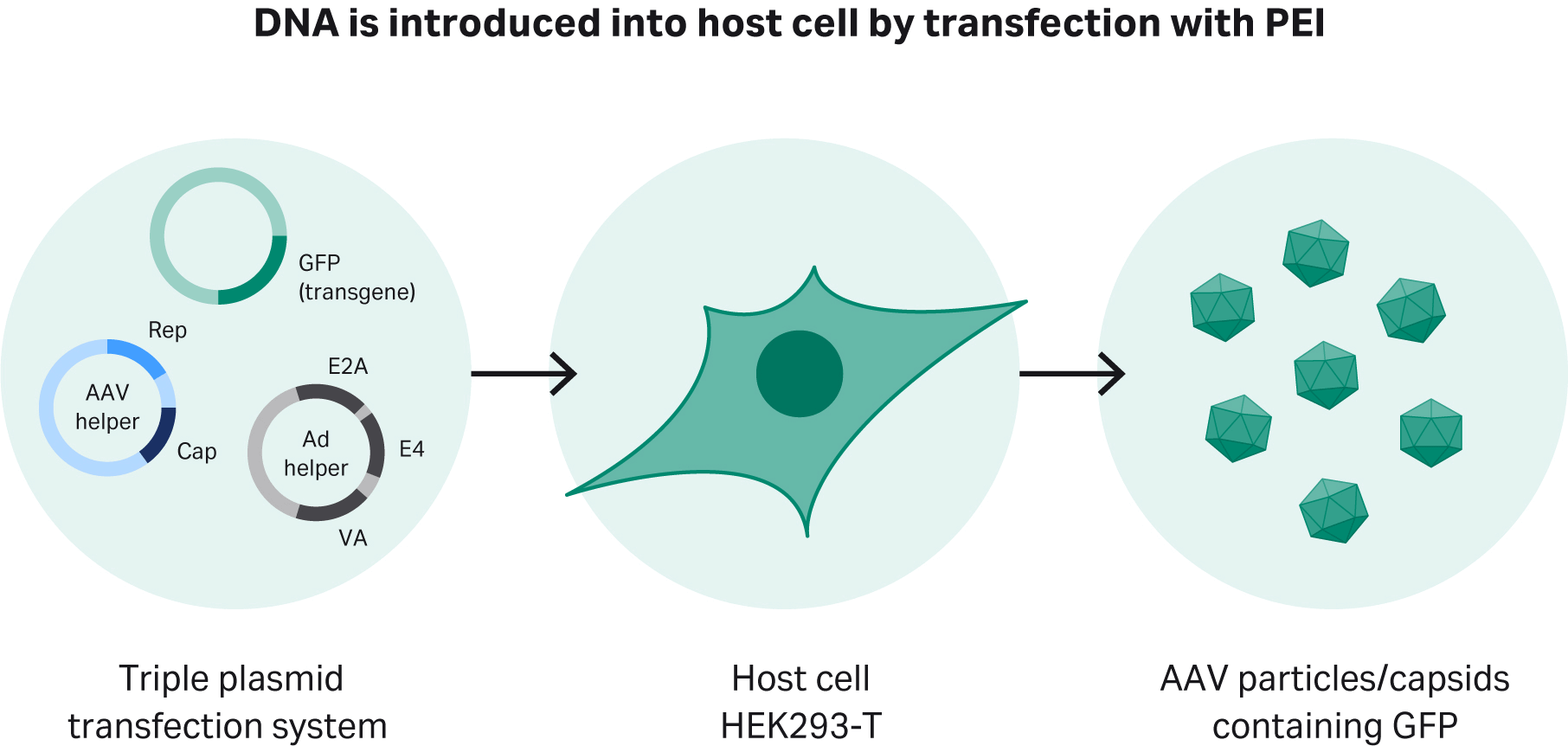
图 1. 使用三重质粒转染方法对驯化的 HEK293T 细胞进行瞬时转染。聚乙烯亚胺 (PEI) 首先与 DNA 形成复合物,然后进入宿主细胞。
图 2 所示是我们描述的该应用中 AAV 生产的上游策略。

图 2. 我们的策略是开发完整的 AAV 生产流程;我们在本文中详细介绍了细胞培养和转染的工艺开发。
详细的材料和方法见文末。
HEK293T 细胞在无血清 AAV 生产中的驯化
我们使用 HyClone™ 细胞培养转染培养基 HyCell™ TransFx-H 驯化贴壁 HEK293T 细胞。材料和方法中介绍了驯化的详细方案。同时,按照相同的策略用同样的培养基成功驯化了 HEK293 细胞(无 SV40 大 T 抗原)(未提供相关数据)。
将加入高糖和 10% HyClone™ 胎牛血清 (FBS) 的经典 HyClone™ DMEM 培养基培养的细胞直接移至新的转染培养基中,进行驯化。培养基中加入了 4 mM HyClone™ L-谷氨酰胺和 0.1% Pluronic™F-68 (Thermo Fisher Scientific™)。HEK293T 悬浮细胞在相应的无血清培养基中经过 10 次传代后,我们用显微镜评估了细胞的生长和形态。为了避免聚集体的出现和减小剪切力,我们从驯化开始就使用 Pluronic™-F68 并将细胞密度保持在 2.5 × 106 个细胞/mL 以下。
经 HyClone™ 培养基驯化的细胞符合我们设定的成功标准,即 < 10% 聚集(< 10 个细胞的小聚集体)且细胞生长旺盛。我们创建了研究细胞库和工作细胞库(分别为 RCB 和 WCB)。从创建的细胞库中解冻 HyCell™TransFx-H 培养基中的冷冻保存细胞(请参阅材料和方法)。
细胞库解冻与细胞生长比较
从细胞库中解冻细胞(请参阅材料和方法),进行接种,并每周两次传代培养。
图 3 所示为细胞形态的微观结果分析 (Evaluation)。大多数细胞是活细胞并且处于单细胞悬浮状态。

图 3. 在 HyCell™ TransFx-H 培养基中培养的 HEK293T 细胞的单细胞悬浮
种群倍增时间 (PDT) 平均约为 20 小时,图 4. 在 10 次传代中保持了良好的细胞活力 (> 97%)。
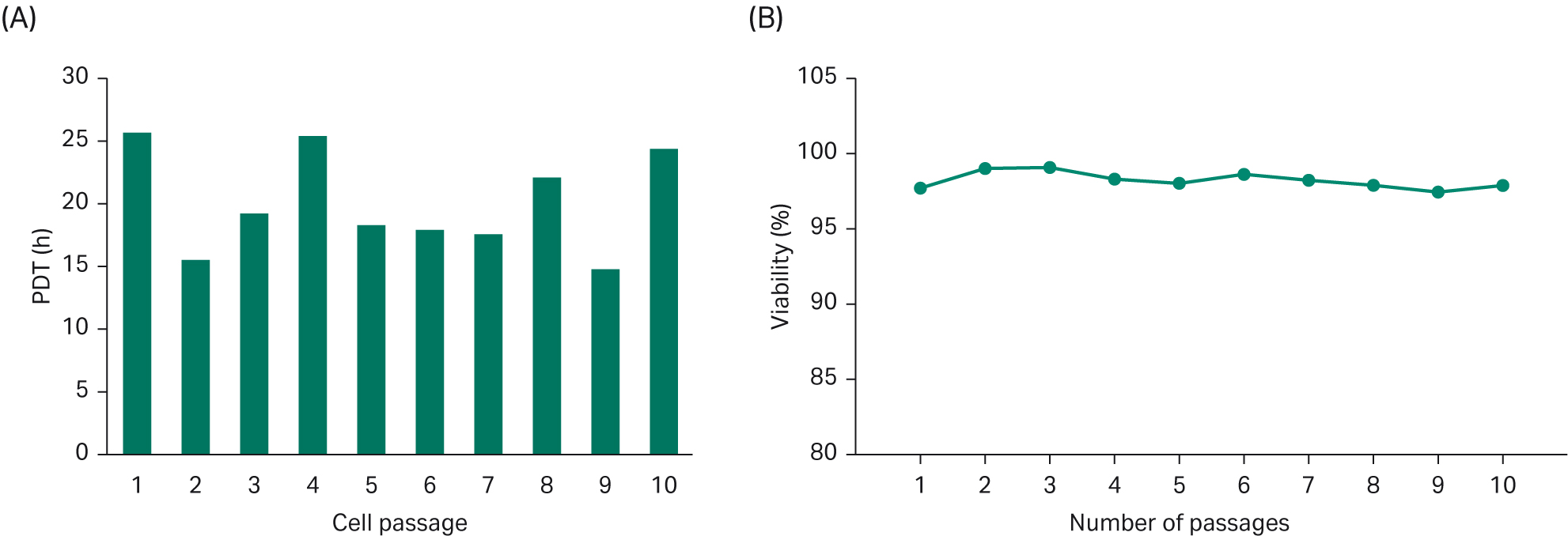
图 4. (A) 在 10 次传代中 HyCell™ TransFx-H 培养基中生长的细胞的群体倍增时间。(B) 10 次传代中的细胞活力。
利用质粒构建体进行 AAV 工艺开发
质粒构建体包含生产 AAV 所需基因和 DNA 序列,并在我们的工艺开发中采用,最初由 Nordic Biosite 提供。
AAV 生产中的质粒扩增通过使用质粒转化细菌来实现。随后在培养转化细菌时复制质粒 DNA。通过使用质粒纯化试剂盒,可以从收获的材料中回收大量的质粒 DNA。
实验设计 (DoE);使用 HEK293T 悬浮细胞优化的 rAAV 生产方案
进行了一系列实验设计 (DoE) 研究以评估转染的最佳条件。总共开展了五项研究,其中四项是针对 rAAV2 的。在我们的工艺开发过程中,目标是达到以下条件以满足下游工艺的要求:1014 个病毒颗粒 (VP)/L,1013 个病毒基因组 (VG)/L,以及收获材料中完整衣壳的百分比为 10% 及以上。实验设计 (DoE) 研究 1–4 表明我们无法满足 rAAV2 的所有要求,因此,对开发的转染方案进行了 rAAV5 测试。因此 DoE5 设计为一项验证研究,用于确认 rAAV5 生产的最佳 DNA 浓度和 DNA-PEI 复合物孵育时间。
DoE1
DoE1 研究了质粒 DNA 浓度、不同细胞密度、PEI/DNA 比率、转染体积和孵育时间(表 1)。为了验证不同条件的影响,对转染效率进行了研究。
表 1 DoE1 设置中使用的参数
| 活细胞密度 (VCD) 转染 (× 106/mL) |
DNA 浓度 (µg/mL) |
PEI/DNA (比率) |
转染体积 (占总体的百分比) |
孵育时间 (分钟) |
|---|---|---|---|---|
| 1 | 1 | 6 | 10 | 45 |
| 0.75 | 0.75 | 4 | 6 | 30 |
| 0.5 | 0.5 | 2 | 2 | 15 |
在瞬时转染中,PEI 将质粒 DNA 浓缩成带正电荷的颗粒,与阴离子细胞表面相互作用,PEI/DNA 复合物通过内吞作用进入细胞。PEI/DNA 的比例对转染效率起到关键作用。我们使用 MODDE™ Pro v12.0.1 软件 (Sartorius Stedim GmbH) 评估了 DoE 1 中的所有参数,该软件汇总并评估了所有数据。我们通过评估结果就能够预测出应该使用哪些参数来实现高转染效率(图 5)。
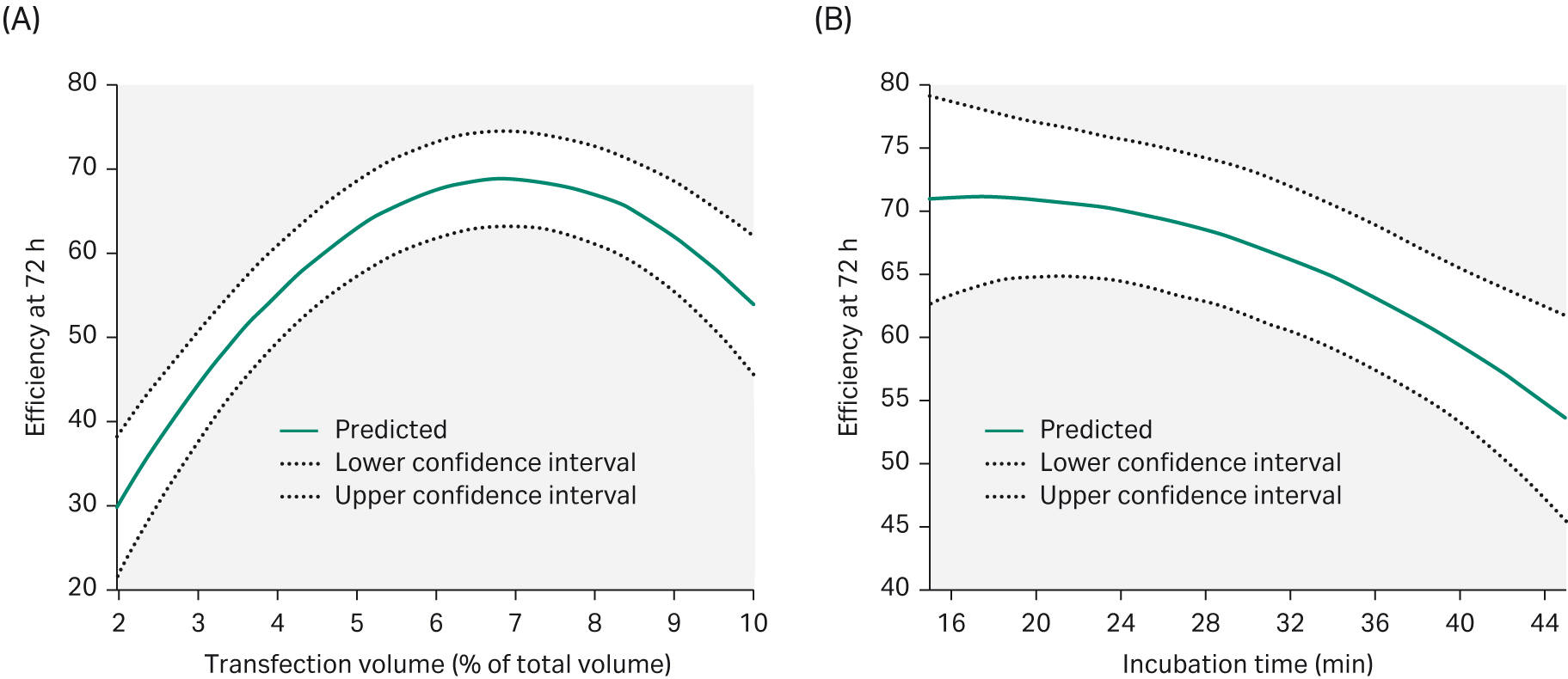
图 5. 要在转染后 72 小时后实现最佳转染效率,(A) 转染体积需要为总体积的 6%。(B) 增加转染孵育时间会对转染效率产生不利影响。
DoE2
根据 DoE1 的评估结果对第二部分 (DoE 2) 的以下参数进行了设置。在 DoE2 中研究和评估了温度和 DNA 质粒比率。
DNA 的最佳数量取决于转染质粒的特性(例如,质粒的大小、复制来源)。各种基因的份额也会影响产量,并对 pAAV-RC2 载体 (a)、pHelper 载体 (b) 和 pAAV-GFP 载体 (c) 进行了不同比例的测试。我们还评估了 rAAV 生产过程中不同温度下对转染效率的影响 — 温度分别为 34°C、35.5°C 和 37°C。
DoE1 和 DoE2 之间的差异在图 6 中用圆圈标记。
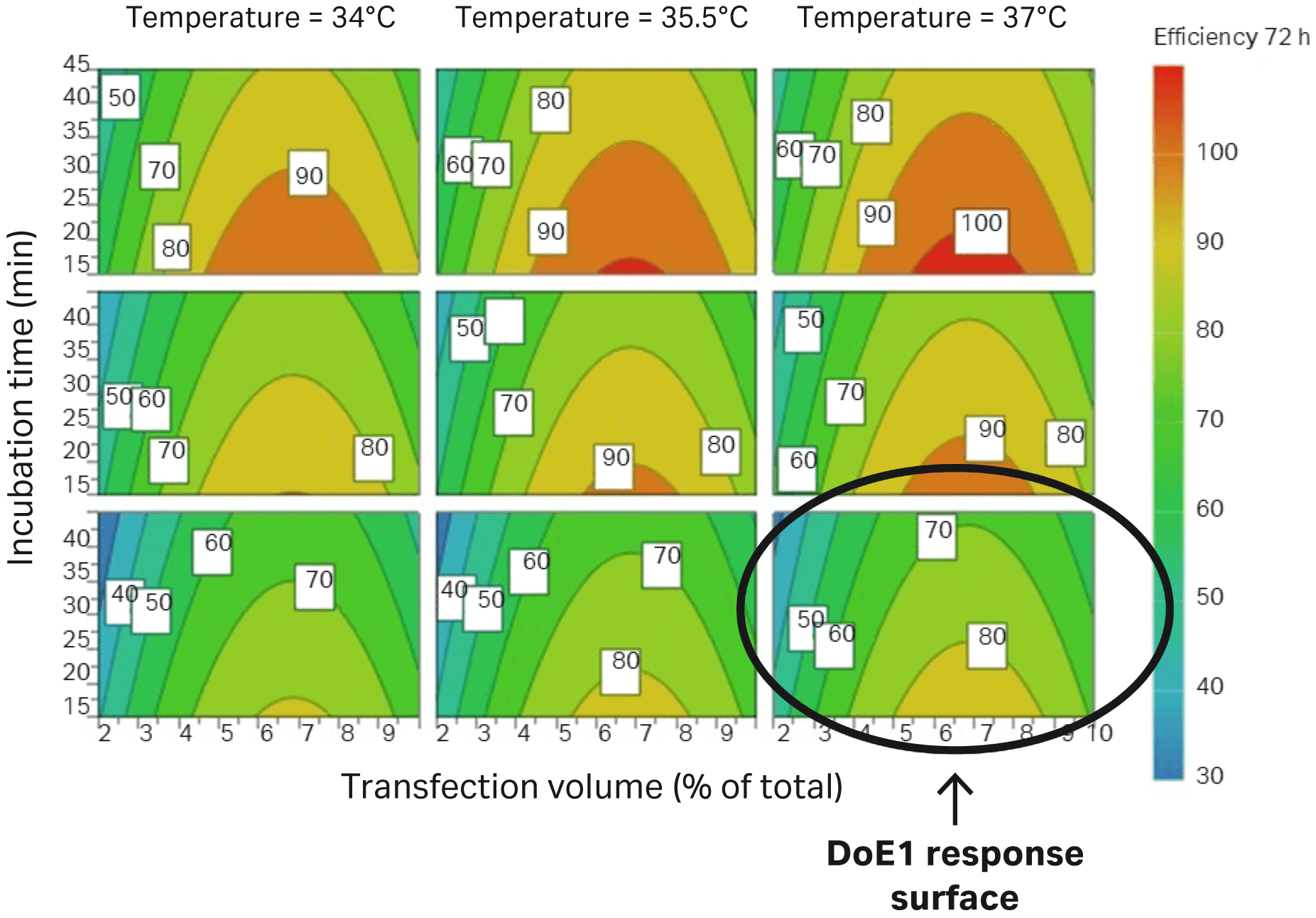
图 6. 与用圆圈标记的 DoE1 的参数相比,DoE2 中评估的参数与 HEK293T 细胞(GFP 表达细胞的百分比)的转染效率提高相关。
AAV 感染性和随后的 GFP 表达由转导测定确定。通过转导分析对裂解的样品进行定量,并通过流式细胞仪进行评估,由转导细胞表达 GFP 阳性细胞,并且使用结果计算感染滴度 (TU/mL)。这表明 DNA 比率差异与提高感染滴度有关。
DoE2 中基于转导测定的各种参数如图 7 所示。圆圈表示 DoE2 相较于 DoE1 的改进之处。
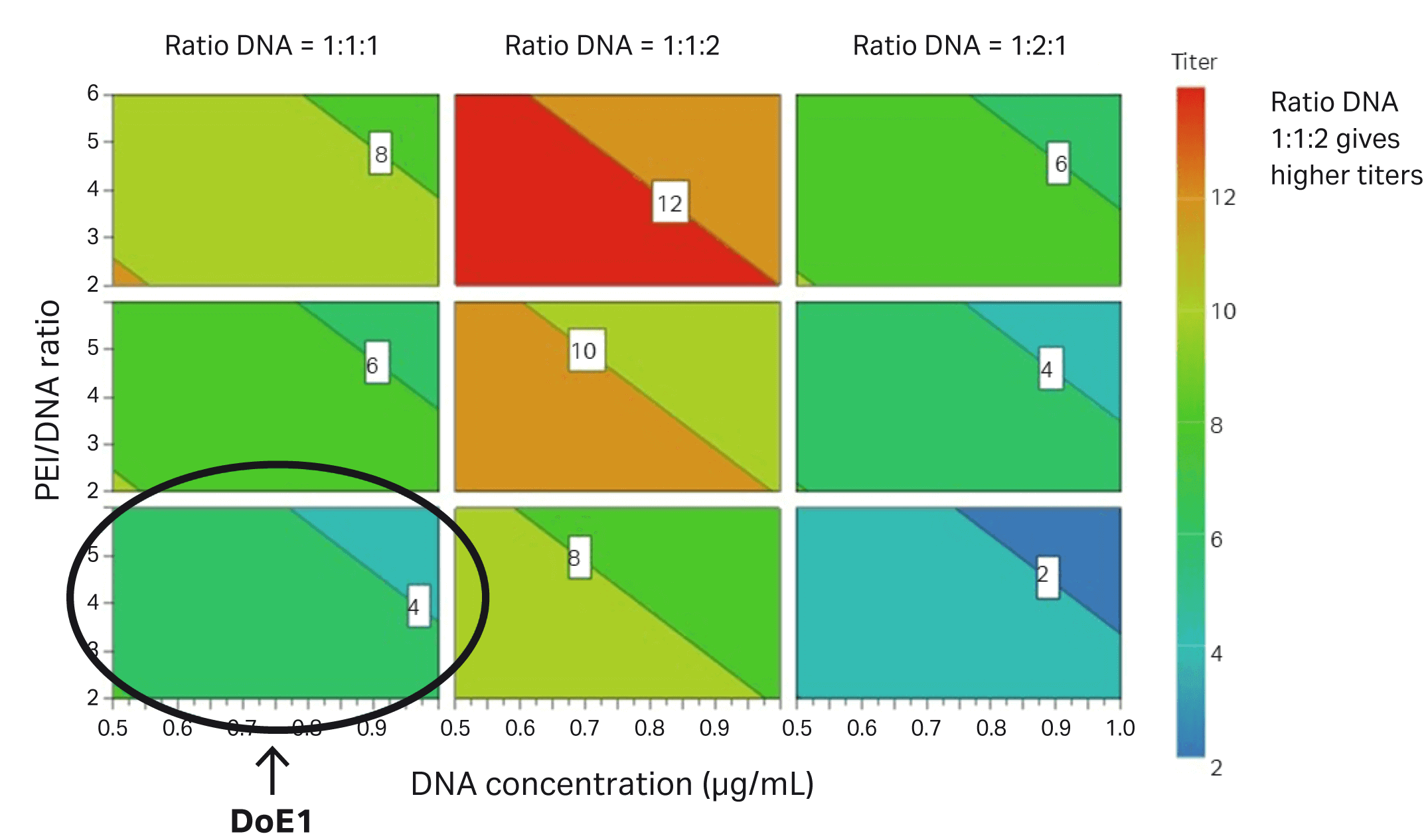
图 7. 在 DoE2 中评估的有助于提高 HEK293T 细胞感染滴度的参数。DoE1 中的条件被圈出,
DoE3
qPCR 可以帮助我们分析病毒基因组滴度。这对于进一步优化工艺和增加收获材料中完整衣壳的份额非常重要。通过比较 qPCR 的 VG 滴度数据 (VG/L) 与 ELISA 检测到的衣壳蛋白数量(衣壳/mL),可以估计完整衣壳的百分比。很明显,转染效率与病毒滴度(通过 ELISA 和 qPCR 测量)的相关性较差。
当 VCD 增加至 1 × 106/mL 时,病毒基因组滴度会有所提高。
DoE4
在下游纯化工艺中,完整衣壳的百分比和 VG 是有效分离完整衣壳的最重要因素。我们需要保证收获物中完整衣壳的百分比至少为 10% 才能进行 rAAV2 纯化。因此另外对 rAAV2 进行了一次实验设计 (DoE) 评估,这次研究了 DNA 浓度和收获时间 (ToH) 对生产过程中病毒基因组滴度和完整衣壳百分比的影响。
我们发现,尽管增加 DNA 浓度可以提高 VG 滴度,但会对完整衣壳的百分比产生不利影响(图 8)。我们发现,为了获得高 VG 滴度但同时完整衣壳的百分比达到 10% 及以上,DNA 浓度需为 0.75 μg/mL。
在这些条件下,收获时间对 VG 滴度和完整衣壳的百分比没有显著影响。
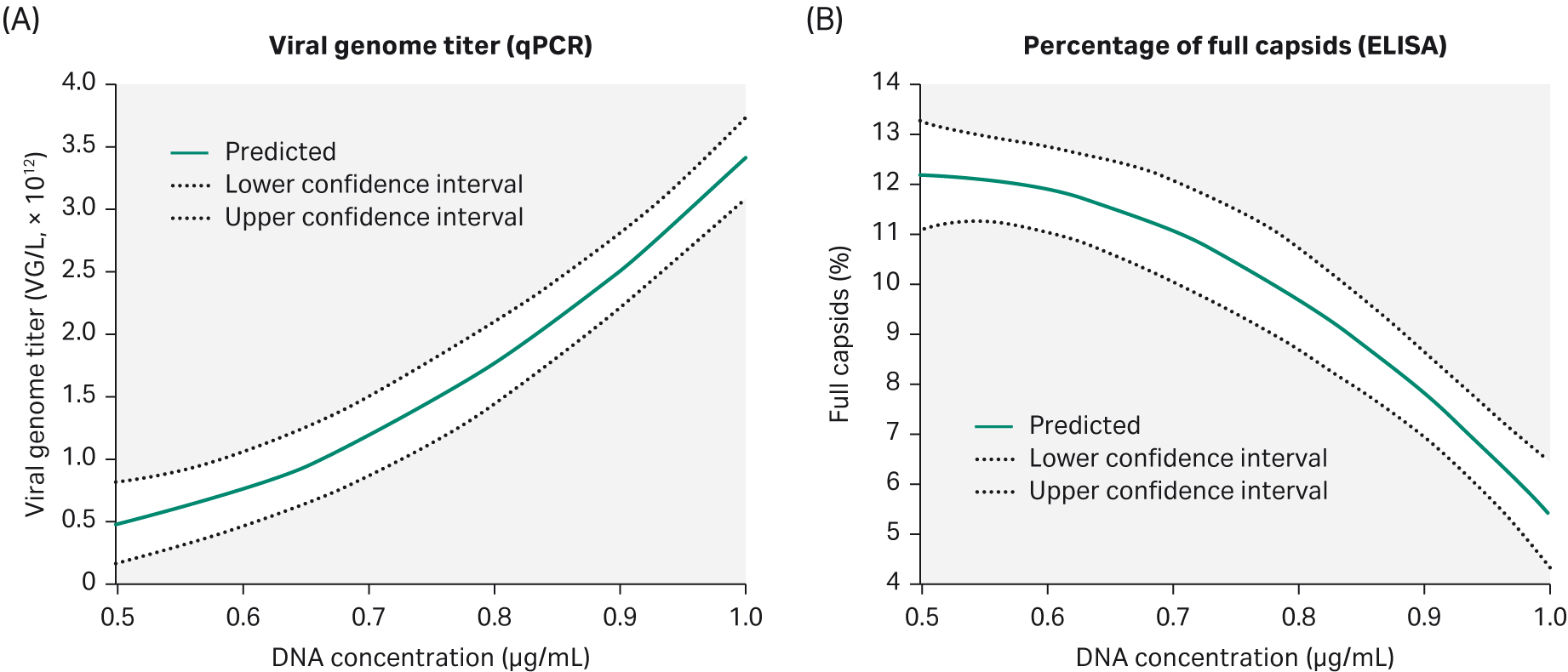
图 8. DoE4 中评估的参数表明,尽管增加 DNA 浓度会提高 VG 滴度 (A),但完整衣壳的百分比 (B) 会受到不利影响。
通过总结 rAAV2 实验设计 (DoE) 1–4 的结果,可以看出 VG 滴度和完整衣壳百分比随着时间的推移在逐步改善(图 9)。但是没有达到我们关于完整衣壳百分比的标准,大家普遍认为 AAV2 进行完整衣壳优化有难度。因此,我们决定对已确定的 AAV5(临床上另一个重要的血清型)的条件进行测试。
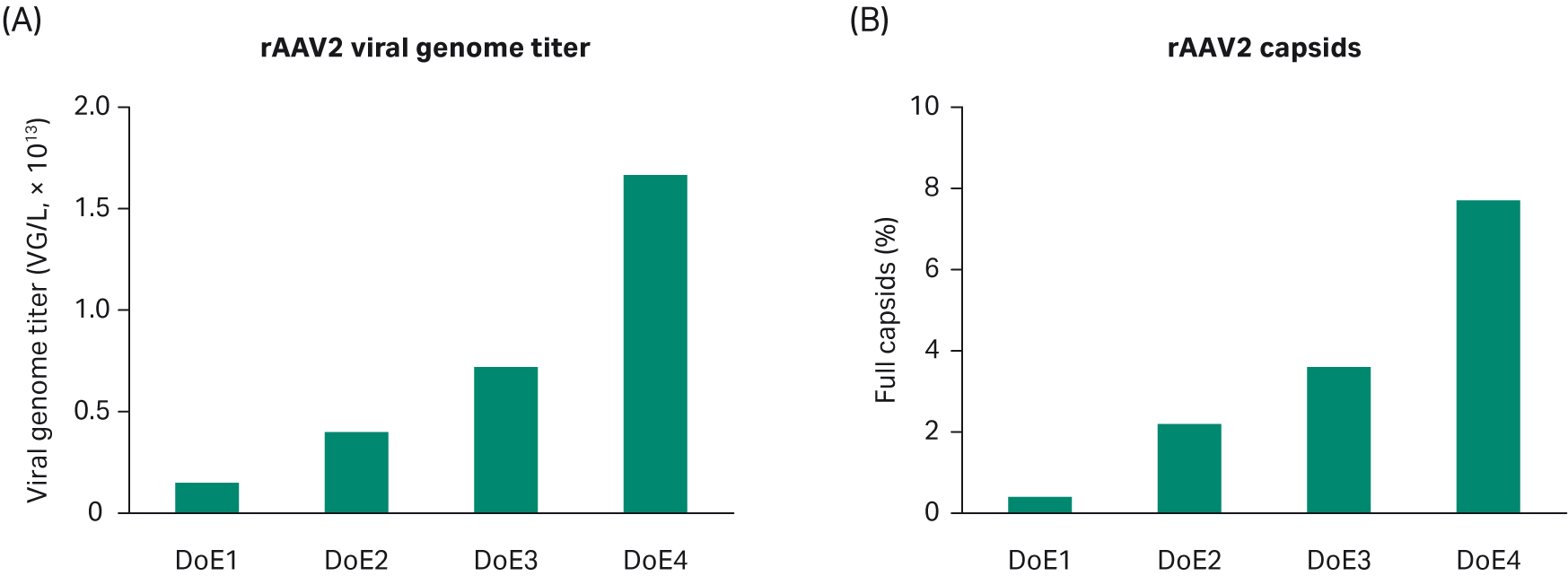
图 9. 实验设计 (DoE) 研究发现 VG 滴度 (A) 和完整衣壳百分比 (B) 随时间推移而改善。
DoE5
我们证实了我们的 AAV2 转染方案可用于 AAV5 生产。DNA 浓度和转染孵育时间这两个参数十分重要。结果证实了 DoE4 中的发现:增加 DNA 浓度可提高 VG 滴度并降低完整衣壳百分比;转染时间对 VG 响应的影响很小(图 10)。
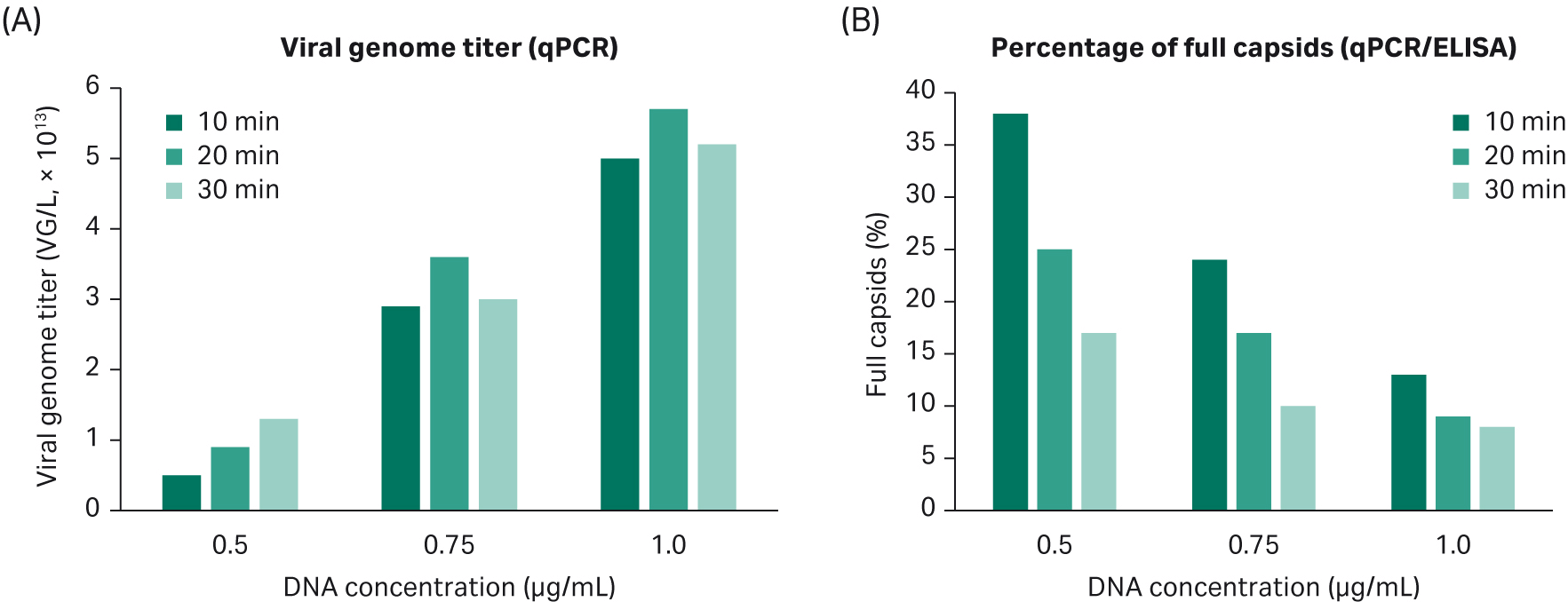
图 10. (A).增加 DNA 浓度可以提高 VG 滴度。转染孵育时间对 VG 响应没有显著影响。(B).增加 DNA 浓度会降低完整衣壳的百分比。使用低浓度 DNA 时,转染孵育时间对完整衣壳百分比的影响更大。
我们在实验设计 (DoE) 中进行了一项设计-空间优化模型测试,对获得 10% 或 15% 的完整衣壳百分比的概率进行评估。完整衣壳的百分比越高,用于选择转染参数的区域就越小(图 11)。
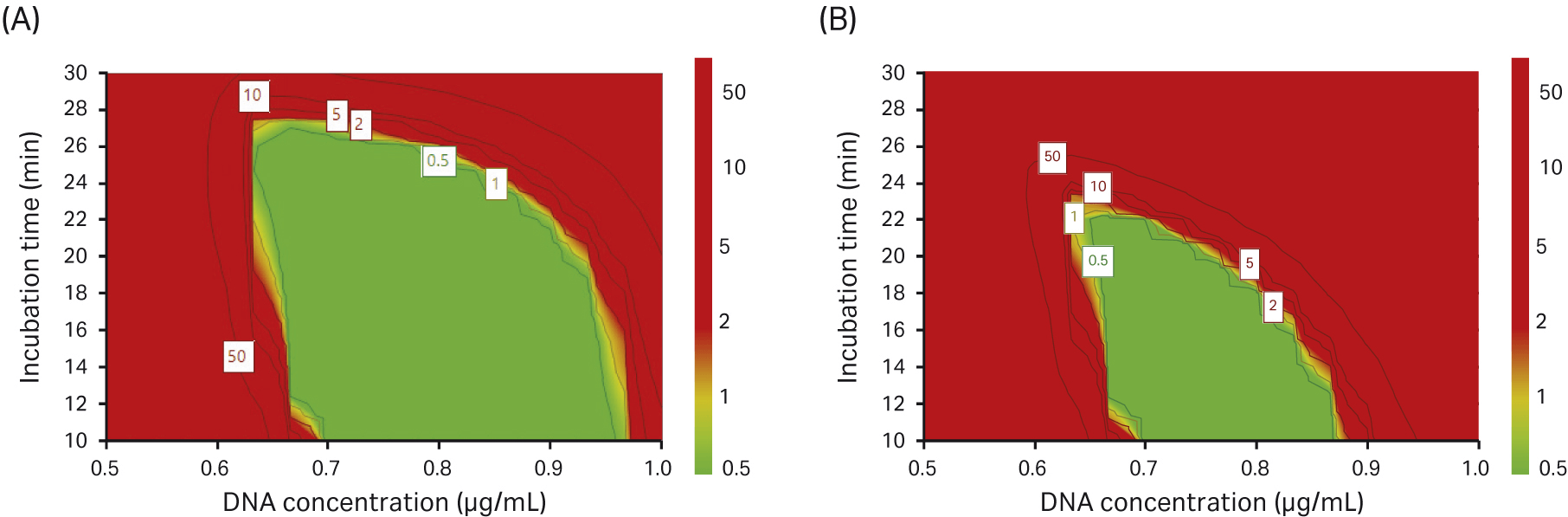
图 11. 我们用于研究达到 (A) 10% 完整衣壳百分比和 (B) 15% 完整衣壳百分比(绿色区域)概率的设计-空间优化模型。
在我们的实验设计 (DoE) 实验中,我们发现,高浓度的 DNA 可以提高 VG 滴度,并且转染孵育时间不会显著影响 VG 滴度。然而,通过查看完整衣壳百分比,我们却看到了相反的效果;通过降低 DNA 浓度和缩短孵育时间,可以提高完整衣壳的百分比。
总之,DoE5 研究中对 rAAV5 生产的验证表明,缩短转染孵育时间对完整衣壳的百分比有积极影响。根据实验设计 (DoE) 实验中的响应结果,我们得出结论,在转染过程中,DNA 浓度为 0.75 µg/mL,孵育时间为 15 分钟,这可能是测试条件下的最佳状态。
优化的转染方案
最终的转染方案和参数如下表 2 所述:
表 2. 转染方案采用的最终参数
| 参数 |
rAAV |
|---|---|
| VCD (× 106/mL) |
1 |
| DNA 浓度,总 DNA (µg/mL) |
0.75 |
| DNA 比例:a:b:c |
1:1:2 |
| a | pAAV-RC5 载体:1 |
| b | pHelper:1 |
| c | pAAV-GFP 载体:2 |
| PEI/DNA 比率 (µL:µg) |
2:1 |
| 转染体积 |
总体积的 5% |
| 孵育时间(分钟) |
15 |
| 温度转染 |
RT |
| AAV 生产温度 | 37°C |
| 收获时间 (ToH)(小时) | 72 |
为了确认转染孵育时间为 15 分钟的 rAAV5 生产转染方案,我们在 ReadyToProcess WAVE™ 25 生物反应器中进行了 10 L 生产。使用生物反应器进行的收获满足了下游工艺中进一步纯化的所有验收标准。
结论和讨论
我们使用 HyClone™ 培养基对 HEK293T 细胞进行了无血清悬浮生长驯化。通过直接移至新培养基中,可以在短时间内有效驯化细胞。细胞活力非常高,并且大多数细胞处于单细胞悬浮状态。细胞在 HyCell™ TransFx-H 培养基中快速生长,群体倍增时间约为 20 小时。快速的细胞生长将缩短种子细胞培养放大和生产所需的时间。
在驯化过程中,我们发现避免非常高的细胞密度很重要,因为这会导致聚集现象。一般来说,我们将细胞密度维持在 2.5 × 106 个细胞/mL 以下。细胞聚集体可能会降低转染效率并导致在放大生产规模中出现问题。重要的是,我们还确认了 HEK293 细胞也可以在具有类似的性能的 HyCell™ TransFx-H 培养基中驯化和培养。由于 SV40 大 T 抗原的存在,我们讨论了 AAV 生产的 HEK293T 细胞在法规上的可接受性。因此在许多情况下应首选 HEK293 细胞。
我们在 ReadyToProcess WAVE™ 25 中放大了 rAAV5 材料的生产规模,产生了高病毒滴度和高百分比的完整衣壳,而且工艺可放大并非常可靠。对生产 rAAV5 的 rAAV2 转染方案进行了验证,可以达到如下质粒纯化最佳标准:
- qPCR ≥ 1 × 1013 VG/L
- ELISA ≥ 1 × 1014 VP/L
- 完整衣壳百分比 ≥ 10%
在这些条件下完全符合 rAAV5 收获材料的所有标准。
因此,我们认为本文描述的优化转染方案适用于多种 AAV 血清型,并且可以放大到生产临床级 AAV 载体所需的体积。尽管我们在本文中描述的是针对 AAV 2 和 AAV 5 的优化,但该策略也已成功用于 AAV 8 和 AAV 9(目前正在进行中)。
HEK293T 细胞在无血清 AAV 生产中的驯化
将冷冻保存的 HEK293T 贴壁细胞放在盛有高糖 DMEM 并添加 10% 胎牛血清 (FBS) (HyClone™) 的 T75 烧瓶中进行解冻。
我们传代培养到 T225 烧瓶中,然后直接移至相应的不含血清的新培养基中。使用 250 mL 摇瓶和 40 mL 培养基,细胞密度为 0.2–0.3 × 106 个细胞/mL,具体取决于分裂间的天数。在 37°C 的温度和 5% CO2 条件下,在摇动培养箱里培养细胞,培养箱的转速为 135 rpm,半径为 50 mm。
细胞培养驯化方案
根据以下分步方案进行直接驯化。细胞培养基添加 0.1% 的 Pluronic™ F-68 (0.1%) 非离子型表面活性剂 (Thermo Fisher™ Scientific) 来减少聚集体数量和减小剪切力。
- 分离贴壁细胞,并以 150 × g 离心 5 分钟。在 5 mL 或 10 mL 的移液管中彻底搅拌细胞,大约 20 次后,使细胞重悬。
- 将细胞接种在 250 mL 的摇瓶中,细胞密度为 0.3 × 106 个细胞/mL,细胞体积为 40 mL。驯化期间,将体积维持在较低的水平以确保培养混合良好。
- 细胞每两天分裂一次。将团块彻底重悬以保持活细胞密度 (VCD) 低于 2.0–2.5 × 106/mL,避免出现聚集体。在过滤过程中,使用 40 µm 的网片来去除聚集体。
- 监测 VCD 和形态,并使用 NucleoCounter™ NC200™ 自动细胞计数器 (Chemometec) 对聚集体进行计数。
- 每个样品瓶有 15 × 106 个细胞,进行 10 次传代后,工作细胞库 (WCB) 得以创建。
请注意,驯化过程中的一个重要步骤是如何接种细胞并确保细胞培养混合良好。为了避免聚集体出现,我们从驯化开始就使用 Pluronic™-F68 并将细胞密度保持在 2.5 × 106 个细胞/mL 以下。为获得最佳细胞培养结果,应考虑培养体积与摇瓶大小的关系。
细胞库
使用比例为 1:1 的新鲜细胞培养基和冷冻培养基(HyClone™ 品牌 HyCryo 两倍干细胞冷冻保存培养基)对 HEK293T 进行冷冻保存,方法是在 150 × g、室温 (RT) 条件下离心 5 分钟后,进行细胞制粒。
在加入等体积的冷冻培养基之前,将细胞团块重悬在新鲜细胞培养基中。在 CoolCell™ (TATAA Biocenter) 中将 1 mL/冷冻管的等分试样(细胞密度为 15 × 106 个细胞/mL,)在 –70°C 的温度下冷冻过夜,并移至 –150°C 的冻存系统进行长期储存。
细胞培养
为进行细胞生长比较和维持培养,将细胞解冻并接种在加入 25 mL 的细胞培养基的 125 mL 体积中。细胞每周传代培养两次,接种密度为 0.2 × 106 个细胞/mL。细胞培养在 250 mL 摇瓶中进行,工作体积为 40 mL。使用 Vi-CELL™ Cell Analyzer (Beckman Coulter) 对细胞进行计数,并接种在有新鲜培养基的新摇瓶中(E125/E250 烧瓶)。培养基中加入了 4 mM L-谷氨酰胺和 0.1% Pluronic™ F-68。
质粒制备和纯化
本研究中用于转染的三种质粒构建体 — pAAV-GFP 对照载体、pHelper 载体和 pAAV-RC 载体 — 来自 Cell Biolabs。构建体用于转染、测序、在细菌中扩增,并使用质粒纯化试剂盒进行纯化。
使用 EndoFree™ Mega 质粒试剂盒 (Qiagen™) 或 Macherey-Nagel™ NucleoBond™ PC 10000 EF 试剂盒对质粒进行纯化。有关具体程序,请参阅供应商说明。每个质粒团块溶解于 0.75 mL 无菌 dH2O 中。
我们使用限制性酶切评估质粒质量,并在琼脂糖凝胶上分析片段。
图 12 所示为使用 Luria 液体培养基 (LB)、摇瓶和纯化试剂盒进行制备的概况。
图 12. 使用 LB、摇瓶和使用市售纯化试剂盒进行纯化的制备概况。
HEK293T 悬浮细胞在摇瓶中的转染
第 0 天:
- 以 1 × 106 个细胞/mL 的浓度接种细胞。根据细胞生长和聚集体情况,确保维持细胞处于良好状态。确保对细胞传代次数进行良好控制,请勿使用超过 40 次细胞传代的细胞。
- 计算转染用的质粒数量并使之标准化。对于需要转染的摇瓶 (20 mL) 培养物,在无血清培养基中制备 0.75 μ g/mL 的总 DNA,使其在 50 mL 离心管中达到最终体积的 5%,并通过移液混合。对于体积较大的培养物,应使用较大的转染管/容器。注意:只能使用聚丙烯制成的塑料,不可使用聚苯乙烯制成的塑料。
- 准备 PEI Max (Polyscience) 溶液 (1 mg/mL),并在使用前进行混合。
- 在步骤 1 中制备的 DNA 混合物中加入 x μL PEI(DNA:PEI 的比例为 1:2)(对于 20 mL 的培养物,使用 15 µg DNA 和 30 µL PEI)。通过轻弹试管或轻轻地来回旋转瓶子来混合溶液。
- 在室温下孵育 15 分钟。将 PEI/DNA 混合物缓慢加入细胞中,轻轻旋转烧瓶进行混合。
- 将烧瓶放回细胞培养箱(37°C、5% CO2)。
第 3 天:转染后 72 小时
- 收集样品并使用流式细胞仪检查转染效率。
- 向培养物加入 10% 的裂解缓冲液(1.65 M NaCl、5.5% Tween™ 20、11 mM MgCl2)来裂解摇瓶中的细胞并在 37°C 下混合孵育 20 分钟(将摇瓶放回 CO2 培养箱)。
- 将 40 U DNAase/mL(Denarase™,c-LEcta GmbH)加入裂解后的培养物中并在 37°C 下孵育至少 4 小时或在 CO2 培养箱中过夜。
- 将裂解的培养物以 850 × g 离心 10 分钟,对上清液进行等分,并在 –80°C 下储存。丢弃团块。
使用实验设计 (DoE) 评估 rAAV2 生产流程
我们使用实验设计 (DoE) 方法优化了在 HEK293T 悬浮细胞系统中生产 rAVV 的质粒转染方案,采用 HyCell™ TransFx-H 培养基。我们可以评估 50 种不同条件/参数对 rAAV 转染的影响。使用 MODDE™ Pro v12.0.1 软件 (Sartorius Stedim GmbH) 对实验设计 (DoE) 进行分析和评估。
在不同的部分设置实验设计 (DoE)。我们开始研究质粒 DNA 浓度、不同细胞密度、PEI/DNA 比率、转染体积和孵育时间的影响。我们继续使用上一项实验设计 (DoE) 中的固定参数,并将新参数添加到下一项实验设计 (DoE)。对温度以及 DNA 质粒比率进行了结果分析 (Evaluation)。
通过流式细胞仪 (BD Biosciences) 检测 GFP 表达细胞来评估转染效率和转导测定。病毒基因组(VG,完整衣壳)通过 qPCR (VG/L) 确定,总病毒颗粒滴度 (VP/L) 通过 ELISA (Progen) 确定。qPCR:ELISA 的比率用于估计完整衣壳的百分比。
表 3 所列为五项实验设计 (DoE) 研究的摘要,我们在 DoE5 中实现了完全优化的条件。
| 参数 |
DoE1 (AAV2) |
DoE2 (AAV2) |
DoE3 (AAV2) |
DoE4 (AAV2) |
DoE5 (AAV5) |
|---|---|---|---|---|---|
| VCD (× 106/mL) |
0.75 |
0.75 |
1 | 1 | 1 |
| DNA 浓度 (µg/mL) |
0.75 |
0.75 |
0.75 |
0.75 |
0.75 |
| DNA 比率 (pAAV-RC:pHelper:pAAV-GFP) |
不适用 |
1:1:2 |
1:1:2 |
1:1:2 | 1:1:2 |
| PEI/DNA 比率 (µL:µg) |
2:1 |
2:1 |
2:1 |
2:1 |
2:1 |
| 转染体积(占总体积的百分比) |
6 | 6 |
5 | 5 | 5 |
| 孵育时间(分钟) |
30 | 30 |
20 | 20 |
15 |
| 温度 |
RT |
RT |
RT |
RT |
RT |
| AAV 生产温度 (°C) |
37 | 37 |
37 |
37 |
37 |
| 收获时间 (ToH)(小时) |
72 | 72 |
72 |
72 |
72 |
| 分析结果 |
|||||
| 感染滴度 (TU/mL) |
7.0 × 105 |
1.4 × 106 |
不适用 |
不适用 |
不适用 |
| ELISA (VP/L) |
8.0 × 1012 |
4.4 × 1012 |
5.2 × 1013 |
1.2 × 1013 |
2.1 × 1014 |
| qPCR (VG/L) |
不适用 |
不适用 |
3.6 × 1012 |
1.3 × 1012 |
3.7 × 1013 |
| 完整衣壳 (%) |
不适用 |
不适用 |
7 | 10 | 18 |