为了确保层析填料功能正常和一致性,我们按照Cytiva全球质量体系的要求设计、检查、生产、检测和放行交付我们所有层析填料产品。
为了实现持续的产品改进,通过标准化的要求和质量程序管理Cytiva产品生命周期。Cytiva的业务通过ISO 9001和ISO 22301认证,并且在Cytiva全球质量管理体系下营运。
我们的客户出于对公共卫生的重大承诺,生产生物药物帮助挽救数百万人的生命。生物药物的生产过程十分复杂,最终产品的质量取决于同样一致的,高质量的关键生产部件。层析填料就是一个关键生产部件的例子。
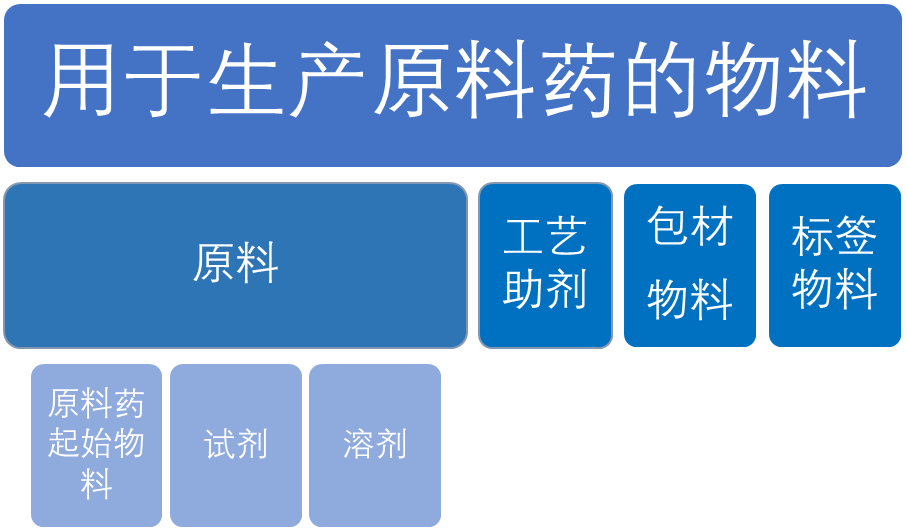
不同类型的物料用于生物药物和原料药的生产。原料药是指拟用于制造药品的任何物质或物质混合物,通过其药理活性或在诊断、治疗、缓解、治疗或预防疾病或影响身体结构和功能方面的其他直接作用成为药品的活性成分。
术语“原料”是指原料药生产过程中所使用的原料药的起始物料、试剂和溶剂。原料药 起始物料以重要结构片段的形式结合至 API 结构中。工艺助剂是用于制造原料药的物料,其本身不参与化学或生物反应(助滤剂、活性炭等)。我们的结论是,层析填料应被视为“工艺助剂”,用于生产原料药,但不被定义为原料。(ICH Q7)
Cytiva通过标准化的要求和质量程序管理产品生命周期。我们的层析填料供应政策是:未经客户同意,不得停止在经批准的注册过程中使用的任何产品。该政策同时规定,如果决定停止供应,有用户订阅了变更控制通知 (CCN)时,应使用三年的通知期。
作为世界领先的色谱树脂供应商之一,Cytiva的业务具备在监管环境中满足高质量工作需求的知识。我们还为在受监管环境中使用的产品提供法规支持文档。
法规支持文件 (RSF)
Bioprocess层析填料文件。有关性能、稳定性、可提取化合物和分析方法的详细信息。
变更控制通知 (CCN)
提供有关可能影响您的产品、流程、文档或程序变更的信息服务。 它提供信息作为您评估变更的基础。
检验报告 (CoA)
该证书详细说明 BioProcess 层析填料的放行标准。
材料安全数据表 (MSDS)
搜索我们完整的材料安全数据表 (MSDS) 数据库。
一般动物来源信息
在Uppsala的制造和研发场所按照第1069/2009号法规(EC)的规定在瑞典农业委员会注册为动物副产品和衍生产品管理机构。第1069/2009号法规(EC)规定了非人类消费的动物副产品和衍生产品的卫生规则。对于 TSE/BSE 相关物种的产品符合 EMA 410/01 当前修订版(欧洲药品管理局,关于通过人类和兽药产品传播海绵状脑病的风险最小化的指导说明。)要求。
法规 (EC) No. 1069/2009 中定义的安全采购适用于所有用作原料的动物衍生化学品或用于 BioProcess 层析介质的制造过程。 安全采购意味着仅使用对公众和动物健康没有不可接受风险的材料。
为了获得可靠的信息,我们与原材料供应商密切合作,收集有关原材料来源的信息。尽可能排除或替代动物源性材料。对于动物源性材料,始终要求提供以下信息:为了获得可靠的信息,我们与原料供应商密切合作,收集有关原料来源的信息。在可能的情况下,排除或替代动物源性材料。对于动物来源物料,始终需要以下信息:
- 使用的动物种类
- 使用的动物组织
- 动物原产国
- 符合 EMA410/0指南(如适用)的说明(如适用)
- 动物源性材料来自适合人类消费的健康动物的证明,即按照法规 (EC) 第 1069/2009 号的第 3 类材料。
- 提供相关信息以表明人体材料的来源安全。
容器材料
主要包装材料符合 FDA 标准,即美国联邦法规 CFR 第 21 条第 177 部分,间接食品添加剂:聚合物。
REACh
Cytiva 积极监控化合物和物品并按照监管要求采取行动,以实现业务可持续性并向客户持续供货。Cytiva 积极监控化合物和物品的监管要求并采取行动,以实现业务可持续性和持续向我们的客户供应。