作者 Tomas Björkman,Cytiva 资深科学家
我们使用精纯层析这一术语描述在生物制药生产的最后阶段去除少量杂质的过程。本文介绍精纯步骤设计过程中应考虑的因素,从基本问题到面临的典型挑战,均有涉及。
什么是精纯层析,何时需要使用精纯层析?
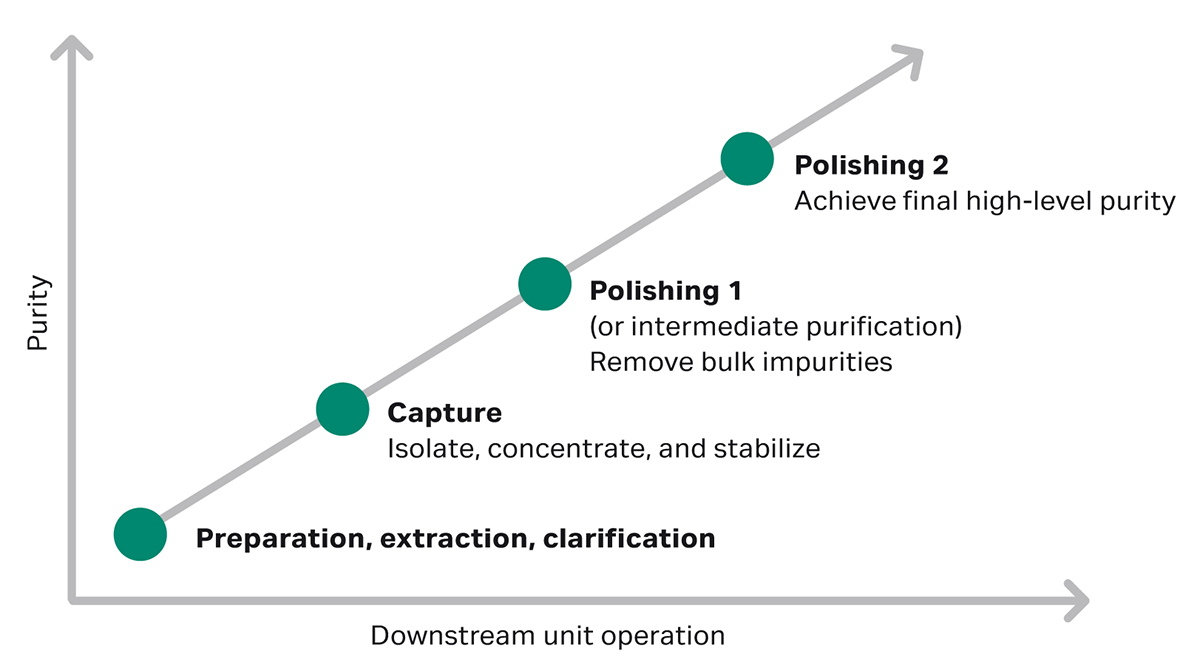
在生物制药生产的下游生物工艺阶段,层析捕获的第一步是将产品与大部分杂质(例如细胞培养基组分和蛋白酶)分离开来。第二步是精纯层析,即去除剩余杂质,获得更高纯度的目标分子(图 1)。
减少杂质最高效的办法是在开始纯化时尽可能地采用亲和步骤作为捕获的第一步。在单克隆抗体生产中,蛋白 A 亲和层析是广泛采用的捕获步骤。经过该第一步纯化后,纯度可以达到 95% 以上,这意味着只需进行有限的精纯即可进入最终的配制步骤。但是,大部分涉及抗体相关产品(mAb、双特异性抗体、Fab 片段)及其他重组蛋白的工艺在捕获步骤完成后,都需要至少两个精纯步骤。
对于部分其他类型的分子,有时可能无法获得所需的亲和层析溶液。目前尚无令人满意的溶液可去除纯化后所有的痕量标签蛋白,因此生物制造中基本不考虑采用标签蛋白质纯化。
如果无法获得目标分子纯化所需的亲和层析溶液,应设计第二步纯化以去除大部分工艺和产品相关杂质,例如高分子量 (HMW) 杂质、宿主细胞残留蛋白 (HCP) 和 DNA。如果捕获步骤不采用亲和层析,则捕获与最终精纯步骤之间的步骤也可称为“中度纯化”(图 1)。
在研究中,可能经过一步精纯就能获得所需的纯度。而在临床应用中,由于监管审批非常严格,需要将杂质降至痕量水平。此外,在病毒清除方面,必须能够证明在整个过程中病毒可以达到某个log降值。
多个层析步骤结合正交分离技术有助于减少病毒含量。
精纯步骤中需要去除的典型杂质有哪些?
- 产品相关杂质
- 宿主细胞蛋白 (HCP)
- DNA
- 之前捕获步骤中脱落的蛋白 A
- 病毒(病毒清除)
- 内毒素(如使用细菌表达系统)
精纯过程中采用的典型层析技术有:
- 离子交换层析 (IEX)
- 疏水层析 (HIC)
- 多模式(或复合模式)层析 (MM)
离子交换层析:精纯首选方式
IEX 所需的优化工作较少,因此通常是精纯的首选方式。另外,与疏水作用力及涉及的混合模式相互作用相比,静电相互作用明显更简单,因此 IEX 被认为比其他精纯技术更具可预测性。实际上,由于现代筛选工具和/或实验设计 (DoE) 方法的采用,MM 和 HIC 的可使用性已非常强。
对于 mAb 精纯,通常采用阳离子交换层析 (CIEX) 以在结合-洗脱 (B/E) 模式下分离目标分子,这种方法可以在上样过程中或清洗液组分中除去带负电荷的杂质,例如残留 HCP。CIEX 还能够在洗脱过程中分离抗体电荷异构体、脱落蛋白 A 和 HMW 分子(例如聚集体)。
大部分 mAb 都是比较基础的分子,因此可以采用阴离子交换层析 (AIEX) 在流穿 (FT) 模式下进行精纯。FT 模式下使用的条件可以促进病毒、DNA、酸性 HCP 与填料配基的结合,同时目标分子经层析流穿实现洗涤和收集 (1)。
有关 mAb 纯化的更多指南,请参见 mAb 纯化平台。
疏水层析和多模式层析
HIC 通常既可用于中间步骤,也可用于精纯步骤,因此我们可以充分利用它的可选择性。对于 mAb 纯化,通常在 FT 模式下使用 HIC。这种做法尤其适合去除聚集体等大分子。
对于采用 IEX(最好是 CIEX)捕获目标分子的应用(当无法采用亲和捕获步骤时),为了确保技术组合的正交性,通常选择 HIC 和/或 MM 作为中间步骤和精纯步骤。
许多工艺已开始采用复合模式层析取代传统的层析步骤。复合模式填料最常用于单一相互作用的填料无法提供目标结果或无法以合理成本提供目标结果的情况 (1)。
复合模式填料主要分为:MM AIEX 和 MM CIEX。这两种填料的优势在于:相对于普通离子交换,它们可在更高的电导率下结合。此外,MM AIEX 填料有时还可以在原料药的等电点 (pI) 以下结合。因此,MM 填料非常适用于以下情况:
- 样品的负载电导率对于传统离子交换填料来说太高
- 需要尽可能地减少纯化步骤时
- 需要单独的离子或疏水相互作用类型以外的其他选择。
虽然 MM 或 HIC 步骤的开发不如 IEX 简单,但也只需要几次高通量实验即可确定合适的条件,请参见下节了解详情。
平台方法使工艺开发变得更快,更具可预测性。平台通常包括某些标准操作程序 (SOP)、核对清单、设备、层析技术和需要使用的材料,包括层析填料。如果您需要纯化多种分子,那么对所有分子重复使用相似的方案可以节省时间。这是实现药物开发和生产标准化、简化精纯步骤开发的极好方法。
在层析填料方面,为应对纯化时出现的超出预期的挑战,务必准备一组备用的层析填料以便进行评估。请注意,当使用现有平台对同一类新目标分子进行纯化时,平台方法是获得所需材料纯度以用于后续研究的较好起点。但是,该工艺可能无法进行收率优化,从长远的经济层面来看,这一点不够理想。
最后,所有关键的质量属性必须达到规定水平。不允许纯度/安全性和有效性受到影响,但必须尽量权衡收率优化(从长远经济层面考虑)与上市时间要求。
必须对每个工艺进行彻底地表征,并充分了解工艺参数与产品关键质量属性之间的关系。对于非平台工艺的设计,最好先从仔细表征目标产品和杂质谱入手,然后进行风险评估,从而确定纯化工艺任务的优先顺序。
对于以实现高纯度和高收率为目标的优化,已经很好地确立了使用高通量技术的必要性。采用并行、小型化技术的好处在于需要的测试材料相对较少,但却能获得大量的信息。这些方法通常结合统计模型使用,可以提高对工艺的理解,但无法充分地解释结果产生的原因。为了深化理解,可以采用新兴的机理建模等先进方法。
mAb 纯化过程中精纯的目的是:
- 去除 mAb 聚集体
- 去除不必要的 mAb 电荷异构体或其他产品相关杂质
- 去除 HCP
- 去除捕获步骤中的脱落蛋白 A
- 去除宿主细胞 DNA
- 帮助进行病毒清除
典型的 mAb 纯化
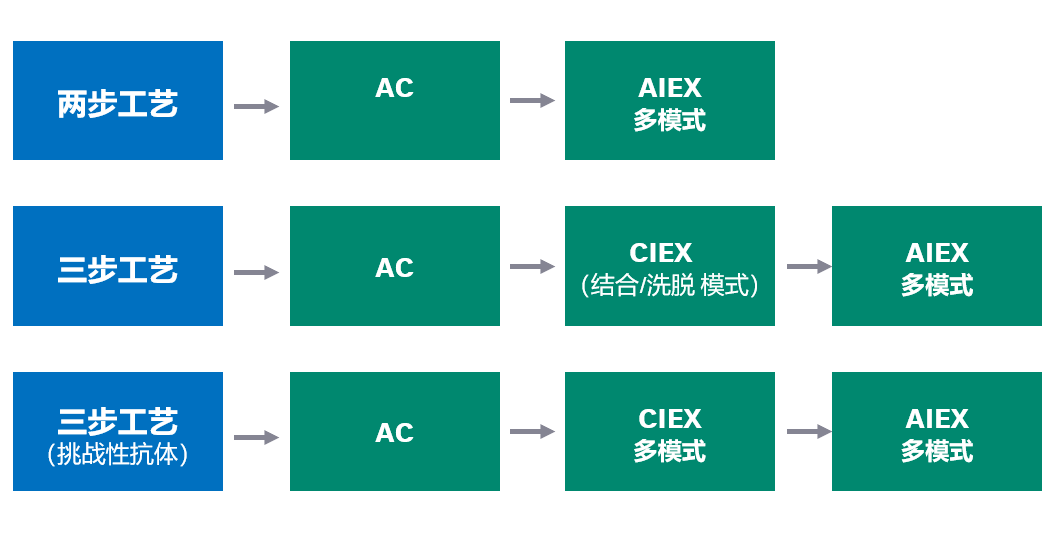
典型的 mAb 纯化平台首先进行亲和捕获步骤,然后是两个精纯步骤。这些精纯步骤通常采用 CIEX 和 AIEX(图 2)。
图 2. 包括一个亲和捕获步骤 (AC) 和两个精纯步骤(CIEX 和 AIEX)的单克隆抗体 (mAb) 层析填料平台示例。AC = 亲和层析。CIEX = 阳离子交换层析。AIEX = 阴离子交换层析。
其他 mAb 纯化工艺
对于部分 mAb,您可能需要调整图 2 所示的纯化方案。例如,如果需要提高性能,或者需要纯化的抗体与 AIEX 填料的 pH 值不相容,可以采用 MM AIEX 步骤(图 3)。
Fig 3. 关于如何使用多模式(复合模式)层析步骤调整层析纯化平台的示例。此处精纯步骤的顺序可以互换。
关于使用 HIC 进行 mAb 精纯
之前在蛋白 A 捕获步骤之后使用 HIC 进行 mAb 纯化的专利现已到期,现在允许在 mAb 精纯工艺开发中使用 HIC。HIC 可以高效去除聚集体。在高导电率下,HIC 还可以实现病毒清除。
对于生物类似药,上市速度甚至会更加重要。因此生物类似药制造商会尽量限制临床试验的数量。为此,工艺开发人员(及分析团队)需要证明电荷异构体图谱等相关参数与原研生物药之间的生物相似性。
上游工艺通常不同于原研生物药所使用的工艺(不同的细胞系),这通常会产生不同的杂质模式,即糖谱和电荷谱。糖谱在上游工艺中处理,而下游工艺必须考虑电荷异构体特征。如果电荷异构体特征不同于原研生物药的产品特征,在精纯步骤可能需要进行额外的优化工作,因而可能导致收率损失。在这方面采用实验设计 (DoE) 和机理建模方法可能会带来很大帮助。
最好的做法是将精纯步骤纳入平台方法中,这意味着它只需要进行有限的调整即可适用于多种药物。但是,如今的流程需生产更复杂、更加多样化的分子。对于其中部分新分子而言,平台方法无法满足所有需求,需要进行调整。因此,平台方法不会是单一的纯化平台,而是采取工具箱的形式以满足不同的设计要求。
下面介绍几个具有挑战性的分离示例。
低稳定性蛋白
需要纯化的分子类型及其总体稳定性会影响所采用的精纯方法与下游工艺。某些蛋白不能耐受低 pH 值,例如,在 AC 步骤之后进行洗脱时或当 pH 值接近蛋白等电点时,可能会形成聚集体。另一个示例是在高 pH 值下蛋白可能发生脱酰胺化。这可能会限制层析填料的选择,此时选择合适的填料变得愈发重要。
抗体衍生分子中产品相关杂质的去除
由于 mAb 样分子日趋多样化(例如双特异性抗体及其他抗体衍生分子),去除产品相关的杂质成为一项主要挑战。
以 bsAb 为例,四链抗体表达可能导致 10 多种不同抗体副产品的产生,它们的结构非常相似,包含错配体/同源二聚体或半抗体,以及轻链单体和二聚体。其中只有一种是所需要的分子,其他都是不需要的。
用于捕获的蛋白 A 亲和层析步骤有一个缺点,即所有分子变体(包括错配体/同源二聚体或半抗体)将与分子的 FC 部分发生相互作用并结合。因此,在许多情况下,这些分析变体无法与目标分子分离。如果使用 MabSelect™ PrismA 这类填料,有可能在捕获步骤中通过 VH3 相互作用(对于部分 VH3 序列而言)实现一定的选择性。
另外,您可能需要尝试其他亲和填料用于捕获(例如蛋白 L),或使用新型重组亲和配基来解决该问题。例如,如果分子中包含一个 kappa 轻链,可以使用蛋白 L。但是,为了区分错配的 bsAb,只能有一个半抗体中可以包含这种轻链。
尽管在捕获步骤中可以采取一定的办法来去除产品相关杂质,但为了确保获得好的去除效果,精纯填料和工艺条件的选择仍然非常重要。有时采用 MM IEX 有助于解决这一挑战。
本文提供了更多关于双特异性抗体纯化的见解。
抗体片段 (Fab) 中内毒素的去除
由于 Fab 具有非糖基化结构,它们可以在微生物细胞中产生,而不需要使用哺乳动物细胞。在大肠杆菌中产生 Fab 时,需要去除宿主细胞内毒素这种重要杂质。即便在捕获步骤中已去除了大部分的内毒素,要达到预期的内毒素去除水平,精纯过程仍然是必不可少的。例如,可以在下游使用 AIEX 填料或 MM 填料(例如 Capto™ adhere 填料)进行处理。请注意,使用能耐受高浓度 NaOH 的捕获填料(例如,如果产品具有 VH3 相互作用,可使用 MabSelect™ PrismA 填料)可以提高内毒素的清除效率。
本文提供了更多关于抗体片段纯化的见解。
抗体药物偶联物 (ADC) 的精纯
通过在抗体上偶联有效载荷(一种剧毒化学物质),我们可以靶向处理特定细胞。在这种应用中,抗体的作用是减少有毒物质对非靶向细胞的作用,从而最大限度地减少副作用。这些细胞毒性药物(有效载荷)的靶向递送,使它们在肿瘤学研究中具有非常积极的作用。
下游纯化面临的一项重要挑战是去除未偶联抗体、游离的细胞毒性药物,以及获得符合质量标准的药物抗体比 (DAR)。此外,有效载荷的大小和疏水性还可能导致 ADC 聚集体的产生。
由于有效载荷较小,并且相应的选择性变化较小,采用传统的层析填料去除这些杂质充满了挑战性。大部分未偶联有效载荷通常采用超滤作用去除。而 HIC 可以在精纯中成功地去除剩余的有效载荷杂质。不过 MM 有待进一步探索。
由于分子具有较高的毒性,应特别注意整个过程要在封闭系统中完成。此时采用一次性系统可能会具有重要价值。
病毒清除
即使有专门的病毒灭活或清除工艺步骤(例如病毒过滤、pH 值处理或溶剂/去垢剂),也应该采用层析步骤来帮助进行病毒清除。
在纯化工作流程中,为了达到预期的病毒log降值,可能需要采取按正交方式组合的额外层析步骤,从而导致这一工艺流程可能最终包含 4 个步骤。为防止发生这种问题,您应选择能够同时获得高产品质量与病毒清除率的填料。
部分考虑因素:
- 在 AIEX 层析中,病毒清除通常在低电导率下实现
- 在 HIC 中,病毒清除通常在高电导率下实现
- 采用 MM AIEX 层析法可在较大范围的电导率下实现病毒清除。例如,Capto™ adhere ImpRes 和 Capto™ adhere 填料已展现出良好的病毒清除能力。
流穿精纯步骤的好处
在流穿模式下目标分子不会结合,而是会直接流过或与填料发生弱的相互作用,而大部分杂质会发生结合。为此需要选择相应的条件(上样量、上样和缓冲液的 pH 值和/或电导率,或盐度)来调整目标分子或层析填料的电荷或疏水性。流穿模式的优势在于可以使用更高的上样水平、有可能减少纯化循环次数、减少洗涤需要并取消洗脱步骤 — 您只需关心最大收率与杂质的结合能力。
流穿组分中目的蛋白的纯度可以通过优化 pH 值、缓冲液、盐等条件来增加。可通过洗涤步骤收集弱结合的目标分子,从而提高目的蛋白的收率。在采用原位清洁 (CIP) 步骤之前,有时会利用洗脱步骤去除/洗脱部分结合杂质。
直通式处理 (STP)
下游层析纯化工艺的传统方法采用分批工艺,不同的单元操作之间采用贮罐存放中间液体。各单独的层析步骤(每个步骤需要从缓冲物质、pH 值、电导率方面进行优化)通常需要中间配液步骤。
为了取消或尽可能减少对储罐和批次配液步骤的需求,可以采用 STP 概念。STP 是在两个或两个以上层析步骤串联时(无论是否在层析柱之间对工艺条件进行在线调整),确保下一个步骤具有最佳的性能。为了省去中间的配液步骤,须选择上个步骤的洗脱条件,使其与下个步骤的上样条件相匹配。
填料差异对精纯工艺结果的可能影响
有时候,即使原材料处于制造商给定的质量标准范围内,但其内在差异可能仍会影响纯度、收率或生产率等工艺结果。如果原材料差异与工艺参数差异的影响之间存在相互作用,则这种情况愈加明显。由于受填料配基密度差异的影响,进行具有挑战性的纯化时尤其如此。现已确定填料差异更容易影响采用 HIC 和 MM 技术的工艺(影响大于采用 IEX 的工艺),以及采用结合/洗脱模式的工艺(影响大于采用流穿模式的工艺)。该问题可以通过全面的工艺表征与适当的控制策略来解决。但是,应当说明的是,绝大多数层析步骤本身对于填料属性的较小差异具有一定稳定性。
填料选择的重要性
与捕获纯化(主要采用快速、高载量洗脱步骤)相比,精纯纯化注重实现高分辨率,从而实现高纯度。因此,为了提高分辨率,精纯纯化采用平均粒径较小的层析填料。但是,减小粒径会导致背压升高。
现代填料(例如我们的 Capto™ 填料系列)显示出比早期 Sepharose™ 填料更高的刚性,因而可以提高流速和柱床高度的灵活性。
探索我们的精纯填料和应用